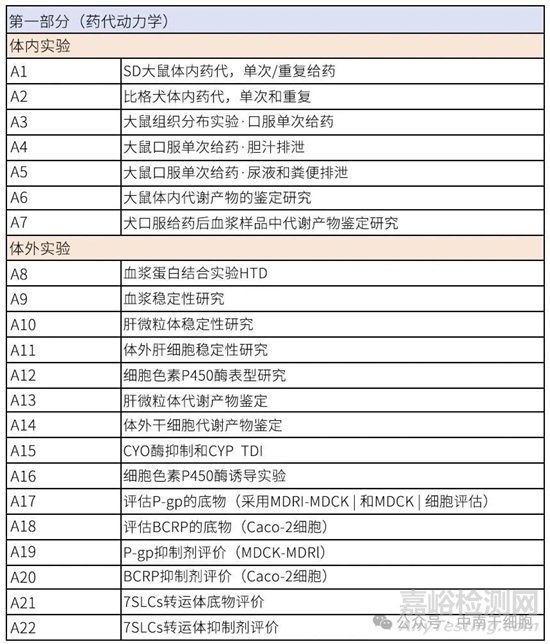
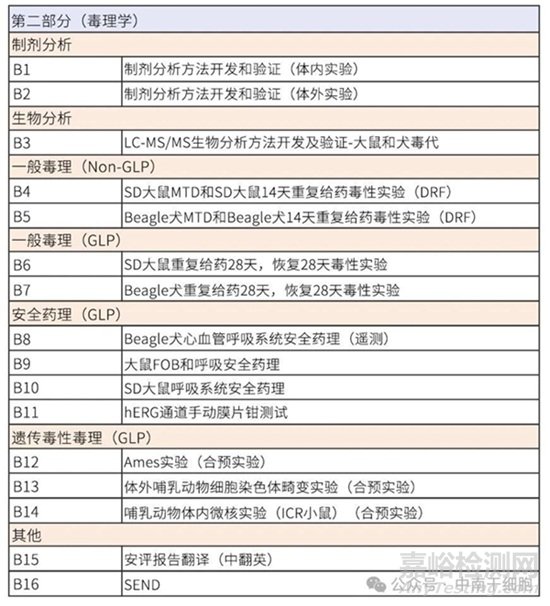
藥物研發(fā)進程中,非臨床藥理毒理評價是評估候選化合物安全性的基石�,為首次人體試驗(FIH)提供至關(guān)重要的科學(xué)依據(jù)。該評價體系需遵循《藥物非臨床研究質(zhì)量管理規(guī)范》(GLP)�,其核心在于系統(tǒng)揭示藥物的吸收�、分布�、代謝、排泄(ADME)特性及潛在毒性風(fēng)險�。不同類型藥物的研究策略雖有差異�,但核心評價框架保持一致�。
臨床前藥理毒理評價有哪些內(nèi)容�?
•《藥物非臨床研究質(zhì)量管理規(guī)范》(國家食品藥品監(jiān)督管理總局令第34號) 指出非臨床安全性評價研究,指為評價藥物安全性�,在實驗室條件下用實驗系統(tǒng)進行的試驗�,包括:安全藥理學(xué)試驗�、單次給藥毒性試驗、重復(fù)給藥毒性試驗�、生殖毒性試驗�、遺傳毒性試驗�、致癌性試驗、局部毒性試驗�、免疫原性試驗、依賴性試驗�、毒代動力學(xué)試驗以及與評價藥物安全性有關(guān)的其他試驗�。
單次給藥毒性試驗(急性毒性)
核心目標(biāo): 明確單次或24小時內(nèi)多次給藥后產(chǎn)生的急性毒性反應(yīng)特征及其可逆性,識別主要毒性靶器官。
核心價值: 為重復(fù)給藥毒性試驗的劑量設(shè)計�、臨床起始劑量選擇及急性中毒風(fēng)險評估提供關(guān)鍵參考�。
實驗設(shè)計: 需采用兩種相關(guān)動物種屬(特定情況如部分中藥可用一種)�、兩種性別、健康成年動物�。劑量設(shè)計方法多樣(如最大耐受量法�、固定劑量法、上下法等)�。觀察期通常不少于14天�,密切監(jiān)測臨床癥狀�、死亡�、體重變化�,終末進行大體解剖和組織病理學(xué)檢查。
關(guān)鍵產(chǎn)出: 最大無毒性反應(yīng)劑量(MFD)�、最大耐受劑量(MTD)�、劑量-反應(yīng)關(guān)系、靶器官初步判斷。
重復(fù)給藥毒性試驗(長期毒性)
核心目標(biāo): 全面描述動物長期重復(fù)暴露于受試物后的毒性反應(yīng)譜�,確定毒性靶器官�、劑量依賴性和時間進程�。
核心價值: 預(yù)測人體潛在不良反應(yīng)�、確定未觀察到有害作用水平(NOAEL)�、推導(dǎo)FIH的起始安全劑量范圍�。
實驗設(shè)計: 要求兩種相關(guān)種屬�、兩種性別動物�。設(shè)置低(通常接近或略高于預(yù)期有效暴露量)�、中、高(應(yīng)能誘導(dǎo)明顯毒性反應(yīng))劑量組及溶劑對照組�。給藥頻率通常每日一次�,試驗周期需覆蓋并支持擬開展臨床研究的期限�。監(jiān)測指標(biāo)全面�,包括行為學(xué)、攝食量�、體重�、眼科、體溫�、心電圖(ECG)�、臨床病理學(xué)(血液學(xué)、血生化�、尿液分析)及詳盡的組織病理學(xué)檢查�。
關(guān)鍵產(chǎn)出: 明確NOAEL�、毒性靶器官�、可逆性評估、安全范圍界定�。需結(jié)合毒代動力學(xué)(TK)數(shù)據(jù)進行綜合評價�。
核心目標(biāo): 檢測受試物是否引起DNA損傷及其固定�,評估潛在的致突變和致癌風(fēng)險�。
適用范圍: 中藥、天然藥物�、化學(xué)藥物基本要求�。
標(biāo)準(zhǔn)策略: 通常采用以下組合之一:
組合一: 細菌回復(fù)突變試驗(Ames試驗) + 體外哺乳動物細胞遺傳損傷試驗(如染色體畸變試驗�、微核試驗) + 一項體內(nèi)遺傳毒性試驗(通常為嚙齒類骨髓微核試驗)�。
組合二: Ames試驗 + 兩項使用不同組織的體內(nèi)遺傳毒性試驗(如骨髓微核試驗 + 肝臟彗星試驗)�。
關(guān)鍵產(chǎn)出: 綜合判斷受試物是否具有遺傳毒性潛力。
核心目標(biāo): 評估藥物對親代生殖功能(配子發(fā)生、交配行為�、受孕�、妊娠、分娩�、哺乳)及子代發(fā)育(胚胎-胎兒發(fā)育�、出生后生長發(fā)育直至性成熟)的潛在不良影響�。
核心價值: 是評估藥物生殖發(fā)育安全性的關(guān)鍵環(huán)節(jié)�,對臨床用藥人群(尤其是育齡人群)的風(fēng)險管理至關(guān)重要�。
試驗分期: 通常按生育力與早期胚胎發(fā)育(I段)、胚胎-胎仔發(fā)育(II段)、圍產(chǎn)期發(fā)育(III段)分階段進行�,覆蓋完整生殖發(fā)育周期。
關(guān)鍵考量: 需根據(jù)藥物特點、臨床適應(yīng)癥和擬用人群確定試驗策略和時機(參見ICH S5(R3)等指南)�。常伴隨TK研究(母體�、胚胎/胎仔、乳汁暴露)�。
安全藥理學(xué)
核心目標(biāo): 識別藥物在治療劑量及以上范圍內(nèi),對生理功能(特別是生命體征相關(guān)系統(tǒng))產(chǎn)生的非預(yù)期藥效學(xué)作用(不良反應(yīng))�。
適用范圍: 普遍適用于所有藥物(含生物制品)。
核心組合: 重點關(guān)注中樞神經(jīng)系統(tǒng)(FOB)�、心血管系統(tǒng)(清醒動物血壓�、心率�、ECG,體外hERG)和呼吸系統(tǒng)(頻率�、潮氣量等)的功能評價�。
實驗設(shè)計: 通常在清醒動物上進行�,單次給藥,劑量需涵蓋并超出治療劑量范圍以達到充分暴露�。根據(jù)核心組合結(jié)果或化合物特性�,可能需進行追加或補充試驗(如對泌尿、胃腸系統(tǒng)的影響)。
關(guān)鍵產(chǎn)出: 評估藥物對重要生命功能系統(tǒng)的潛在風(fēng)險�。
核心目標(biāo): 識別受試物在動物中的潛在致癌性,并評估其對人體的相關(guān)風(fēng)險�。
啟動依據(jù): 通?;陂L期用藥(≥6個月或頻繁間歇性長期使用)、特定擔(dān)憂因素(如陽性遺傳毒性結(jié)果�、明確免疫抑制或激素活性�、特定患者人群、高全身暴露�、結(jié)構(gòu)警示、光致癌潛力等)進行評估�。
實驗系統(tǒng): 首選大鼠�,通常需第二種嚙齒類(小鼠)�。特殊情況下可使用替代模型�。
關(guān)鍵產(chǎn)出: 評估腫瘤發(fā)生率�、類型�、潛伏期、劑量-反應(yīng)關(guān)系�,并與人體藥代動力學(xué)特征進行關(guān)聯(lián)性分析�,判斷人體風(fēng)險�。
局部毒性試驗
核心目標(biāo): 評估非口服給藥途徑(如注射�、皮膚�、粘膜、眼�、吸入等)對用藥局部組織產(chǎn)生的刺激性、腐蝕性�、過敏性反應(yīng)�,以及對全身產(chǎn)生的過敏性、溶血性等不良反應(yīng)�。
關(guān)鍵內(nèi)容: 局部刺激性/過敏性試驗�、全身過敏性試驗�、溶血性試驗�。
關(guān)鍵產(chǎn)出: 明確給藥途徑相關(guān)的局部和全身安全性風(fēng)險。
免疫原性試驗
核心目標(biāo): 評估治療性蛋白�、多肽及其衍生物(如抗體偶聯(lián)藥物ADC)誘發(fā)抗藥抗體(ADA)的能力及其潛在后果(如中和活性、過敏反應(yīng)�、影響藥效/清除)�。
研究重點: ADA的檢測與表征(發(fā)生率�、滴度�、持續(xù)時間�、中和能力)�。
檢測策略: 采用層級化的分析方法(篩選�、確證、滴度測定�、中和活性分析),常用方法包括橋聯(lián)法�、直接法等。
關(guān)鍵產(chǎn)出: 評估免疫原性風(fēng)險及其對臨床安全性和有效性的潛在影響。
依賴性試驗
核心目標(biāo): 評估藥物產(chǎn)生精神依賴(渴求)和軀體依賴(戒斷癥狀)的潛力,警示潛在濫用傾向�。適用范圍: 主要針對作用于中樞神經(jīng)系統(tǒng)(CNS)的藥物。
評估策略: 早期評估(結(jié)構(gòu)分析�、靶點預(yù)測、PK特性)結(jié)合依賴性行為學(xué)試驗(藥物辨別�、自身給藥�、戒斷評價)�,常用大鼠模型�。
實驗設(shè)計: 通常設(shè)陽性/陰性對照,在最高預(yù)期人體治療劑量Cmax附近設(shè)置劑量�,在藥物達峰時間(Tmax)附近觀察行為學(xué)變化。關(guān)鍵產(chǎn)出: 判斷藥物的依賴性潛力等級。
毒代動力學(xué)
核心目標(biāo): 在毒性試驗中同步測定受試物在動物體內(nèi)的全身暴露水平(AUC, Cmax等)及其持續(xù)時間�,建立暴露量與毒性效應(yīng)的關(guān)系�。
核心價值: 解釋毒性反應(yīng)�、支持種屬選擇合理性、優(yōu)化給藥方案�、量化靶器官暴露�、橋接動物與人體安全性(為FIH劑量選擇提供依據(jù))�、指導(dǎo)臨床安全監(jiān)測�。
實施要點: 伴隨主要毒性試驗(尤其是重復(fù)給藥毒性試驗)進行�,關(guān)注關(guān)鍵參數(shù)(AUC0-t, Cmax, C(time))�,確保分析方法可靠�。
關(guān)鍵產(chǎn)出: 暴露量-毒性關(guān)系分析�,支持非臨床到臨床的安全性轉(zhuǎn)化�。
支持IND申報所需的試驗
支持IND申報的關(guān)鍵非臨床研究概覽
為成功提交IND申請�,需整合并提供以下關(guān)鍵非臨床研究數(shù)據(jù):
藥理學(xué): 體內(nèi)外主要藥效學(xué)(作用機制驗證�、概念驗證POC)�。
分析學(xué): 經(jīng)過驗證的藥物制劑分析方法和生物樣品分析方法�。
藥代動力學(xué): 全面的體內(nèi)ADME研究及體外代謝/相互作用研究�。
毒理學(xué)(安全性評價核心):
安全藥理學(xué)(核心組合:CNS�、心血管�、呼吸系統(tǒng))�。
一般毒性試驗:劑量范圍探索試驗(DRF)及符合GLP規(guī)范的單次和重復(fù)給藥毒性試驗(試驗期限不短于擬開展的臨床研究給藥期)。
遺傳毒性試驗(標(biāo)準(zhǔn)核心組合)�。根據(jù)藥物特性和臨床計劃�,可能需要的其他試驗(生殖毒性早期試驗�、局部耐受性、免疫原性�、依賴性潛力初步評估等)�。
制劑安全性: 根據(jù)給藥途徑和制劑類型�,完成相應(yīng)的局部耐受性/刺激性/過敏性等試驗。
總結(jié)
非臨床藥理毒理評價是一個系統(tǒng)�、嚴(yán)謹且高度法規(guī)化的過程。通過精心設(shè)計和執(zhí)行上述關(guān)鍵研究�,旨在全面闡明候選藥物的安全性特征,識別潛在風(fēng)險點(毒性靶器官�、安全范圍、特殊毒性如遺傳�、生殖�、致癌�、依賴風(fēng)險等),并利用毒代動力學(xué)數(shù)據(jù)建立動物與人體暴露關(guān)聯(lián)�,為首次人體臨床試驗的安全啟動奠定堅實的科學(xué)基礎(chǔ)�,最終保障受試者安全。各項研究的具體實施需嚴(yán)格遵循國內(nèi)外相關(guān)技術(shù)指導(dǎo)原則的要求�。
支持IND申報的非臨床研究主要清單
|
研究類別 |
核心目的/內(nèi)容 |
關(guān)鍵產(chǎn)出/目標(biāo) |
|
體內(nèi)外藥理學(xué) |
|
|
|
分析方法開發(fā)與驗證 |
藥物制劑分析�、生物樣本(如血漿)中藥物及代謝物定量分析方法 |
確保數(shù)據(jù)準(zhǔn)確可靠的關(guān)鍵前提 |
|
藥代動力學(xué)(PK) |
體內(nèi)ADME過程�、體外代謝(酶抑制/誘導(dǎo))及轉(zhuǎn)運體研究 |
闡明藥物體內(nèi)過程�,預(yù)測潛在相互作用 |
|
安全藥理學(xué)(核心組合) |
中樞神經(jīng)系統(tǒng)�、心血管系統(tǒng)、呼吸系統(tǒng)功能影響 |
評估對生命維持關(guān)鍵系統(tǒng)的潛在風(fēng)險 |
|
單次給藥毒性試驗(急性) |
單次或24小時內(nèi)多次給藥的急性毒性反應(yīng) |
確定MTD/MFD�,識別急性靶器官�,支持起始劑量設(shè)計 |
|
重復(fù)給藥毒性試驗(長期) |
重復(fù)給藥的毒性特征(符合GLP�,期限≥臨床擬用期限) |
確定NOAEL/靶器官/可逆性�,推導(dǎo)臨床安全起始劑量及范圍 |
|
遺傳毒性試驗(核心組合) |
評估致突變和染色體損傷潛力(通常:2個體外 + 1個體內(nèi)試驗) |
|
|
制劑安全性試驗 |
根據(jù)給藥途徑(如注射、外用�、眼用等)評估局部耐受性 |
確保特定劑型和給藥方式下的局部與全身安全性(如刺激性等) |
|
(酌情增加) |
|
|
|
生殖毒性試驗(早期階段) |
|
評估對早期生殖過程的潛在風(fēng)險(根據(jù)臨床計劃) |
|
免疫原性試驗(生物制品) |
|
評估免疫反應(yīng)風(fēng)險及對療效/安全性的影響 |
|
依賴性潛力評估 |
|
|
附表:試驗清單