2025年5月5日���,美國總統(tǒng)特朗普簽署了一項名為“促進國內(nèi)關鍵藥品生產(chǎn)的監(jiān)管減負”的行政令�。該行政令的核心目標是通過簡化監(jiān)管流程���,消除阻礙美國國內(nèi)藥品生產(chǎn)的監(jiān)管障礙���,推動藥品制造回流美國,以增強美國在藥品供應上的自主性和安全性�。然而,這一行政令的“外緊”政策���,即加強對外國藥品制造設施的監(jiān)管���,給國內(nèi)藥品出口企業(yè)帶來了新的挑戰(zhàn)�。根據(jù)行政令的要求�,在未來90天內(nèi),FDA局長將制定并推進一系列改進措施����,確保對供應美國藥品的海外制造設施進行常規(guī)審查�。此外�,為了支持更多的檢查活動����,行政令還計劃通過增加對外國制造設施的收費來籌集資金���,這意味著海外藥廠需要繳納更多的費用來支持這些檢查����。
5月6日����,F(xiàn)DA宣布擴大對外國生產(chǎn)設施的不事先通知檢查(飛檢)的使用范圍。這一變化旨在確保外國企業(yè)接受與美國國內(nèi)企業(yè)相同的監(jiān)管標準���,消除長期以來存在的雙重標準問題����。FDA局長強調(diào):“長期以來�,外國企業(yè)在檢查前獲得提前通知���,而美國本土制造商則面臨著嚴格的無預警檢查�。這一局面從今天起將被改變����。”FDA將評估其政策和做法���,以改進外國檢查項目,確保自身成為監(jiān)管監(jiān)督的黃金標準���。這包括明確FDA調(diào)查人員拒絕受監(jiān)管行業(yè)提供的旅行住宿(包括住宿和交通安排)的政策,以維護監(jiān)督過程的公正性�。
FDA的這一舉措意味著國內(nèi)藥品企業(yè)出口美國市場的成本和難度都將大幅增加。一方面���,場地費用預計會顯著上漲�,直接加重企業(yè)的合規(guī)成本負擔�;另一方面���,不事先通知的檢查將使企業(yè)難以提前準備,要求企業(yè)必須始終保持高標準的合規(guī)狀態(tài)����。此外,任何記錄造假或違規(guī)行為都可能被曝光���,進而導致產(chǎn)品被拒����、罰款甚至被禁止進入美國市場�。例如作為出口美國的代表浙江華海藥業(yè)在1月份接受的飛行檢查���,未得到事先通知���,是FDA檢查員到企業(yè)門口才知道的,所以此次檢查最終檢查結果整整11頁的7條觀察項�,毫無疑問是OAI,后面也可以關注一下其整改及FDA的行動���。
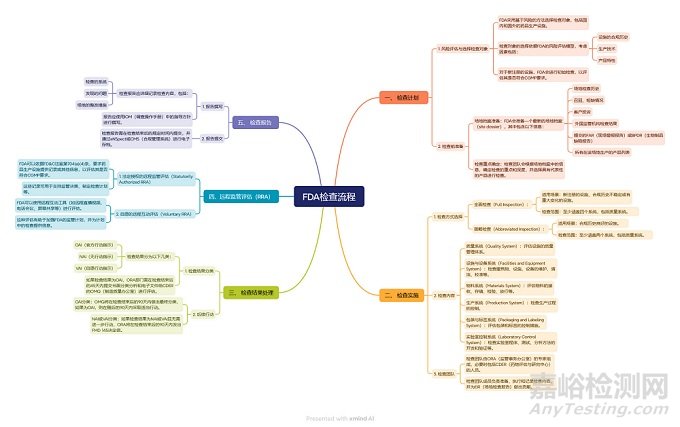
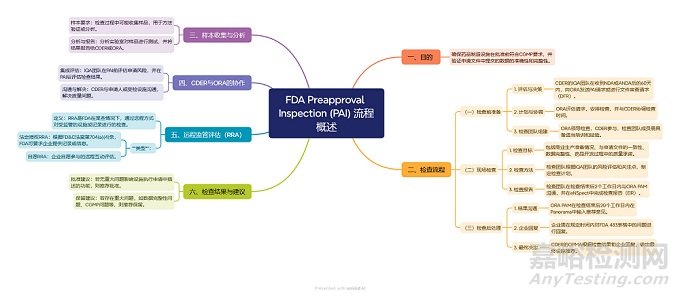
為了幫助國內(nèi)藥企更好地應對FDA檢查�,筆者特意整理了FDA常規(guī)檢查(圖1)和批準前檢查(圖2)的流程�,希望能為大家提供一些參考�。
▲圖1-FDA常規(guī)檢查流程
▲圖2-FDA批準前檢查流程
上述流程是基于FDA現(xiàn)行的符合性指南制作的����, 檢查由ORA(Office of Regulatory Affairs,法規(guī)事務辦公室)負責�,如為VAI/NAI,則由ORA發(fā)布最終決定信����,如為OAI���,則會進入CDER的OC (Office of Compliance���,合規(guī)辦公室),由其發(fā)布最終檢查決定(該決定也可能會降級)����;對于PAI檢查�,則是由CDER的OPQ(Office of Pharmaceutical Quality)做出決定�。
然而,需要注意的是,F(xiàn)DA的組織架構已經(jīng)發(fā)生了調(diào)整。自2024年10月1日起�,ORA被重組為OII(Office of Inspections and Investigations���,檢查與調(diào)查辦公室)����。重組后的OII繼續(xù)負責檢查工作���,但大部分合規(guī)職能和人員已調(diào)整到各個中心�,以簡化操作并加快最終決定的做出(重組前要求在90天內(nèi)做出決定)。
鑒于此�,上述檢查流程在未來可能會有所調(diào)整���。筆者也已與FDA溝通交流確認����,流程和時限沒有變化�,CDER合規(guī)部基于可用信息對OII分類為VAI和OAI檢查做出評估及最終決定���,而且最終檢查決定的時間沒有變,仍然是90天����;至于何時會更新相關的指南文件,時間還不確定�。筆者將持續(xù)關注FDA根據(jù)此次改組修訂相應法規(guī)政策文件的后續(xù)進展�,并及時為大家?guī)碜钚碌男畔ⅰ?/span>
FDA的檢查流程與組織架構正處于持續(xù)優(yōu)化與調(diào)整之中,其核心目標是進一步保障藥品質(zhì)量與公眾健康���。這一變革雖給國內(nèi)藥企帶來了諸多挑戰(zhàn),卻也為其提升合規(guī)水平與質(zhì)量管理體系提供了契機����。國內(nèi)藥企應積極主動地關注這些變化,及時調(diào)整合規(guī)策略����,以從容應對可能出現(xiàn)的新挑戰(zhàn)����。藥企需通過深入了解FDA的檢查要求����,建立完善的質(zhì)量管理體系,加強員工培訓�,確保記錄的真實性和完整性等措施,來提升自身的國際競爭力���。只有這樣�,企業(yè)才能在滿足美國市場嚴格監(jiān)管要求的同時���,贏得更廣闊的發(fā)展空間。
此外����,藥企還應密切關注FDA對其他企業(yè)的檢查結果�,包括FDA 483、警告信����、進口禁令等����。需注意的是,F(xiàn)DA 483通常只有在收到3份或更多《信息自由法案》(FOIA)請求時才會發(fā)布,且發(fā)布時會刪去商業(yè)機密或保密商業(yè)信息����。FDA也可能在特定條件下主動發(fā)布這些文件。
相關檢查數(shù)據(jù)與記錄可通過以下網(wǎng)址查詢:
● FDA Data Dashboard for Inspections
● OII FOIA Electronic Reading Room
通過分析這些信息�,企業(yè)能夠更好地把握FDA的檢查要求與趨勢����,從而為自身的合規(guī)發(fā)展提供有力支持�。