在歐盟監(jiān)管體系中,如何界定醫(yī)療器械與其他產(chǎn)品的邊界�����、準(zhǔn)確劃分產(chǎn)品風(fēng)險(xiǎn)等級(jí),一直是行業(yè)關(guān)注的焦點(diǎn)�����。近日�,《歐盟醫(yī)療器械法規(guī)(EU)2017/745 和體外診斷醫(yī)療器械法規(guī)(EU)2017/746 下的邊界與分類手冊(cè)》(Version 4)發(fā)布���,針對(duì)眾多爭(zhēng)議產(chǎn)品的定性與分類給出了明確指引�����,對(duì)企業(yè)合規(guī)經(jīng)營(yíng)、監(jiān)管機(jī)構(gòu)執(zhí)法均具有重要參考意義�����。
原文鏈接: https://health.ec.europa.eu/document/download/71a87df8-5ca1-4555-b453-b65bdf8de909_en?filename=md_borderline_manual_en.pdf
一、核心前提:手冊(cè)定位與適用原則
該手冊(cè)由歐盟醫(yī)療器械協(xié)調(diào)組(MDCG)下屬的邊界與分類工作組(BCWG)制定�,需注意以下關(guān)鍵前提:
1.非法律強(qiáng)制:僅為成員國(guó)監(jiān)管機(jī)構(gòu)和企業(yè)提供個(gè)案適用的支持工具,不具備法律約束力�,最終解釋權(quán)歸歐盟法院。
2.協(xié)同閱讀:需結(jié)合其他專項(xiàng)指引使用�,如《醫(yī)療器械與藥品邊界指引(MDCG 2022-5)》《軟件定性與分類指引(MDCG 2019-11)》等�����。
3.風(fēng)險(xiǎn)分類框架:若產(chǎn)品被定性為醫(yī)療器械,風(fēng)險(xiǎn)等級(jí)分為 I�、IIa、IIb�、III 類;若為體外診斷醫(yī)療器械(IVD)�����,則分為 A、B�、C、D 類�����。
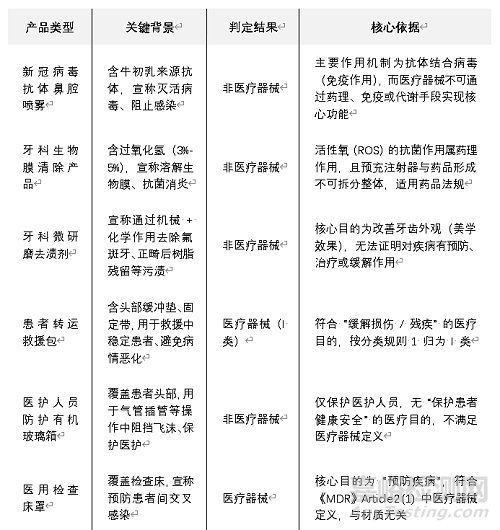
二、重點(diǎn)產(chǎn)品邊界判定:這些 “模糊領(lǐng)域” 有了定論
手冊(cè)針對(duì)醫(yī)療器械與藥品�����、化妝品�����、個(gè)人防護(hù)裝備(PPE)等多類產(chǎn)品的邊界爭(zhēng)議,通過(guò)具體案例明確判定標(biāo)準(zhǔn)���,以下為典型案例總結(jié):
醫(yī)療器械分類關(guān)鍵案例:這些產(chǎn)品風(fēng)險(xiǎn)等級(jí)明確
對(duì)于已定性為醫(yī)療器械的產(chǎn)品�,手冊(cè)依據(jù)《MDR》附錄 VIII 分類規(guī)則,明確了多類產(chǎn)品的風(fēng)險(xiǎn)等級(jí):
1���、含腺嘌呤的紅細(xì)胞添加液:歸為 III 類�����。腺嘌呤通過(guò)代謝作用維持紅細(xì)胞 ATP 水平(延長(zhǎng)儲(chǔ)存期)�����,屬 “含單獨(dú)使用時(shí)為藥品的物質(zhì)”,且該物質(zhì)作用為器械輔助功能�����,按規(guī)則 14 歸為最高風(fēng)險(xiǎn)的 III 類���。
2���、醫(yī)用計(jì)算器 APP:至少歸為 IIa 類?��?捎?jì)算房顫患者卒中風(fēng)險(xiǎn)(CHA?DS?-VASc 評(píng)分)�����、腎功能肌酐清除率等���,為醫(yī)生診斷 / 治療決策提供依據(jù)�,按規(guī)則 11(軟件提供診療決策信息)歸為 IIa 類���,具體等級(jí)需結(jié)合信息對(duì)決策的影響程度調(diào)整�。
3�、定制顱骨植入物:歸為 III 類。直接與腦膜(中樞神經(jīng)系統(tǒng)組成部分)接觸�����,按規(guī)則 8(用于中樞神經(jīng)系統(tǒng)直接接觸的植入器械)歸為 III 類,無(wú)需證明與組織有相互作用�。
4、環(huán)氧乙烷(EtO)氣體 cartridge:至少歸為 IIa 類���。用于醫(yī)療器械滅菌�����,屬 “專門用于醫(yī)療器械消毒 / 滅菌的設(shè)備”���,按規(guī)則 16 歸為 IIa 類���;若為侵入性器械消毒終點(diǎn)設(shè)備�����,則需歸為 IIb 類。