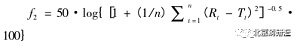文章內(nèi)容
溶出度試驗(yàn)對(duì)于口服固體制劑的開(kāi)發(fā)和質(zhì)量控制具有重要意義�����,其既是處方工藝的篩選工具���,也是質(zhì)量控制工具�����,為口服固體制劑研究中的一項(xiàng)重要內(nèi)容���。開(kāi)展溶出度試驗(yàn)�,首先需建立適宜的溶出條件���,包括溶出裝置�����、介質(zhì)種類(lèi)和體積、轉(zhuǎn)速;其次�����,要開(kāi)展適宜的溶出度比較研究�,包括自研樣品同原研產(chǎn)品溶出行為的比較、創(chuàng)新藥研究進(jìn)程中不同階段樣品溶出行為的比較�、上市后變更前后樣品溶出行為的比較以及不同規(guī)格樣品溶出行為的比較。再者要注意記錄關(guān)鍵批次樣品的溶出行為�;為質(zhì)量標(biāo)準(zhǔn)的制定提供依據(jù),為后續(xù)工藝驗(yàn)證批次���、變更后批次的溶出度比較提供對(duì)比依據(jù)�����。
概述
口服固體制劑給藥后體內(nèi)過(guò)程包括制劑在胃腸道內(nèi)崩解�����、 藥物在胃腸道內(nèi)溶解�、 溶出以及藥物透過(guò)胃腸道吸收?��;谶@一過(guò)程中藥物溶解�����、 溶出的重要性�, 溶出行為通常作為口服固體制劑的一項(xiàng)關(guān)鍵質(zhì)量屬性���, 是口服固體制劑開(kāi)發(fā)中的一項(xiàng)重要研究?jī)?nèi)容�。根據(jù) 2010 版中國(guó)藥典的定義�, 溶出度系指“活性藥物從片劑、 膠囊劑或顆粒劑等制劑在規(guī)定條件下溶出的速率和程度�。根據(jù) Noyes- Whitney方程,可知溶出行為受到藥物理化性質(zhì)(晶型�、粒度���、溶解度等)、處方組成�����、生產(chǎn)工藝以及所用溶出條件的影響�。
溶出度試驗(yàn)對(duì)于產(chǎn)品的開(kāi)發(fā)和質(zhì)量控制具有重要意義,具體而言:溶出度是一項(xiàng)重要的質(zhì)量評(píng)價(jià)指標(biāo)�����,能夠?qū)υ纤庩P(guān)鍵理化性質(zhì)的篩選�、處方組成的確定�����、關(guān)鍵工藝步驟和工藝參數(shù)范圍的確定提供支持���;能夠?qū)Σ煌?guī)模條件下生產(chǎn)的產(chǎn)品質(zhì)量進(jìn)行評(píng)價(jià)�,確認(rèn)放大的合理性���;能夠作為質(zhì)量控制的工具�����,控制批間質(zhì)量的一致性���;某些情況下�,通過(guò)溶出度研究�����,能夠提示可能的生物利用度問(wèn)題�����。近年來(lái)�����,隨著生物藥劑學(xué)分類(lèi)系統(tǒng)�����、質(zhì)量源于設(shè)計(jì)理念的推廣應(yīng)用�,溶出度研究在口服固體制劑的開(kāi)發(fā)中發(fā)揮著越來(lái)越重要的作用。比如�,對(duì)于高溶解���、 高滲透以及快速溶出的藥物,可以通過(guò)體外溶出度研究申請(qǐng)豁免體內(nèi)生物等效研究
鑒于溶出度研究在普通口服固體制劑開(kāi)發(fā)中的重要作用�����, 藥審中心負(fù)責(zé)組織起草了《普通口服固體制劑溶出度試驗(yàn)技術(shù)要求指導(dǎo)原則》�����。下文將結(jié)合該指導(dǎo)原則�,對(duì)普通口服固體制劑溶出度研究中的 3 個(gè)關(guān)鍵問(wèn)題進(jìn)行論述。
1溶出條件的篩選及驗(yàn)證
1.1溶出條件的選擇
溶出條件選擇的一般原則是采用適當(dāng)�����、溫和的溶出條件�����,該條件下能區(qū)分不同質(zhì)量的產(chǎn)品同時(shí)所選條件又具有一定的耐受性���。溶出條件包括:溶出介質(zhì)(介質(zhì)的種類(lèi)、介質(zhì)的體積及溫度)�、溶出裝置及轉(zhuǎn)速���、取樣時(shí)間點(diǎn)。
1.1.1 溶出介質(zhì)
溶出度試驗(yàn)應(yīng)盡可能在生理?xiàng)l件下進(jìn)行�,這樣可以從藥品體內(nèi)行為的角度,更好地理解體外溶出數(shù)據(jù)�����。但常規(guī)的溶出度試驗(yàn)條件不需要與胃腸環(huán)境嚴(yán)格一致�����,而是可根據(jù)原料藥的理化性質(zhì)和口服給藥后可能的暴露條件確定適當(dāng)?shù)慕橘|(zhì)�����。溶出介質(zhì)一般采用 pH1.2~6.8 的水性介質(zhì)���,溫度為(37±0.5)℃�。特殊情況下���,可采用高pH的溶出介質(zhì)�����,但一般不應(yīng)超過(guò) pH8.0���。對(duì)于不溶于水或難溶于水的藥物�����,可考慮在溶出介質(zhì)中加入十二烷基硫酸鈉或其他適當(dāng)?shù)谋砻婊钚詣?��,但需充分論證表面活性劑加入的必要性和加入量的合理性,用量應(yīng)盡可能小�����。由于不同來(lái)源的表面活性劑質(zhì)量可能存在明顯差異�,需注意不同質(zhì)量的表面活性劑對(duì)試驗(yàn)結(jié)果帶來(lái)的顯著影響,使用標(biāo)準(zhǔn)化的或高純度的表面活性劑可避免上述影響�。溶出介質(zhì)的體積一般為500,900�����,1000 mL�,藥物在其中最好能滿(mǎn)足漏槽條件�,同時(shí)藥物在介質(zhì)中應(yīng)具有較好的物理化學(xué)穩(wěn)定性�。
1.1.2 溶出裝置和轉(zhuǎn)速
常規(guī)使用的溶出裝置為轉(zhuǎn)籃法和槳法���,籃法的轉(zhuǎn)速一般為 50~100r·min-1���,槳法的轉(zhuǎn)速一般為50~75r·min-1。必要時(shí)可采用往復(fù)筒法或流通池法進(jìn)行體外溶出度試驗(yàn)�����,如使用非藥典收載的溶出裝置�,需充分論證其必要性和可行性。
1.1.3 取樣時(shí)間點(diǎn)
取樣時(shí)間點(diǎn)需要結(jié)合制劑特性確定�。如為快速溶出制劑,取樣時(shí)間點(diǎn)可考慮比較短的取樣間隔�,如15 min。如制劑溶出較慢,取樣間隔可適當(dāng)延長(zhǎng)�。
1.2 溶出條件區(qū)分能力的驗(yàn)證
溶出條件區(qū)分能力的驗(yàn)證一直是溶出度研究中的薄弱環(huán)節(jié)。通??赏ㄟ^(guò)改變可能影響樣品溶出行為的生產(chǎn)因素(比如處方組成、 工藝參數(shù)等)制備不同樣品�,考證在選用的溶出條件下以上樣品溶出行為是否有差異。如果改變了關(guān)鍵生產(chǎn)因素獲得的不同樣品溶出行為有差異���, 則證明所選擇的溶出條件具有一定的區(qū)分能力���。下面以具體的案例來(lái)闡述驗(yàn)證過(guò)程�。
1.2.1 案例解析—創(chuàng)新藥
1.2.1.1 溶出條件的初步確定
藥物 A�,難溶于水�,開(kāi)發(fā)為片劑���,規(guī)格 200 mg�����。其溶解性呈 pH依賴(lài)性,pH 1~2 時(shí)溶解度最高���,但即使在 pH 1~2 的條件下尚需加入 0.5%的 SLS方可滿(mǎn)足漏槽條件���。由于藥物在含有 0.5% SLS 的0.1 mol·L-1鹽酸中溶出不完全,初步選擇 900 mL 含有1% SLS 的 0.1mol·L-1鹽酸為溶出介質(zhì)�����,槳法�����,50 r·min-1 �����。
1.2.1.2 溶出條件的優(yōu)化
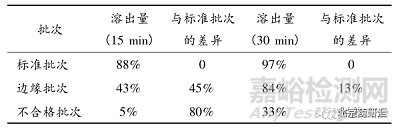
研究進(jìn)程中發(fā)現(xiàn)兩個(gè)批號(hào)片劑體內(nèi)性質(zhì)有差別,但體外都符合最初設(shè)定的溶出度檢查規(guī)定(槳法�����,50r·min-1,900 mL 0.1mol·L-1鹽酸+1% SLS 為溶出介質(zhì)���, 30 min 溶出大于 80%)。以上結(jié)果提示需優(yōu)化溶出條件���,改善其分辨能力�����。通過(guò)分析不同批次(標(biāo)準(zhǔn)溶出批次、邊緣溶出批次、不合格溶出批次)的溶出曲線(xiàn)���,可知相比于30 min,不同批次在15 min 的溶出量差異較大�����,具體如表 1 所示�����,故初步考慮選擇 15 min 作為溶出測(cè)試點(diǎn)�。
表 1 不同批次 15 和 30 min 溶出結(jié)果的比較
1.2.1.3 溶出條件區(qū)分能力的驗(yàn)證
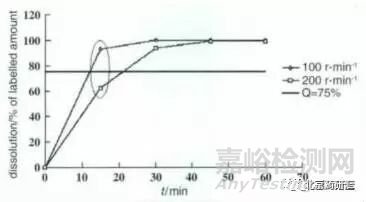
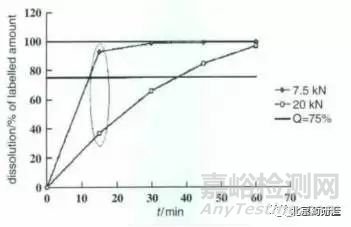
為驗(yàn)證修訂后的溶出條件是否能分辨不同工藝批次樣品的質(zhì)量差異�����,對(duì)預(yù)期中可能影響片劑溶出行為的生產(chǎn)參數(shù)進(jìn)行了改變�。根據(jù)前期工藝研究結(jié)果對(duì) 7 個(gè)可能影響樣品質(zhì)量的生產(chǎn)參數(shù)進(jìn)行了考察���,最終確定關(guān)鍵生產(chǎn)參數(shù)為制粒機(jī)轉(zhuǎn)速和壓片壓力。將制粒機(jī)轉(zhuǎn)速由 100 r·min-1調(diào)整至200 r·min-1 ���、壓片壓力由 7.5kN 調(diào)整至 20 kN 生產(chǎn)不同樣品�,在上述條件下考察不同樣品的溶出行為,結(jié)果如圖 1~2 所示�。
圖 1 制粒機(jī)轉(zhuǎn)速不同樣品溶出行為的比較
圖2 壓片壓力不同樣品溶出行為的比較
根據(jù)以上溶出行為的對(duì)比可知���, 由于偏離了既定的關(guān)鍵生產(chǎn)參數(shù),在制粒機(jī)轉(zhuǎn)速為 200 r· min-1和壓片壓力為 20 KN 下生產(chǎn)的樣品溶出不符合規(guī)定���。以上結(jié)果提示,目前選擇的溶出度試驗(yàn)條件對(duì)關(guān)鍵生產(chǎn)技術(shù)參數(shù)的變化比較敏感�����,能分辨不同工藝批次的樣品的質(zhì)量差異�����。
1.2.1.4 溶出條件耐用性的驗(yàn)證
在考察了溶出條件區(qū)分能力的基礎(chǔ)上�,需進(jìn)一步考證溶出條件的耐用性�����。分別考察了溶出條件在一定范圍內(nèi)波動(dòng)(比如介質(zhì)溫度±2 ℃、 轉(zhuǎn)速± 4 r·min-1 �、 SLS 濃度±0.1%、 溶出介質(zhì)是否脫氣處理)對(duì)于溶出行為是否產(chǎn)生影響�����, 結(jié)果顯示以上條件的微小變化對(duì)產(chǎn)品的測(cè)定結(jié)果影響較小�, 提示所選用的溶出條件具有較好的耐受性�。
1.2.2 案例解析—仿制藥
1.2.2.1 背景信息
藥物 B�, 難溶于水, 開(kāi)發(fā)為片劑���。原研產(chǎn)品采用的溶出條件為槳法, 75 r·min-1 �����,900 mL 0.1 N 鹽酸 + 2.0% w/v 十二烷基硫酸鈉(SLS) 為溶出介質(zhì)�,規(guī)定 30 min 溶出量不少于90%。研究中發(fā)現(xiàn)在原研產(chǎn)品確定的溶出條件下�����,初步篩選的多個(gè)處方在體外均同原研產(chǎn)品保持一致,需要解決的問(wèn)題是如何才能確定與原研產(chǎn)品體內(nèi)行為保持一致的處方���。
1.2.2.2 溶出條件的篩選
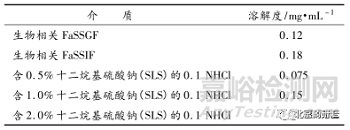
首先,仔細(xì)比較了藥物B 在不同介質(zhì)中的溶解度(如表 2)�����,結(jié)果顯示藥物在 0.1 N 鹽酸 +1.0% SLS 介質(zhì)中的溶解度與禁食后人工胃液和人工腸液中的溶解度相似�,故考慮采用該介質(zhì)為溶出介質(zhì)�。
表 2 藥物 B 在不同介質(zhì)中的溶解度
1.2.2.3 溶出條件的驗(yàn)證
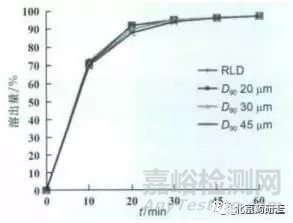
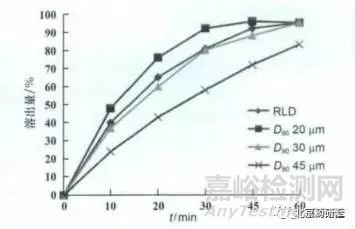
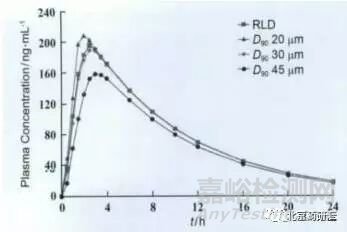
藥物 B 難溶于水�����,故改變藥物 B 的粒度可能會(huì)改變其溶出行為���。分別采用D90為20, 30�, 45 μm 的原料藥制備制劑,然后在兩種溶出條件(自建溶出條件和原研溶出條件)下與原研制劑進(jìn)行溶出行為的比較�����,同時(shí)也開(kāi)展了同原研制劑的生物等效比較研究�, 結(jié)果如圖3 ~5 所示。
圖 3 4種樣品在原研溶出條件下的溶出比較圖
4 4種樣品在自建溶出條件下的溶出比較
圖 5 4種樣品的生物等效對(duì)比研究中平均藥動(dòng)學(xué)結(jié)果
從以上結(jié)果可以看出, 不同粒度原料藥制備樣品在原研溶出條件下溶出行為一致�, 但在自建溶出條件下粒度越大溶出越慢且采用 D 90 30 μm 原料藥制備的樣品溶出行為和原研產(chǎn)品一致。體內(nèi)藥動(dòng)學(xué)研究結(jié)果也顯示不同粒度樣品體內(nèi)行為不同且采用D 90 30 μm 原料藥制備樣品和原研產(chǎn)品體內(nèi)行為一致�����, 這也進(jìn)一步證明了自建溶出條件的區(qū)分能力���。
2 溶出行為的比較
溶出行為的比較包括仿制藥研究中自研樣品同原研產(chǎn)品溶出行為的比較�、 創(chuàng)新藥研究進(jìn)程中不同階段樣品溶出行為的比較���、 上市后變更前后樣品溶出行為的比較以及不同規(guī)格樣品溶出行為的比較。注冊(cè)申請(qǐng)中�, 建議以表格的形式詳細(xì)列出考察樣品的信息, 包括生產(chǎn)日期�、 生產(chǎn)地點(diǎn)���、 生產(chǎn)批號(hào)�����、 生產(chǎn)規(guī)模�、 樣品用途、 所采用的處方工藝(如必要)���, 詳細(xì)列明溶出行為比較所采用的方法, 包括溶出裝置�����、 溶出介質(zhì)�、 轉(zhuǎn)速���、 取樣點(diǎn)、 溶出量測(cè)定方法�、 溶出結(jié)果比較的方法。對(duì)于溶出結(jié)果的比較�, 在整體溶出度曲線(xiàn)相似以及每一采樣時(shí)間點(diǎn)溶出度相似時(shí)�����, 可認(rèn)為兩者溶出行為相似。常規(guī)采用方法為非模型依賴(lài)的相似因子法[5]:
其中 n 為取樣時(shí)間點(diǎn)個(gè)數(shù)�����, R t 為參比樣品在 t時(shí)刻的溶出量���, Tt 為試驗(yàn)批次在 t 時(shí)刻的溶出量。相似因子 f 2 的比較需滿(mǎn)足以下條件:① 取樣時(shí)間點(diǎn)除 0 時(shí)外至少有 3 個(gè)���, 如 5���, 15�,30, 45 min�����。② 每個(gè)處方樣品至少采用 12 個(gè)劑量單位�����。③ 計(jì)算時(shí)藥物溶出達(dá)到 85% 以上的時(shí)間點(diǎn)只能選取一點(diǎn)。④ 第 1 個(gè)時(shí)間點(diǎn)的變異系數(shù)不得過(guò)20%�����, 其余時(shí)間點(diǎn)變異系數(shù)應(yīng)小于 10%���。
3 關(guān)鍵批次樣品溶出行為的記錄
建立體外溶出度質(zhì)量標(biāo)準(zhǔn)的目的是保證藥品批間質(zhì)量的一致性, 并提示可能的體內(nèi)生物利用度問(wèn)題���。對(duì)于新藥申請(qǐng)�, 通常是根據(jù)可接受的臨床試驗(yàn)樣品���、 關(guān)鍵生物利用度試驗(yàn)和/或生物等效性試驗(yàn)用樣品的溶出數(shù)據(jù)以及產(chǎn)品研發(fā)過(guò)程中的經(jīng)驗(yàn), 確定溶出度質(zhì)量標(biāo)準(zhǔn) �。對(duì)于仿制藥申請(qǐng), 通常是根據(jù)可接受的生物等效性試驗(yàn)用樣品的溶出數(shù)據(jù)�����,確定溶出度質(zhì)量標(biāo)準(zhǔn)。關(guān)鍵批次樣品即是指生物等效性試驗(yàn)用樣品或者關(guān)鍵臨床試驗(yàn)(比如Ⅲ期臨床試驗(yàn))用樣品�����, 研究中需關(guān)注記錄以上批次樣品在多種介質(zhì)中的溶出曲線(xiàn), 一則是為質(zhì)量標(biāo)準(zhǔn)中溶出度限度確定提供依據(jù)���, 二則為驗(yàn)證批次、 變更后批次溶出行為的比較提供對(duì)比的標(biāo)尺�����。
4 結(jié)語(yǔ)
溶出度試驗(yàn)研究對(duì)于普通口服固體制劑的開(kāi)發(fā)具有重要意義�����, 一可以指導(dǎo)處方工藝的開(kāi)發(fā)�, 二可以作為評(píng)估和控制產(chǎn)品質(zhì)量的工具���。對(duì)于溶出度試驗(yàn)�����, 首先需要建立適宜的溶出條件�, 能夠區(qū)分不同質(zhì)量的樣品同時(shí)又具有一定的耐用性;其次�����, 研究中需注意記錄關(guān)鍵批次樣品的溶出行為, 既為溶出度標(biāo)準(zhǔn)的確定提供依據(jù)�, 同時(shí)也能為后續(xù)驗(yàn)證批次�、 變更批次提供比較的標(biāo)尺;再者, 就是要在以上研究基礎(chǔ)上�, 確定適宜的溶出度標(biāo)準(zhǔn), 并進(jìn)行必要的體內(nèi)外確認(rèn)���。