引用本文
史宇航��,梁毅*.跨國(guó)醫(yī)藥公司實(shí)施ICH 指南的挑戰(zhàn)與對(duì)策思考[J].中國(guó)食品藥品監(jiān)管.2025.8(259):130-137.
跨國(guó)醫(yī)藥公司實(shí)施ICH 指南的挑戰(zhàn)與對(duì)策思考
Challenges and Countermeasures for Multinational Pharmaceutical Companies in Implementing ICH Guidelines
史宇航
中國(guó)藥科大學(xué)國(guó)際醫(yī)藥商學(xué)院
SHI Yu-hang
School of International Pharmaceutical Business, China Pharmaceutical University
梁毅*
中國(guó)藥科大學(xué)國(guó)際醫(yī)藥商學(xué)院
LIANG Yi*
School of International Pharmaceutical Business,China Pharmaceutical University
摘 要 Abstract
隨著全球化程度的逐漸加深與醫(yī)藥行業(yè)的不斷發(fā)展,國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)(ICH)指南的持續(xù)更新對(duì)跨國(guó)醫(yī)藥公司的影響日益顯著��?�?鐕?guó)醫(yī)藥公司需要密切關(guān)注有關(guān)變化��,及時(shí)調(diào)整業(yè)務(wù)策略和運(yùn)營(yíng)模式��,確保適應(yīng)并遵循不斷更新的ICH 指南要求��。本文采用文獻(xiàn)分析與政策研究方法�����,基于ICH 發(fā)展背景與跨國(guó)醫(yī)藥公司發(fā)展模式�����,分析跨國(guó)醫(yī)藥公司在實(shí)施ICH 指南時(shí)遇到的主要挑戰(zhàn)以及應(yīng)對(duì)策略����,同時(shí)探索構(gòu)建跨國(guó)醫(yī)藥公司質(zhì)量管理通用標(biāo)準(zhǔn)�����,以期為其更好地實(shí)施ICH 指南提供參考����?����?鐕?guó)醫(yī)藥公司應(yīng)將適應(yīng)和實(shí)施不斷更新的ICH 指南作為持續(xù)監(jiān)測(cè)的戰(zhàn)略重點(diǎn)��,以確保其在全球醫(yī)藥市場(chǎng)中保持競(jìng)爭(zhēng)優(yōu)勢(shì)��,實(shí)現(xiàn)可持續(xù)發(fā)展����。
With the deepening of globalization and the ongoing evolution of the pharmaceutical industry, frequent updates to the International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) guidelines have had an increasingly significant impact on multinational pharmaceutical companies. These companies must closely monitor regulatory developments, promptly adjust business strategies and operational models, and ensure timely compliance with the evolving ICH requirements. This paper employs literature review and policy analysis methodologies to examine the key challenges faced by multinational pharmaceutical companies in implementing ICH guidelines, taking into account the historical development of ICH and corporate operational strategies. Furthermore, it proposes the construction of a general quality management framework adaptable across multinational operations to facilitate effective implementation of ICH standards.It is recommended that multinational pharmaceutical companies treat the adaptation to and implementation of updated ICH guidelines as a continuous strategic priority to maintain competitiveness in the global pharmaceutical market and achieve sustainable development.
關(guān)鍵詞 Key words
國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)指南����;跨國(guó)醫(yī)藥公司;監(jiān)管�����;挑戰(zhàn);策略
ICH guidelines; multinational pharmaceutical companies; regulation; challenges; strategies
國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)
(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use����,ICH)是致力于促進(jìn)全球藥品監(jiān)管協(xié)調(diào)與統(tǒng)一的國(guó)際組織,通過(guò)制定共同的藥品監(jiān)管指南�����,推動(dòng)國(guó)際藥品研發(fā)����、注冊(cè)、生產(chǎn)等監(jiān)管工作的合作與互認(rèn)����。ICH的成立可以追溯至1990 年,全球制藥行業(yè)面臨著越來(lái)越多的挑戰(zhàn)��,如快速發(fā)展的科學(xué)技術(shù)�����、日益嚴(yán)格的法律法規(guī)��、不斷增長(zhǎng)的國(guó)際貿(mào)易需求等。為了應(yīng)對(duì)相關(guān)挑戰(zhàn)����,歐洲、美國(guó)和日本藥品監(jiān)管機(jī)構(gòu)及相關(guān)組織共同發(fā)起成立ICH����。2017 年6 月,原國(guó)家食品藥品監(jiān)督管理總局正式加入ICH��,標(biāo)志著我國(guó)藥品標(biāo)準(zhǔn)在國(guó)際合作領(lǐng)域邁出重要的一步[1]��。ICH 指南涵蓋多個(gè)方面的內(nèi)容����,包括藥物非臨床研究、藥物臨床試驗(yàn)設(shè)計(jì)����、質(zhì)量控制標(biāo)準(zhǔn)��、安全性評(píng)估以及藥品注冊(cè)申請(qǐng)等����。這些內(nèi)容經(jīng)過(guò)廣泛的學(xué)者討論與專家評(píng)審,具有較好的科學(xué)性、有效性����、可操作性等。由于ICH 成員覆蓋全球主要的藥品市場(chǎng)�����,ICH 指南具有較高的國(guó)際認(rèn)可度和適用性�����,許多國(guó)家和地區(qū)藥品監(jiān)管機(jī)構(gòu)將ICH 指南作為藥品注冊(cè)審評(píng)審批的參考標(biāo)準(zhǔn)�����。
跨國(guó)醫(yī)藥公司在全球醫(yī)藥市場(chǎng)中扮演著重要角色����,ICH 指南的持續(xù)更新對(duì)其影響深遠(yuǎn)。首先�����,跨國(guó)醫(yī)藥公司通常承擔(dān)藥物研發(fā)的重要工作�����。其通常擁有龐大的專家團(tuán)隊(duì)和充足的研發(fā)資金,致力于藥物創(chuàng)新��,推動(dòng)全球醫(yī)藥領(lǐng)域進(jìn)步��。其次�����,跨國(guó)醫(yī)藥公司通常具有較多藥品國(guó)際市場(chǎng)準(zhǔn)入的現(xiàn)實(shí)任務(wù)����。其通常在多個(gè)國(guó)家和地區(qū)注冊(cè)與銷售產(chǎn)品,需要考慮藥品國(guó)際市場(chǎng)準(zhǔn)入順序以及遵守不同國(guó)家和地區(qū)的監(jiān)管要求��,從而有效推動(dòng)產(chǎn)品在全球范圍內(nèi)上市銷售�����。最后��, 跨國(guó)醫(yī)藥公司對(duì)于國(guó)際合作與協(xié)調(diào)“ 生態(tài)系統(tǒng)”的需求較大��。其通常與不同國(guó)家和地區(qū)醫(yī)療機(jī)構(gòu)��、學(xué)術(shù)研究機(jī)構(gòu)等開(kāi)展多方合作��,促進(jìn)科研成果的轉(zhuǎn)化和應(yīng)用��,推動(dòng)醫(yī)藥科技的發(fā)展�����。因此��,跨國(guó)醫(yī)藥公司需要及時(shí)監(jiān)測(cè)ICH 指南的更新動(dòng)態(tài)����,為全球患者提供數(shù)量與質(zhì)量并重的醫(yī)藥產(chǎn)品與服務(wù)�����。本文基于ICH 發(fā)展背景與跨國(guó)醫(yī)藥公司發(fā)展模式����,探析ICH 指南實(shí)施過(guò)程中的主要挑戰(zhàn)和應(yīng)對(duì)策略,并探索構(gòu)建跨國(guó)醫(yī)藥公司質(zhì)量管理通用標(biāo)準(zhǔn)��,以期為其更好地實(shí)施ICH 指南提供參考��。
1 ICH 及其指南發(fā)展概況
2015 年10 月,ICH 召開(kāi)大會(huì)宣布進(jìn)行組織改革�����,根據(jù)瑞士法律�����,成為一個(gè)具有法律實(shí)體的國(guó)際組織��。此次會(huì)議的召開(kāi)不僅代表ICH 總結(jié)并交付了已探索25 年的全球藥品監(jiān)管指南��,同時(shí)也反映出世界各國(guó)和地區(qū)對(duì)藥品研發(fā)��、注冊(cè)��、生產(chǎn)等監(jiān)管環(huán)節(jié)達(dá)成長(zhǎng)期協(xié)調(diào)穩(wěn)定的愿景����。協(xié)調(diào)監(jiān)管要求是由歐共體于20 世紀(jì)80 年代初期提出的,歐洲各國(guó)和地區(qū)向藥品市場(chǎng)的聯(lián)合邁進(jìn)證明了協(xié)調(diào)監(jiān)管的可行性�����。1989年��, 在法國(guó)巴黎舉行的世界衛(wèi)生組織國(guó)際藥品監(jiān)管機(jī)構(gòu)會(huì)議(International Conference of Drug Regulatory Authorities,ICDRA)就實(shí)際操作計(jì)劃展開(kāi)了研究��。隨后�����,世界衛(wèi)生組織與國(guó)際藥品制造商協(xié)會(huì)聯(lián)合會(huì)(The International Federation of Pharmaceutical Manufacturers and Associations�����,IFPMA) 商討了關(guān)于國(guó)際協(xié)調(diào)的行業(yè)監(jiān)管聯(lián)合倡議����, 并構(gòu)思成立ICH�����。1990 年�����,歐洲制藥工業(yè)協(xié)會(huì)聯(lián)合會(huì)(European Federation of Pharmaceutical Industries and Associations����,EFPIA)在布魯塞爾召開(kāi)會(huì)議�����, 各方代表共同討論了ICH 的意義與任務(wù)����。2015 年����,ICH 被確立為獨(dú)立的法律實(shí)體,旨在形成更加穩(wěn)定的運(yùn)行結(jié)構(gòu)��,不斷增加國(guó)際外聯(lián)����,向更廣泛的利益相關(guān)者傳播更多關(guān)于藥品監(jiān)管的信息。
ICH 指南的發(fā)展歷程可主要分為4 個(gè)階段:① ICH 指南制定初期��。其內(nèi)容主要是圍繞國(guó)際藥品注冊(cè)技術(shù)要求編寫(xiě)的����,包括質(zhì)量(quality)、安全性(safety)�����、有效性(efficacy) 和多學(xué)科(multidisciplinary) 等方面。② ICH 指南的修訂與進(jìn)一步擴(kuò)展����。ICH 指南經(jīng)過(guò)不斷修訂和擴(kuò)展,以適應(yīng)不斷發(fā)展的科學(xué)技術(shù)和國(guó)際藥品監(jiān)管的需求����。③全球多方利益相關(guān)者參與編寫(xiě)��。許多國(guó)家和地區(qū)藥品監(jiān)管機(jī)構(gòu)與全球制藥行業(yè)協(xié)會(huì)逐漸在ICH 指南研討過(guò)程中貢獻(xiàn)自身力量�����。④ ICH 應(yīng)對(duì)新興挑戰(zhàn)�����。近年來(lái)����,隨著科學(xué)技術(shù)在醫(yī)藥領(lǐng)域的快速發(fā)展,ICH不斷應(yīng)對(duì)新興挑戰(zhàn)����,如生物標(biāo)志物��、人工智能等在藥品研發(fā)和注冊(cè)中得到應(yīng)用��。為了應(yīng)對(duì)這些新的挑戰(zhàn)�����,ICH 不斷修訂和更新其指南��,以持續(xù)引領(lǐng)國(guó)際藥品注冊(cè)和監(jiān)管標(biāo)準(zhǔn)的更新�����。
2 跨國(guó)醫(yī)藥公司發(fā)展模式概況
跨國(guó)醫(yī)藥公司通常具有較為復(fù)雜的發(fā)展模式��,以應(yīng)對(duì)快速變化的全球醫(yī)藥市場(chǎng)與不斷更新的國(guó)際監(jiān)管要求��。
2.1 運(yùn)營(yíng)模式
跨國(guó)醫(yī)藥公司的運(yùn)營(yíng)模式主要分為2 種:研發(fā)驅(qū)動(dòng)型和市場(chǎng)驅(qū)動(dòng)型��。研發(fā)驅(qū)動(dòng)型運(yùn)營(yíng)主要是指采用研發(fā)驅(qū)動(dòng)模式�����,將創(chuàng)新作為主要競(jìng)爭(zhēng)優(yōu)勢(shì)�����。這些公司通常在全球范圍內(nèi)擁有龐大的研發(fā)團(tuán)隊(duì)����,并投入大量資金用于新藥研發(fā)。市場(chǎng)驅(qū)動(dòng)型運(yùn)營(yíng)主要是指采用市場(chǎng)驅(qū)動(dòng)模式��,注重市場(chǎng)營(yíng)銷和銷售����,將產(chǎn)品推向全球市場(chǎng)����。這些公司通常在全球范圍內(nèi)建立了強(qiáng)大的銷售網(wǎng)絡(luò)和分銷渠道,以確保產(chǎn)品的廣泛覆蓋和市場(chǎng)份額的增長(zhǎng)��。
2.2 全球布局
跨國(guó)醫(yī)藥公司在全球布局時(shí)重點(diǎn)考慮總部協(xié)調(diào)�����、研發(fā)設(shè)計(jì)與生產(chǎn)基地����。總部協(xié)調(diào)即總部地區(qū)規(guī)劃,跨國(guó)醫(yī)藥公司通常在全球范圍內(nèi)的政治金融中心設(shè)立總部����,以便管理和協(xié)調(diào)各地業(yè)務(wù),總部負(fù)責(zé)制定地區(qū)戰(zhàn)略��、管理運(yùn)營(yíng)活動(dòng)����,并與當(dāng)?shù)卣⑿袠I(yè)組織和合作伙伴等溝通交流�����。研發(fā)設(shè)計(jì)即布局研發(fā)中心����,跨國(guó)醫(yī)藥公司通常在全球范圍內(nèi)的人才聚集地設(shè)立研發(fā)中心,以便充分利用當(dāng)?shù)氐目蒲腥肆Y源開(kāi)展藥物研發(fā)和創(chuàng)新活動(dòng)�����,研發(fā)中心通常擁有先進(jìn)的實(shí)驗(yàn)設(shè)備和技術(shù)平臺(tái)����,致力于研發(fā)新藥物��?����?鐕?guó)醫(yī)藥公司的生產(chǎn)基地主要分布在全球范圍內(nèi)資源豐富之處����,以滿足不同國(guó)家和地區(qū)的市場(chǎng)需求����,生產(chǎn)基地通常按照國(guó)際標(biāo)準(zhǔn)建設(shè),并受當(dāng)?shù)乇O(jiān)管機(jī)構(gòu)的監(jiān)管����。
2.3 國(guó)際化戰(zhàn)略
部分跨國(guó)醫(yī)藥公司采用標(biāo)準(zhǔn)化戰(zhàn)略����,即在不同國(guó)家和地區(qū)使用相同的品牌和產(chǎn)品,并采用統(tǒng)一的營(yíng)銷和銷售策略��。這種戰(zhàn)略有助于降低成本�����,提高效率,增強(qiáng)品牌影響力��。另有部分跨國(guó)醫(yī)藥公司采用本地化戰(zhàn)略�����,根據(jù)不同國(guó)家和地區(qū)的文化����、法規(guī)和市場(chǎng)需求,定制產(chǎn)品以及營(yíng)銷和銷售策略��。這種戰(zhàn)略可以更好地適應(yīng)當(dāng)?shù)厥袌?chǎng)環(huán)境����,提高產(chǎn)品的市場(chǎng)競(jìng)爭(zhēng)力。目前����,較多跨國(guó)醫(yī)藥公司樂(lè)于與當(dāng)?shù)叵嚓P(guān)組織和機(jī)構(gòu)進(jìn)行戰(zhàn)略合作,共同開(kāi)發(fā)市場(chǎng)和推廣產(chǎn)品��,助其更好地理解當(dāng)?shù)厥袌?chǎng)和行業(yè)環(huán)境����,更快實(shí)現(xiàn)市場(chǎng)準(zhǔn)入和增長(zhǎng)�����。
3 跨國(guó)醫(yī)藥公司實(shí)施ICH 指南面臨的挑戰(zhàn)
3.1 ICH 指南更新較快
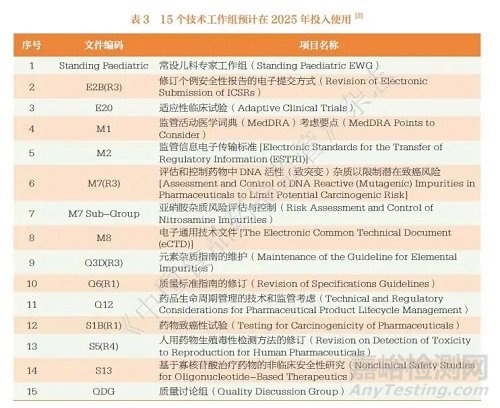
筆者分析ICH 官網(wǎng)發(fā)布的《2025 年度ICH 工作計(jì)劃》(ICH Association 2025 Annual Work Plan)[2] 發(fā)現(xiàn)����,ICH 于2024 年初步計(jì)劃了2025 年度5 類目工作��,其中戰(zhàn)略工作(Strategy)6 項(xiàng)��、協(xié)調(diào)工作(Harmonisation)4 項(xiàng)����、運(yùn)營(yíng)工作(Operations)22 項(xiàng)、程序工作(Procedures)3 項(xiàng)��、溝通交流工作(Communication)4 項(xiàng)�����。此外��,工作計(jì)劃包含3 個(gè)附件:附件1 為10 個(gè)技術(shù)工作組預(yù)計(jì)在2025 年達(dá)到步驟4 或?qū)崿F(xiàn)最終交付�����,見(jiàn)表1 �����;附件2 為7個(gè)技術(shù)工作組預(yù)計(jì)在2025 年達(dá)到步驟2a/b�����,見(jiàn)表2 ����;附件3 為15 個(gè)技術(shù)工作組預(yù)計(jì)在2025 年投入使用,見(jiàn)表3��。ICH 指南逐年快速的更新與完善為跨國(guó)醫(yī)藥公司帶來(lái)了挑戰(zhàn)��,主要體現(xiàn)在以下3 個(gè)方面�����。
3.1.1 反應(yīng)時(shí)間壓力
跨國(guó)醫(yī)藥公司通常需要花費(fèi)大量時(shí)間和精力了解更新變化的ICH指南��,并將其應(yīng)用到業(yè)務(wù)實(shí)踐中��。不論是學(xué)習(xí)更新的ICH 指南�����,還是將ICH 指南轉(zhuǎn)化到實(shí)踐中,都需要較長(zhǎng)時(shí)間�����,這可能導(dǎo)致項(xiàng)目延遲或者影響產(chǎn)品上市規(guī)劃����,從而影響企業(yè)的收入和市場(chǎng)競(jìng)爭(zhēng)力。
3.1.2 技術(shù)難題壓力
部分ICH 指南的更新涉及技術(shù)要求的提升��,跨國(guó)醫(yī)藥公司需要采用新的技術(shù)以達(dá)到相關(guān)要求��。ICH 指南對(duì)非臨床研究與臨床試驗(yàn)數(shù)據(jù)管理具有嚴(yán)格的要求����,跨國(guó)醫(yī)藥公司需要具備先進(jìn)的數(shù)據(jù)采集、統(tǒng)計(jì)分析�����、整理歸納等技術(shù)��,還需要具備先進(jìn)的藥物安全評(píng)價(jià)技術(shù)和監(jiān)測(cè)手段����。此外,ICH 指南對(duì)藥品的生產(chǎn)工藝��、質(zhì)量控制和質(zhì)量保證等具有較高的標(biāo)準(zhǔn)�����,如在穩(wěn)定性�����、純度�����、雜質(zhì)等方面����,跨國(guó)醫(yī)藥公司需要建立健全質(zhì)量管理體系,確保藥品生產(chǎn)過(guò)程的合規(guī)性和產(chǎn)品質(zhì)量的穩(wěn)定性����。
3.1.3 成本增加壓力
跨國(guó)醫(yī)藥公司通常需要不斷投入資源用于員工培訓(xùn)與教育,以及與監(jiān)管機(jī)構(gòu)持續(xù)溝通等,以適應(yīng)ICH 指南的快速更新��。具體而言�����,跨國(guó)醫(yī)藥公司需要為員工提供有關(guān)ICH 指南的知識(shí)培訓(xùn)����,以確保員工了解和遵循相關(guān)要求,該成本可能涉及組織內(nèi)部培訓(xùn)課程�����、組織外部學(xué)習(xí)活動(dòng)以及雇傭?qū)I(yè)顧問(wèn)等費(fèi)用��。與監(jiān)管機(jī)構(gòu)溝通的成本是指跨國(guó)醫(yī)藥公司在日常運(yùn)營(yíng)過(guò)程中與監(jiān)管機(jī)構(gòu)進(jìn)行持續(xù)交流需要付出的成本�����。
3.2 國(guó)際監(jiān)管要求存在差異
3.2.1 實(shí)施進(jìn)度差異
不同國(guó)家和地區(qū)的藥品監(jiān)管機(jī)構(gòu)對(duì)于ICH 指南的實(shí)施進(jìn)度具有差異��。有的國(guó)家和地區(qū)能夠快速落實(shí)全部ICH 指南����,也有國(guó)家和地區(qū)受各種因素影響只能實(shí)施部分ICH 指南[3]��?���?鐕?guó)醫(yī)藥公司需要靈活調(diào)整項(xiàng)目計(jì)劃�����,選擇適合藥品先行進(jìn)入的國(guó)家和地區(qū)����,并確保及時(shí)提交和更新注冊(cè)申請(qǐng)�����。
3.2.2 注冊(cè)申請(qǐng)差異
不同國(guó)家和地區(qū)的藥品監(jiān)管機(jī)構(gòu)對(duì)于符合ICH 指南的藥品注冊(cè)申請(qǐng)的要求具有差異[4]��。一些國(guó)家和地區(qū)藥品監(jiān)管機(jī)構(gòu)要求提交詳細(xì)和全面的數(shù)據(jù)����,也有一些國(guó)家和地區(qū)藥品監(jiān)管機(jī)構(gòu)對(duì)部分?jǐn)?shù)據(jù)的要求較少?�?鐕?guó)醫(yī)藥公司需要根據(jù)不同國(guó)家和地區(qū)藥品監(jiān)管機(jī)構(gòu)的要求準(zhǔn)備申請(qǐng)資料����,確保其符合對(duì)應(yīng)市場(chǎng)的規(guī)范����。
3.2.3 審查標(biāo)準(zhǔn)差異
不同國(guó)家和地區(qū)的藥品監(jiān)管機(jī)構(gòu)可能采用不同的審查標(biāo)準(zhǔn)和評(píng)價(jià)方法對(duì)ICH 指南的符合性進(jìn)行審查����。一些國(guó)家和地區(qū)可能更加關(guān)注藥品的安全性,也有一些國(guó)家和地區(qū)可能更加注重藥品的療效和臨床效果�����?���?鐕?guó)醫(yī)藥公司需要根據(jù)不同國(guó)家和地區(qū)藥品監(jiān)管機(jī)構(gòu)的要求進(jìn)行不同的臨床試驗(yàn)設(shè)計(jì)和數(shù)據(jù)分析整理。
3.3 跨國(guó)醫(yī)藥公司內(nèi)部調(diào)整管理困難
3.3.1 內(nèi)部組織結(jié)構(gòu)和工作流程調(diào)整困難
首先��,部分跨國(guó)醫(yī)藥公司內(nèi)部存在組織文化差異����。跨國(guó)醫(yī)藥公司可能在不同國(guó)家和地區(qū)設(shè)有多個(gè)分支機(jī)構(gòu)��,每個(gè)分支機(jī)構(gòu)具有不同的組織文化和工作方式����,不同部門或團(tuán)隊(duì)可能對(duì)新的ICH指南持有不同的態(tài)度����。其次����,跨國(guó)醫(yī)藥公司不同部門或團(tuán)隊(duì)之間可能存在權(quán)力和利益沖突�����。例如����,研發(fā)部門通常希望加快新藥研發(fā)進(jìn)程,而質(zhì)量管理部門可能更關(guān)注合規(guī)性和產(chǎn)品質(zhì)量����,各方可能對(duì)適應(yīng)新的ICH 指南產(chǎn)生不同的意見(jiàn)。最后��,部分跨國(guó)醫(yī)藥公司內(nèi)部信息溝通和協(xié)調(diào)困難����。不同部門或團(tuán)隊(duì)之間信息溝通和交流困難��,可能導(dǎo)致新的ICH 指南的信息難以被有效傳達(dá)和理解����,影響變革的推進(jìn)和實(shí)施效果����。
3.3.2 內(nèi)部實(shí)現(xiàn)標(biāo)準(zhǔn)化困難
跨國(guó)醫(yī)藥公司在實(shí)施ICH 指南時(shí),其內(nèi)部在實(shí)現(xiàn)標(biāo)準(zhǔn)化過(guò)程中可能面臨多種挑戰(zhàn)�����。首先����,業(yè)務(wù)流程多元化。由于地理位置不同�����,市場(chǎng)需求存在差異�����,跨國(guó)醫(yī)藥公司在不同國(guó)家和地區(qū)的業(yè)務(wù)流程呈現(xiàn)多樣性��,其內(nèi)部要實(shí)現(xiàn)標(biāo)準(zhǔn)化,需要克服不同業(yè)務(wù)流程之間的差異挑戰(zhàn)����。其次,技術(shù)平臺(tái)不一致��?�?鐕?guó)醫(yī)藥公司在不同國(guó)家和地區(qū)可能使用不同的信息技術(shù)平臺(tái)和軟件系統(tǒng)來(lái)支持業(yè)務(wù)開(kāi)展��,技術(shù)平臺(tái)不一致可能導(dǎo)致數(shù)據(jù)整合和信息共享困難����,阻礙標(biāo)準(zhǔn)化的實(shí)現(xiàn)[5]�����。最后�����,標(biāo)準(zhǔn)化流程需要持續(xù)改進(jìn)��。實(shí)現(xiàn)標(biāo)準(zhǔn)化不是一次性的任務(wù)����,而是一個(gè)持續(xù)改進(jìn)的過(guò)程����?�?鐕?guó)醫(yī)藥公司需要建立有效的監(jiān)控機(jī)制和反饋機(jī)制����,及時(shí)發(fā)現(xiàn)和解決標(biāo)準(zhǔn)化過(guò)程中的問(wèn)題,并持續(xù)改進(jìn)標(biāo)準(zhǔn)化流程����,以確保其有效性和持續(xù)性。
4 跨國(guó)醫(yī)藥公司應(yīng)對(duì)ICH 指南更新的策略
4.1 加強(qiáng)溝通交流��,緊跟前沿動(dòng)態(tài)
跨國(guó)醫(yī)藥公司應(yīng)與藥品監(jiān)管機(jī)構(gòu)和行業(yè)協(xié)會(huì)保持密切溝通交流��,以確保及時(shí)獲取ICH 指南更新變化的重要信息����,使其運(yùn)營(yíng)符合最新的ICH 指南要求。一方面�����,跨國(guó)醫(yī)藥公司應(yīng)加強(qiáng)與不同國(guó)家和地區(qū)藥品監(jiān)管機(jī)構(gòu)的溝通與協(xié)調(diào),建立開(kāi)放����、透明的溝通渠道,定期進(jìn)行會(huì)議交流����,及時(shí)向監(jiān)管機(jī)構(gòu)報(bào)告項(xiàng)目進(jìn)展信息,積極回應(yīng)監(jiān)管機(jī)構(gòu)提出的問(wèn)題和疑慮����,與監(jiān)管機(jī)構(gòu)形成長(zhǎng)期穩(wěn)定的溝通交流關(guān)系,通過(guò)參與政府部門組織的會(huì)議和研討等活動(dòng)�����,建立持續(xù)改進(jìn)機(jī)制�����,不斷總結(jié)經(jīng)驗(yàn)教訓(xùn)��,提升內(nèi)部合規(guī)水平[6]����。另一方面,跨國(guó)醫(yī)藥公司應(yīng)積極與行業(yè)協(xié)會(huì)和倡導(dǎo)團(tuán)體溝通交流��,如IFPMA����、生物技術(shù)創(chuàng)新組織(Biotechnology Innovation Organization,BIO)����、EFPIA 等,分享相關(guān)經(jīng)驗(yàn)和資源����,共同推動(dòng)ICH 指南的制定和實(shí)施。
4.2 優(yōu)化內(nèi)部組織結(jié)構(gòu)
跨國(guó)醫(yī)藥公司可建立專門的團(tuán)隊(duì)或部門跟蹤ICH 指南合規(guī)工作��,并及時(shí)調(diào)整工作流程以滿足需要�����。該團(tuán)隊(duì)或部門可以是一個(gè)典型的跨職能工作組����,例如,其成員可以包含臨床試驗(yàn)、質(zhì)量管理��、藥物警戒等部門的代表����。此舉不僅可以兼顧各項(xiàng)工作的順利開(kāi)展,也考慮到公司內(nèi)部各方利益��,有利于ICH 指南的實(shí)施�����。此外�����,該團(tuán)隊(duì)或部門可負(fù)責(zé)不同部門之間的溝通協(xié)作�����,解決跨部門合作中的問(wèn)題和矛盾����,確保信息暢通����,并識(shí)別現(xiàn)存的瓶頸問(wèn)題�����,采取優(yōu)化措施����,建立健全質(zhì)量控制和風(fēng)險(xiǎn)管理系統(tǒng)��,確保所有業(yè)務(wù)活動(dòng)符合質(zhì)量標(biāo)準(zhǔn)和合規(guī)要求�����。
4.3 制定內(nèi)部標(biāo)準(zhǔn)化流程
跨國(guó)醫(yī)藥公司可制定和實(shí)施內(nèi)部標(biāo)準(zhǔn)化流程和操作規(guī)范����,并不斷改進(jìn),以確保持續(xù)遵循ICH指南要求�����,提高業(yè)務(wù)運(yùn)作的效率和質(zhì)量����,增強(qiáng)市場(chǎng)競(jìng)爭(zhēng)力����。首先��,全面分析和評(píng)估當(dāng)前的業(yè)務(wù)流程和操作規(guī)范��,確定與ICH 指南要求相符的部分�����,并認(rèn)定其為標(biāo)準(zhǔn)化流程�����,重點(diǎn)關(guān)注有待調(diào)整或持續(xù)更新的環(huán)節(jié)����。其次,確保已被認(rèn)定的標(biāo)準(zhǔn)化流程的質(zhì)量管控工作按照統(tǒng)一的標(biāo)準(zhǔn)進(jìn)行��,包括標(biāo)準(zhǔn)化的操作流程�����、文件模板����、記錄格式等[7]。最后����,建立持續(xù)改進(jìn)機(jī)制,不斷優(yōu)化和完善標(biāo)準(zhǔn)化流程和操作規(guī)范����,以適應(yīng)業(yè)務(wù)發(fā)展的需要和指南更新的要求。
5 對(duì)于跨國(guó)醫(yī)藥公司構(gòu)建質(zhì)量管理通用標(biāo)準(zhǔn)的思考
跨國(guó)醫(yī)藥公司需要在復(fù)雜多變的市場(chǎng)環(huán)境中重點(diǎn)關(guān)注并堅(jiān)持實(shí)施ICH 指南��,筆者探索構(gòu)建跨國(guó)醫(yī)藥公司的質(zhì)量管理通用標(biāo)準(zhǔn)����,以期為跨國(guó)醫(yī)藥公司進(jìn)行常態(tài)化運(yùn)營(yíng)的合理監(jiān)管提供參考。
5.1 嚴(yán)格執(zhí)行藥物非臨床研究質(zhì)量管理規(guī)范
跨國(guó)醫(yī)藥公司應(yīng)遵守藥物非臨床研究質(zhì)量管理規(guī)范(good laboratory practice����,GLP),以符合ICH 指南的相關(guān)要求��。精心設(shè)計(jì)研究方案����,確保研究結(jié)果的可靠性和可重復(fù)性�����。合理選擇動(dòng)物模型和研究方法��,避免潛在的偏差����。尋找并應(yīng)用新的技術(shù)和方法����,以提高研究效率和準(zhǔn)確性。建立完善的數(shù)據(jù)管理系統(tǒng)����,確保數(shù)據(jù)的完整性和安全性,并利用統(tǒng)計(jì)學(xué)方法對(duì)數(shù)據(jù)進(jìn)行深入分析��,發(fā)現(xiàn)其潛在的規(guī)律和趨勢(shì)�����。
5.2 優(yōu)化藥物臨床試驗(yàn)設(shè)計(jì)與執(zhí)行
跨國(guó)醫(yī)藥公司可通過(guò)開(kāi)展多中心臨床試驗(yàn)����、隨機(jī)雙盲對(duì)照試驗(yàn)等��,確保試驗(yàn)結(jié)果的準(zhǔn)確性和可靠性[8]����。同時(shí)�����,采用先進(jìn)的臨床試驗(yàn)技術(shù)和方法�����,如生物標(biāo)志物分析��、適應(yīng)性設(shè)計(jì)等�����,提高臨床試驗(yàn)效率和成本效益[9]��。
5.3 加強(qiáng)藥品生產(chǎn)與流通質(zhì)量管理
跨國(guó)醫(yī)藥公司應(yīng)建立健全質(zhì)量管理體系����,包括標(biāo)準(zhǔn)化的質(zhì)量控制流程����、質(zhì)量文檔管理系統(tǒng)����、質(zhì)量審核和評(píng)估機(jī)制等����。具體而言,建立標(biāo)準(zhǔn)化的質(zhì)量控制流程��,包括原材料采購(gòu)��、生產(chǎn)制造�����、包裝和分銷等環(huán)節(jié)的質(zhì)量控制和監(jiān)督��;制定可追溯的質(zhì)量文檔管理系統(tǒng)����,包括電子文檔管理系統(tǒng)、數(shù)據(jù)采集和分析平臺(tái)��、物聯(lián)網(wǎng)平臺(tái)等,實(shí)現(xiàn)數(shù)據(jù)的實(shí)時(shí)監(jiān)測(cè)和管理[10] ����;實(shí)施質(zhì)量審核和評(píng)估機(jī)制,定期對(duì)質(zhì)量管理體系進(jìn)行內(nèi)部審核和外部認(rèn)證��,以確保符合ICH指南和相關(guān)法規(guī)要求�����。
5.4 健全藥物警戒體系
跨國(guó)醫(yī)藥公司應(yīng)建立完善的藥物安全評(píng)價(jià)與監(jiān)測(cè)體系�����,包括臨床試驗(yàn)前��、臨床試驗(yàn)過(guò)程中和上市后的藥物安全監(jiān)測(cè)和報(bào)告機(jī)制�����。通過(guò)實(shí)時(shí)監(jiān)測(cè)��,及時(shí)發(fā)現(xiàn)并應(yīng)對(duì)藥物安全問(wèn)題����,保障患者的安全與權(quán)益。加強(qiáng)藥物風(fēng)險(xiǎn)評(píng)估與控制��,通過(guò)分析產(chǎn)品生命周期中可能存在的風(fēng)險(xiǎn)����,建立風(fēng)險(xiǎn)評(píng)估和管理控制體系,及時(shí)識(shí)別潛在的質(zhì)量風(fēng)險(xiǎn)�����,并采取措施加以預(yù)防和控制[11]����。
6 討論與小結(jié)
本文主要探析了跨國(guó)醫(yī)藥公司在實(shí)施ICH 指南時(shí)面臨的挑戰(zhàn),包括ICH 指南更新較快��、國(guó)際監(jiān)管要求存在差異�����、跨國(guó)醫(yī)藥公司內(nèi)部調(diào)整管理困難等��。針對(duì)這些挑戰(zhàn)��,筆者提出了相關(guān)對(duì)策思考��,如加強(qiáng)多方溝通以掌握ICH 更新的前沿動(dòng)態(tài)、優(yōu)化內(nèi)部組織結(jié)構(gòu)并建立標(biāo)準(zhǔn)化流程等��,以期幫助跨國(guó)醫(yī)藥公司更好地應(yīng)對(duì)ICH 指南的更新��,不斷提高產(chǎn)品質(zhì)量和合規(guī)水平�����。同時(shí)��,本文為跨國(guó)醫(yī)藥公司建立質(zhì)量管理通用標(biāo)準(zhǔn)提供了參考��,以期幫助跨國(guó)醫(yī)藥公司更好地實(shí)施ICH 指南����。需要說(shuō)明的是����,由于ICH 指南研究范圍廣泛且內(nèi)容深入,跨國(guó)醫(yī)藥公司受國(guó)際藥品監(jiān)管環(huán)境變化的影響較大�����,本文的分析不足以涵蓋全部要點(diǎn)����,有待進(jìn)一步完善�����。未來(lái)��,隨著全球藥品監(jiān)管趨于標(biāo)準(zhǔn)化與統(tǒng)一化�����,跨國(guó)醫(yī)藥公司需要不斷優(yōu)化和完善自身管理體系和運(yùn)營(yíng)策略��,加強(qiáng)合作伙伴關(guān)系和溝通交流�����,推動(dòng)數(shù)字化轉(zhuǎn)型�����,提高創(chuàng)新能力和管理水平����,以更好地適應(yīng)國(guó)際藥品監(jiān)管環(huán)境的變化����,保持競(jìng)爭(zhēng)優(yōu)勢(shì)��,應(yīng)對(duì)新的機(jī)遇與挑戰(zhàn)��。