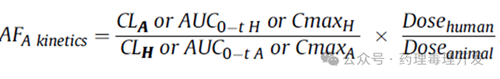每日允許暴露量(PDE)或每日可接受暴露量(ADE)指的是����,人類若終生每日通過任何途徑暴露于該劑量或以下劑量的物質(zhì),預(yù)計(jì)不會(huì)產(chǎn)生任何不良影響的劑量����。歐洲藥品管理局(EMA)的指南指出����,PDE和ADE在實(shí)際應(yīng)用中含義相同����。推導(dǎo)PDE的目的是將藥品中污染物的暴露限制在無不良健康影響的劑量范圍內(nèi)?���;诮】档?a href="http://www.bowken.cn/search/q-%E6%9A%B4%E9%9C%B2%E9%99%90%E5%80%BC.html">暴露限值(HBEL)方法會(huì)考慮物質(zhì)的特定屬性,包括藥理學(xué)特性����、效價(jià)、藥代動(dòng)力學(xué)特征����、不良作用類型以及非臨床和臨床安全性數(shù)據(jù)等。
PDE的計(jì)算公式
PDE=PoD×BW/(UFC×MF×PK)
其中����,PDE指允許日暴露量(毫克/天);PoD指基準(zhǔn)值����,通?���;趧?dòng)物����、臨床或流行病學(xué)數(shù)據(jù)中的無觀察(不良)效應(yīng)水平(NO(A)EL)、最低觀察(不良)效應(yīng)水平(LO(A)EL)����。對(duì)于非臨床數(shù)據(jù),通常采信GLP條件下開展的研究����。偶爾,當(dāng)無法確定NOAEL����、LOAEL,可將最低治療劑量水平(TDL)或每日治療劑量(TDD)用作基準(zhǔn)值����;BW指體重(千克)����。
MF指修正系數(shù)����,視數(shù)據(jù)的完整性情況����,考慮是否有必要設(shè)置修正因子MF。在存在較大的數(shù)據(jù)缺口����,且無法從其他數(shù)據(jù)方面得到間接的安全性支持,導(dǎo)致可能存在嚴(yán)重的毒性效應(yīng)無法評(píng)估的情況下����,可以設(shè)置MF因子。MF因子不同于常規(guī)的校正因子����,需要根據(jù)評(píng)估目標(biāo)的具體情況確定,取值范圍一般為1-10����。
PK指藥代動(dòng)力學(xué)調(diào)整系數(shù),需考慮目標(biāo)化合物的吸收、分布����、代謝、清除等體內(nèi)過程����,與此相關(guān)的需要考慮藥代動(dòng)力學(xué)因子的調(diào)節(jié),PK因子可進(jìn)一步細(xì)分為生物利用度α因子和蓄積效應(yīng)因子����。
UFC指復(fù)合不確定系數(shù)。UFC由5個(gè)因子組成����,F(xiàn)1×F2×F3×F4×F5����,不同因子的意義在ICH Q3C和ICH Q3D中均有介紹,F(xiàn)1為種屬間差異調(diào)整的因子����,F(xiàn)2為種屬內(nèi)����,即個(gè)體間差異校正因子,F(xiàn)3為暴露時(shí)間校正因子����,F(xiàn)4為毒性嚴(yán)重效應(yīng)調(diào)節(jié)因子,F(xiàn)5為未確定NOEL/NOAEL的可變因子����。比如在只有 LOEL 可用時(shí),根據(jù)毒性的嚴(yán)重程度����,可以使用高達(dá) 10 的因子����。顯而易見,各種調(diào)整因子有助于實(shí)現(xiàn)總體安全邊際,它是多個(gè)獨(dú)立因子的乘積����,這些因子用于解釋PoD相較于目標(biāo)人群的變異性和不確定性(例如從動(dòng)物外推至人類、個(gè)體間差異等)����。
種屬間差異調(diào)整因子F1(AFA)
種屬差異比較容易理解����,大部分化學(xué)物質(zhì)的毒性暴露是在動(dòng)物中研究的����,將動(dòng)物實(shí)驗(yàn)結(jié)果外推至人體時(shí)����,需考慮不同種屬在毒代動(dòng)力學(xué)(TK)和毒物效應(yīng)動(dòng)力學(xué)(TD)方面可能存在的差異。
很早之前����,使用10這一默認(rèn)值����,且不考慮物種(US EPA,1993)����,US EPA在近幾年才開始推薦將異速生長(zhǎng)縮放作為推導(dǎo)依據(jù)。這種早期方法可能源于Lehman和Fitzhugh(1954)提出的100倍安全因子的理念����。目前已不再沿用����。
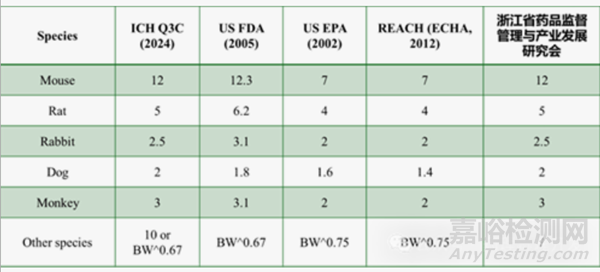
EMA、ICH Q3C����、FDA等指南均給出了推薦使用的調(diào)整因子F1(取值在2-12之間)����,如下表所示。未羅列的種屬可以基于異速生長(zhǎng)縮放的模型推導(dǎo)����。不同機(jī)構(gòu)的縮放指數(shù)略有區(qū)別,US EPA推薦BW的0.75次方����,ICH Q3C和FDA則推薦0.67次方����。有觀點(diǎn)認(rèn)為����,BW 0.75反映了代謝和生理參數(shù)的差異����,而BW 0.67與表面積/體積比的相關(guān)性更緊密����。當(dāng)然,對(duì)于異速縮放方法是否能同時(shí)覆蓋TK和TD種屬間變異����,還是僅能覆蓋TK的跨物種變異,不同指南之間還有爭(zhēng)議����,尚未完全達(dá)成一致。
當(dāng)已有足夠 TK/TD 數(shù)據(jù)����,且想取代默認(rèn)或異速生長(zhǎng)因子時(shí),用化學(xué)物質(zhì)特異性調(diào)整因子(CSAF)更科學(xué)。將AFA細(xì)分為TK和TD組分/子因子����,以及化學(xué)物特異性數(shù)據(jù)的使用����,可參考Reichard等人(2016)的相關(guān)資料,種屬間計(jì)算公式如下����。
個(gè)體間差異調(diào)整因子F2(AFH)
F2也可稱為種內(nèi)或人與人之間的差異調(diào)整因子����,用于解釋人群內(nèi)部在TK和TD方面的變異性,其目的是保護(hù)敏感亞群����。相較于用于確定“關(guān)鍵效應(yīng)”的研究人群����,這些亞群可能因年齡、性別����、遺傳因素����、既往疾病等原因更易受影響。EMA����、ICH Q3C(R9)、ICH Q3D(R2)以及我國浙江省藥品監(jiān)督管理與產(chǎn)業(yè)發(fā)展研究會(huì)發(fā)布的《藥品每日允許暴露量評(píng)估方法》指南中推薦用調(diào)整因子F2“解釋個(gè)體間差異”����,而Risk-MaPP為此推薦使用術(shù)語UFH,這些文件在該調(diào)整因子的應(yīng)用上是一致的����。
F2默認(rèn)值通常為10。設(shè)定合理F2的關(guān)鍵考量因素是����,敏感亞群接觸另一種藥物中的微量污染物時(shí),可能出現(xiàn)的效應(yīng)的發(fā)生概率和嚴(yán)重程度����。例如,對(duì)于已獲批藥物����,其產(chǎn)品標(biāo)簽(如包裝說明書)會(huì)明確亞群(如性別����、種族����、年齡)以及是否需要針對(duì)特定群體調(diào)整劑量����。通過作用機(jī)制也能識(shí)別敏感亞群(如血管緊張素轉(zhuǎn)換酶抑制劑的作用機(jī)制提示可能對(duì)胎兒產(chǎn)生影響)。這些數(shù)據(jù)能更全面地反映毒代動(dòng)力學(xué)和毒效動(dòng)力學(xué)對(duì)變異性的影響����,還可為設(shè)定非默認(rèn)的個(gè)體間差異因子提供依據(jù)。
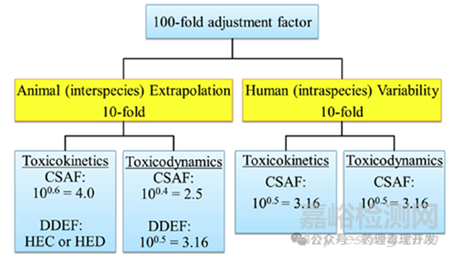
10倍默認(rèn)因子����,源于美國FDA早期開展的風(fēng)險(xiǎn)評(píng)估����,當(dāng)時(shí)生物數(shù)據(jù)有限,將種間外推和種內(nèi)個(gè)體間變異性的因子均設(shè)為10����,二者結(jié)合形成了“100倍安全因子”。數(shù)十年間����,隨著科學(xué)知識(shí)體系的發(fā)展,風(fēng)險(xiǎn)評(píng)估范式逐漸轉(zhuǎn)變����。這種脫離默認(rèn)因子的轉(zhuǎn)變,始于Renwick(1991)的提議����,他建議將種屬間和種屬內(nèi)各自10的默認(rèn)值細(xì)分為兩個(gè)子因子,一個(gè)解釋TK差異����,另一個(gè)解釋TD差異。當(dāng)有數(shù)據(jù)可用時(shí)����,這種細(xì)分十分有用,因?yàn)榭筛鶕?jù)情況����,分別利用TK和TD數(shù)據(jù)替代默認(rèn)值的部分內(nèi)容。在后續(xù)研究中����,Renwick(1993)發(fā)現(xiàn),TK差異通常大于TD差異����,因此建議將AFH(種屬間差異調(diào)整因子)和AFA(種屬內(nèi)個(gè)體間差異調(diào)整因子)的安全因子進(jìn)行不等分:TK部分設(shè)為4,TD部分設(shè)為2.5����。IPCS采納了Renwick(1993)提出的原則,但建議僅對(duì)種間因子進(jìn)行不等分����,TK部分為4倍,TD部分為2.5倍����;而種內(nèi)因子應(yīng)進(jìn)行等分(TK和TD部分均為3.16)����,原因是所分析的數(shù)據(jù)庫不足以支撐對(duì)人類變異性10倍因子進(jìn)行不等分����。
除已知特定基因多態(tài)性(如CYP2D6)與特定亞群的易感性相關(guān)的情況外,默認(rèn)值10對(duì)大多數(shù)化學(xué)物質(zhì)和大多數(shù)人群而言����,似乎具有足夠的保護(hù)作用。不過����,該因子并非要覆蓋人類敏感性的全部分布范圍,而是涵蓋從普通人群到敏感人群的范圍����。國際化學(xué)品安全規(guī)劃署(IPCS)在其關(guān)于設(shè)定耐受攝入量的指導(dǎo)文件中明確指出,“少數(shù)個(gè)體的特異質(zhì)性高敏感性(與大多數(shù)接受相同劑量暴露的個(gè)體相比����,對(duì)特定劑量物質(zhì)產(chǎn)生過度反應(yīng))不應(yīng)作為推導(dǎo)某化學(xué)物質(zhì)耐受攝入量的依據(jù)”。
已有指南指出����,當(dāng)有充足的化學(xué)物質(zhì)特異性數(shù)據(jù)時(shí)����,可使用數(shù)據(jù)推導(dǎo)的調(diào)整值替代默認(rèn)調(diào)整因子����。從定義上講����,默認(rèn)調(diào)整因子僅應(yīng)在缺乏相關(guān)數(shù)據(jù)時(shí)使用����。美國EPA方法中所述的數(shù)據(jù)推導(dǎo)外推因子(DDEF)以及IPCS方法中所述的化學(xué)物質(zhì)特異性調(diào)整因子(CSAF),旨在有TK和TD數(shù)據(jù)時(shí)替代默認(rèn)因子����。使用化學(xué)物質(zhì)特異性數(shù)據(jù)時(shí)需考慮多個(gè)因素����,包括該化學(xué)物質(zhì)本身還是其代謝物為活性物質(zhì)����、TK或TD數(shù)據(jù)與關(guān)鍵終點(diǎn)的相關(guān)性����,以及數(shù)據(jù)對(duì)受保護(hù)患者人群的代表性等。CSAF用于量化目標(biāo)人群相關(guān)亞群在TK和TD方面的“變異性”����。若該亞群能代表總體人群,且能提供關(guān)于他們之間差異(或相似性)的定量信息����,那么“不確定性”程度能大幅降低。在CSAF框架內(nèi)����,通過多個(gè)TK和TD參數(shù)評(píng)估個(gè)體間差異,這些參數(shù)可反映所評(píng)估化學(xué)物質(zhì)的全身暴露情況和藥理活性����。Reichard等(2016)更詳細(xì)地介紹了進(jìn)行這些調(diào)整所需的TD和TK數(shù)據(jù)以及相關(guān)流程����,公式如下����。AFH指的就是個(gè)體間差異因子,由分布尾部與集中趨勢(shì)的比值決定����。如果某個(gè)亞群(如人群分布的尾部)與普通人群存在顯著差異(即在相同劑量下����,AUC或Cmax顯著更高),則應(yīng)降低(向下調(diào)整)可接受暴露量����,以與正常(平均)健康個(gè)體的暴露量一致。所以����,TK不再是默認(rèn)因子3.16,而是以該公式計(jì)算獲得的因子為準(zhǔn)����。
使用CSAF并不一定意味著設(shè)定基于健康的限值時(shí)所用的“安全因子”會(huì)降低����。有時(shí)����,某化學(xué)物質(zhì)的現(xiàn)有數(shù)據(jù)顯示,其個(gè)體間變異性高于默認(rèn)值10所對(duì)應(yīng)的水平����。
用于計(jì)算TD變異性的參數(shù)與藥物的藥理學(xué)特性相關(guān),例如抗高血壓藥物的降血壓效果����,或針對(duì)貧血患者的紅細(xì)胞計(jì)數(shù)升高效果?���?赏ㄟ^接受相同劑量的受試者的相關(guān)終點(diǎn)的離體數(shù)據(jù)來評(píng)估TD的變異性。若測(cè)量了受試者的反應(yīng)變異性����,這些數(shù)據(jù)可直接用于推導(dǎo)CSAF,因?yàn)樗卜从沉薚K的變異性(CSAF_TK+TD)����。
總體而言����,各監(jiān)管機(jī)構(gòu)推薦的個(gè)體差異默認(rèn)調(diào)整因子是一致的����。難點(diǎn)在于如何處理偏離這些默認(rèn)值的情況,缺乏關(guān)于何時(shí)以及如何替換默認(rèn)因子的明確統(tǒng)一的指南����。在健康風(fēng)險(xiǎn)評(píng)估中,DDEF和CSAF方法已被廣泛采用����。
暴露時(shí)間調(diào)整因子F3
若ADE計(jì)算所用的PoD(基準(zhǔn)劑量)來自非終身研究����,需根據(jù)“暴露時(shí)長(zhǎng)越長(zhǎng),化學(xué)物引發(fā)不良效應(yīng)的劑量閾值越低”的假設(shè)����,應(yīng)用暴露時(shí)長(zhǎng)調(diào)整因子。根據(jù)ICH����、浙江省相關(guān)指南規(guī)定����。F3=1����,研究時(shí)間至少為動(dòng)物壽命一半(嚙齒動(dòng)物或兔為1年,貓����、狗和猴為7年)。F3=1����,涵蓋整個(gè)器官形成期的生殖研究。F3=2����,為期6個(gè)月的嚙齒動(dòng)物研究,或?yàn)槠?.5年的非嚙齒動(dòng)物研究����。F3=5,為期3個(gè)月的嚙齒動(dòng)物研究����,或?yàn)槠?年的非嚙齒動(dòng)物研究����。F3=10����,持續(xù)時(shí)間更短的研究。當(dāng)然����,這些都是默認(rèn)的調(diào)整因子。默認(rèn)調(diào)整因子僅適用于“無法獲取研究細(xì)節(jié)”的場(chǎng)景����。理想情況下����,應(yīng)結(jié)合以下信息綜合確定調(diào)整因子:1)觀察到的效應(yīng)是否隨時(shí)間“加重”或“在更低劑量下出現(xiàn)”����;2)若缺乏直接數(shù)據(jù),需評(píng)估效應(yīng)的作用機(jī)制(如藥效學(xué)蓄積潛力)和化合物的動(dòng)力學(xué)蓄積情況����。反之����,對(duì)于以下情況:1)未觀察到化合物蓄積����,且效應(yīng)未隨時(shí)間增強(qiáng);2)已有更長(zhǎng)暴露時(shí)長(zhǎng)的研究數(shù)據(jù)����;3)效應(yīng)為“短暫藥理作用”(除非發(fā)生動(dòng)力學(xué)蓄積,部分情況下甚至可能出現(xiàn)藥物耐受/快速耐受)����;4)已有慢性動(dòng)物研究數(shù)據(jù),且效應(yīng)未隨時(shí)間增強(qiáng)����;5)PoD來自“有限時(shí)長(zhǎng)的臨床試驗(yàn)”,但已有重復(fù)給藥動(dòng)物研究可評(píng)估“長(zhǎng)期暴露的潛在效應(yīng)”����。滿足以上條件之一時(shí),從短期研究外推至長(zhǎng)期暴露無需應(yīng)用調(diào)整因子����。所以����,并不是機(jī)械的套用默認(rèn)調(diào)整因子����,如果已經(jīng)獲得足夠多研究細(xì)節(jié),風(fēng)險(xiǎn)明確����,可以靈活調(diào)整。
毒性嚴(yán)重效應(yīng)調(diào)節(jié)因子F4
在推導(dǎo)PDE時(shí)����,各機(jī)構(gòu)對(duì)“效應(yīng)嚴(yán)重性”這一獨(dú)立調(diào)整因子的使用并不統(tǒng)一,且該因子的預(yù)期應(yīng)用場(chǎng)景也未完全明確����。比如EMA和ICH納入設(shè)立調(diào)整因子F4,適用于“嚴(yán)重毒性”場(chǎng)景����,例如非遺傳毒性致癌性����、神經(jīng)毒性����、致畸性����。規(guī)定,F(xiàn)4=1����,與母體毒性有關(guān)的胎兒毒性;F4=5����,無母體毒性的胎兒毒性;F4=5����,有母體毒性的致畸反應(yīng);F4=10����,無母體毒性的致畸反應(yīng)。反觀����,Risk-MaPP����、EPA����、
REACH并未單獨(dú)設(shè)立F4這個(gè)因子。
若使用嚴(yán)重性調(diào)整因子����,需嚴(yán)格遵循以下原則,避免評(píng)估偏差:
1)避免重復(fù)計(jì)算:需確保嚴(yán)重性相關(guān)考量未在其他因子中體現(xiàn)����。例如,當(dāng)LOAEL的依據(jù)是“嚴(yán)重效應(yīng)”(即遠(yuǎn)高于NOAEL與LOAEL的邊界值)時(shí)����,有時(shí)會(huì)采用更大的LOAEL-to-NOAEL外推系數(shù)。此時(shí)若再單獨(dú)加入嚴(yán)重性調(diào)整因子����,即屬于重復(fù)計(jì)算。
2)與數(shù)據(jù)庫完整性因子的區(qū)分:數(shù)據(jù)庫完整性因子用于應(yīng)對(duì)“現(xiàn)有數(shù)據(jù)未識(shí)別出最敏感終點(diǎn),可能遺漏嚴(yán)重終點(diǎn)”的擔(dān)憂����,而嚴(yán)重性調(diào)整因子則針對(duì)“已確認(rèn)的嚴(yán)重/不可逆毒性”����,二者針對(duì)場(chǎng)景不同,不可混淆����。
3)核心作用:僅當(dāng)化合物產(chǎn)生“PoD未直接覆蓋的嚴(yán)重/不可逆毒性”時(shí),才需引入嚴(yán)重性調(diào)整因子����,以補(bǔ)充安全邊際。其本質(zhì)是回答“若其他所有因子未提供足夠安全邊際����,‘評(píng)估偏差’的可接受程度如何”這一問題,常見應(yīng)用場(chǎng)景包括化合物存在遺傳毒性����、致癌性、致畸性或雌雄生殖毒性等情況����。
4)依賴科學(xué)判斷:應(yīng)用時(shí)需結(jié)合科學(xué)證據(jù)判斷——通?���;谒幮W(xué)效應(yīng)的PoD對(duì)應(yīng)的暴露量����,遠(yuǎn)低于產(chǎn)生更嚴(yán)重不良反應(yīng)的暴露量。例如����,若動(dòng)物研究顯示某藥物在高劑量下致畸形,但評(píng)估認(rèn)為其仍有足夠安全邊際支持治療用途����,則為PDE評(píng)估額外加入嚴(yán)重性調(diào)整因子F4即不恰當(dāng);反之����,若PoD本身基于“觀察到嚴(yán)重效應(yīng)的LOAEL”,則需加入該因子以提升PDE的安全邊際����。
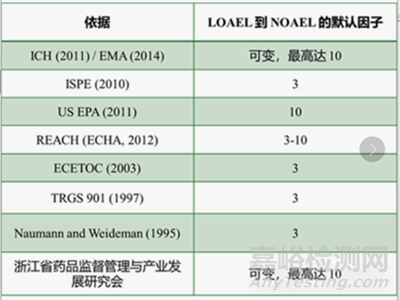
未確定NOEL/NOAEL的可變因子F5
當(dāng)無NOAEL作為PoD,僅能獲得LOAEL其它毒性效應(yīng)劑量時(shí)����,需借助調(diào)整因子計(jì)算PDE����。
EMA/ICH或者國內(nèi)浙江省相關(guān)指南推薦的調(diào)整因子F5是“在未確立無效應(yīng)水平時(shí)可能適用的可變因子����,若僅能獲得LOAEL����,可根據(jù)毒性嚴(yán)重程度使用最高達(dá)10的因子”。值得注意的是����,因子F4也涉及嚴(yán)重程度,因此EMA/ICH的方法存在一定重疊����。在缺乏充分劑量-反應(yīng)模型結(jié)果時(shí),可變因子的選擇需依靠科學(xué)判斷����,以估算需將劑量降低多少才能避免效應(yīng)發(fā)生(比如估算NOAEL)。影響估算的因素包括觀察到的效應(yīng)類型與嚴(yán)重程度����、劑量-反應(yīng)斜率等����。風(fēng)險(xiǎn)評(píng)估指南中通常推薦3-10的默認(rèn)因子����。若嚴(yán)重程度已作為修正因子的一部分或單獨(dú)因子(如依據(jù)ICH指南),需注意避免過度補(bǔ)償����。
通常,關(guān)于原料藥的藥理和臨床不良反應(yīng)有充足數(shù)據(jù)����,理想情況下應(yīng)將這些效應(yīng)的NOAEL作為PoD。但在某些情況����,如臨床給藥始于最低預(yù)期生物效應(yīng)水平(MABEL)時(shí)����,或?qū)τ诶吓f/仿制藥,化合物藥理效應(yīng)的NOAEL可能未在臨床研究中確定或不易獲取����。此時(shí)����,需通過對(duì)LOAEL����、MABEL或人類治療劑量應(yīng)用調(diào)整因子,外推至NOAEL����。
從LOAEL外推至NOAEL的因子����,最佳做法是基于觀察到的效應(yīng)的臨床意義和嚴(yán)重程度、劑量-反應(yīng)曲線及藥代動(dòng)力學(xué)/藥效學(xué)數(shù)據(jù)����,逐案進(jìn)行數(shù)據(jù)驅(qū)動(dòng)的決策。但需注意����,嚴(yán)重程度的評(píng)估具有主觀性,不同毒理學(xué)家可能有不同看法����,因此需在PDE文件中詳細(xì)說明專業(yè)判斷的依據(jù)����。例如����,若僅某一臨床病理參數(shù)出現(xiàn)輕微效應(yīng),且無其他效應(yīng)(如無組織病理學(xué)效應(yīng))����,或生物標(biāo)志物僅有微小變化(如酶抑制、基因表達(dá)改變等)但臨床或功能參數(shù)未變����,又或臨床病理的微小變化處于所研究動(dòng)物物種的正常變異范圍內(nèi),通常需用較小的因子����。其中部分效應(yīng)可能非不良反應(yīng),實(shí)際上應(yīng)視為NOAEL而非LOAEL����。反之,若靶器官(如肝����、心����、腎等)出現(xiàn)組織壞死����,則需用較大的因子。若僅能獲得FEL(即出現(xiàn)明顯甚至嚴(yán)重毒性效應(yīng)的劑量)����,可能需要大于10的因子,但更建議用修正因子替代大于10的LOAEL到NOAEL的外推因子����。
若無法獲得低于引起藥理效應(yīng)劑量的臨床研究數(shù)據(jù)����,可將與任何效應(yīng)相關(guān)的最低劑量作為PoD。最佳選擇是使用最敏感亞人群的最低治療劑量����,且將其作為PoD時(shí),可使用較低的個(gè)體間變異性因子����。人類最低治療劑量的10%通常無相關(guān)效應(yīng)����,但抗癌藥物需謹(jǐn)慎����,因其即使在治療劑量下也常出現(xiàn)顯著不良反應(yīng)。這類藥物給的是最大耐受劑量����,處于劑量-反應(yīng)曲線的另一端,可能需要應(yīng)用更高的因子����,需逐案考慮,且最好通過更大的修正因子處理����。腫瘤藥物的綜合調(diào)整因子,即UFC����,常超過1000。
修正因子MF
修正因子(Modifying Factor,MF)是PDE推導(dǎo)中用于“補(bǔ)償其他調(diào)整因子未覆蓋的殘余不確定性”的靈活工具����,其應(yīng)用需基于科學(xué)依據(jù)且避免與其他因子重復(fù)計(jì)算����。數(shù)據(jù)是否存在缺口����,即數(shù)據(jù)庫完整性是MF中的一項(xiàng)重要內(nèi)容。
數(shù)據(jù)庫完整性因子是對(duì)物質(zhì)現(xiàn)有毒理學(xué)信息“數(shù)量”與“質(zhì)量”的綜合判斷工具����,其核心作用是量化因數(shù)據(jù)缺失或質(zhì)量不足帶來的評(píng)估不確定性,為PDE推導(dǎo)提供科學(xué)依據(jù)����。若物質(zhì)具備“完整的藥理毒理學(xué)數(shù)據(jù)集”,該因子取值為1(表示無額外不確定性需補(bǔ)償)����;若數(shù)據(jù)存在缺失或質(zhì)量缺陷����,則需根據(jù)缺口程度提高因子數(shù)值(如3或10)。
EMA不單獨(dú)劃分“數(shù)據(jù)庫完整性因子”����,但將“數(shù)據(jù)缺失”(如生殖發(fā)育毒性數(shù)據(jù)缺失)納入“潛在修正因子”的考量范圍����。ICH及國內(nèi)浙江省藥品監(jiān)督管理與產(chǎn)業(yè)發(fā)展研究會(huì)相關(guān)指南未明確提及“數(shù)據(jù)庫完整性”相關(guān)獨(dú)立調(diào)整因子����。Risk-MaPP則設(shè)立“未開展研究因子(UFD)”,專門應(yīng)對(duì)“未進(jìn)行的關(guān)鍵研究(如生殖/發(fā)育毒性研究)可能得出比當(dāng)前PoD更低的NOAEL”這一風(fēng)險(xiǎn)����。
完整的數(shù)據(jù)包應(yīng)包含以下信息,缺一即可能需調(diào)整因子:1)PK與PD數(shù)據(jù):涵蓋臨床與非臨床研究����,包括二者關(guān)聯(lián)模型;2)非臨床毒理學(xué)研究:急性毒性����、重復(fù)給藥毒性(需覆蓋相關(guān)暴露途徑)、生殖毒性����、慢性毒性及致癌性研究;3)專項(xiàng)毒性研究:針對(duì)特定擔(dān)憂的研究,如免疫毒性研究����。
如果出現(xiàn)數(shù)據(jù)缺口,建議根據(jù)缺失數(shù)據(jù)的“關(guān)鍵程度”����,因子取值需科學(xué)判斷:1)高優(yōu)先級(jí)缺口(因子取3或10):若缺失“生殖/發(fā)育毒性”“致癌性”等關(guān)鍵數(shù)據(jù),且結(jié)合物質(zhì)作用機(jī)制或已知風(fēng)險(xiǎn)存在擔(dān)憂����,因子通常取3或10;2)低優(yōu)先級(jí)缺口(因子取較低值):若僅缺失“男性生育力”等局部數(shù)據(jù)����,且多數(shù)核心終點(diǎn)已覆蓋,可選取較低因子(如1-3之間)����。尤其當(dāng)物質(zhì)屬于“通常不與該類效應(yīng)相關(guān)的治療類別”時(shí),可進(jìn)一步降低����;3)特殊豁免情況(因子取1):若物質(zhì)無遺傳毒性����、動(dòng)物研究中無增殖效應(yīng)����,且已選擇“高敏感性PD終點(diǎn)”作為PoD����,即使缺失“非臨床致癌性研究”,也可認(rèn)為無需調(diào)整因子(因現(xiàn)有數(shù)據(jù)已足夠降低不確定性)����。
數(shù)據(jù)庫完整性因子不僅關(guān)注“數(shù)據(jù)數(shù)量”,還需評(píng)估“數(shù)據(jù)質(zhì)量”����,質(zhì)量缺陷可能導(dǎo)致因子取值高于1。評(píng)估數(shù)據(jù)質(zhì)量需覆蓋以下維度:1)科學(xué)有效性與穩(wěn)健性:數(shù)據(jù)是否符合科學(xué)原理����,結(jié)果是否可重復(fù);2)評(píng)估關(guān)聯(lián)性:數(shù)據(jù)是否與當(dāng)前PDE評(píng)估的場(chǎng)景(如暴露途徑����、種屬)匹配;3)文檔完整性:數(shù)據(jù)記錄是否清晰����、完整����,可追溯性強(qiáng)����;4)數(shù)據(jù)變異性:現(xiàn)有數(shù)據(jù)的波動(dòng)范圍是否在合理區(qū)間,是否存在異常值����;5)研究方法合規(guī)性:研究是否采用“當(dāng)前公認(rèn)的科學(xué)方法”,而非未驗(yàn)證的新型方法����。若數(shù)據(jù)在上述維度存在缺陷,不僅可能影響PoD的選擇����,還需提高數(shù)據(jù)庫完整性因子的數(shù)值,以補(bǔ)償質(zhì)量不足帶來的不確定性����。
包括數(shù)據(jù)庫相關(guān)調(diào)整因子在內(nèi),根據(jù)文獻(xiàn)(Dankovicetal.,2015)����,MF的典型考量方向涵蓋11類關(guān)鍵不確定性����,具體如下:1)關(guān)鍵效應(yīng)的劑量-反應(yīng)曲線斜率(如曲線過陡可能增加低劑量暴露風(fēng)險(xiǎn)����,需通過MF補(bǔ)償)����;2)關(guān)鍵效應(yīng)的選擇合理性(如是否遺漏更敏感的效應(yīng)端點(diǎn),需MF補(bǔ)充驗(yàn)證)����;3)效應(yīng)的嚴(yán)重性(與前文“嚴(yán)重性因子”的殘余缺口互補(bǔ),非重復(fù)計(jì)算)����;4)暴露途徑間的外推不確定性(如動(dòng)物經(jīng)口毒性數(shù)據(jù)外推至人類吸入暴露的缺口);5)易感亞人群的識(shí)別(如兒童����、孕婦等特殊人群的額外風(fēng)險(xiǎn)未被基礎(chǔ)因子覆蓋);6)關(guān)鍵效應(yīng)的臨床意義(如動(dòng)物實(shí)驗(yàn)中觀察到的效應(yīng)在人類臨床場(chǎng)景中的實(shí)際影響程度)����;7)關(guān)鍵效應(yīng)的可逆性(不可逆效應(yīng)的長(zhǎng)期風(fēng)險(xiǎn)未被充分補(bǔ)償時(shí))����;8)數(shù)據(jù)庫的整體質(zhì)量(與“數(shù)據(jù)庫完整性因子”的殘余缺口互補(bǔ)����,如數(shù)據(jù)雖完整但部分研究可靠性不足);9)關(guān)鍵效應(yīng)與患者亞人群的相關(guān)性(如動(dòng)物效應(yīng)是否適用于目標(biāo)治療人群)����;10)與同類化學(xué)品的相似性/差異性(如缺乏目標(biāo)物質(zhì)數(shù)據(jù)時(shí),基于同類物質(zhì)推斷的不確定性)����;11)各獨(dú)立調(diào)整因子間的非獨(dú)立性(如兩個(gè)因子均依賴同一數(shù)據(jù)集,可能導(dǎo)致不確定性被低估����,需MF修正)。
PK因子
PK因子可進(jìn)一步細(xì)分為生物利用度α因子和蓄積效應(yīng)因子����。對(duì)于這兩個(gè)因子的計(jì)算,浙江省藥品監(jiān)督管理與產(chǎn)業(yè)發(fā)展研究會(huì)發(fā)布的《藥品每日允許暴露量評(píng)估方法》指南中有詳細(xì)介紹����,不再贅述����。
綜合調(diào)整因子
由于部分獨(dú)立因子的評(píng)估范圍可能存在交叉����,直接相乘易導(dǎo)致綜合因子數(shù)值遠(yuǎn)超實(shí)際需求����,即“重復(fù)補(bǔ)償同一不確定性”。舉兩個(gè)例子����。
案例1:暴露時(shí)長(zhǎng)因子與數(shù)據(jù)庫完整性因子的重疊
場(chǎng)景:若僅存在28天大鼠研究(無90天或慢性研究),需同時(shí)考慮兩個(gè)因子:1)暴露時(shí)長(zhǎng)因子:因28天亞慢性研究外推至慢性暴露����,需提高該因子數(shù)值以補(bǔ)償“長(zhǎng)期暴露可能出現(xiàn)更低NOAEL”的風(fēng)險(xiǎn);2)數(shù)據(jù)庫完整性因子:因缺乏慢性研究����,可能考慮通過該因子補(bǔ)償數(shù)據(jù)缺口。
問題:二者本質(zhì)均針對(duì)“慢性研究缺失導(dǎo)致的不確定性”����,若同時(shí)提高兩個(gè)因子����,屬于“雙重補(bǔ)償”(double-dipping)����,不合理。
合理做法:數(shù)據(jù)庫完整性因子更應(yīng)保留用于“核心終點(diǎn)數(shù)據(jù)缺失”(如無生殖發(fā)育毒性研究)����,而非與暴露時(shí)長(zhǎng)因子重疊。
案例2:LOAEL-to-NOAEL外推因子與嚴(yán)重性因子的重疊
場(chǎng)景:若以“治療劑量”(如抗腫瘤藥的LOAEL或FEL����,即有害效應(yīng)水平)作為PoD,需考慮兩個(gè)因子:1)LOAEL-to-NOAEL外推因子:因PoD為有害效應(yīng)水平����,需更大外推因子以推導(dǎo)安全的NOAEL;2)嚴(yán)重性因子:治療劑量下觀察到的效應(yīng)可能具有嚴(yán)重性����,可能考慮額外補(bǔ)償。
問題:外推因子已隱含“有害效應(yīng)需更大安全邊際”的考量,再疊加嚴(yán)重性因子易導(dǎo)致過度補(bǔ)償����。
合理做法:優(yōu)先通過修正因子(MF)補(bǔ)償殘余不確定性,而非重復(fù)使用獨(dú)立因子����。
另外,提醒一下����,PDE通常以毫克/天為單位呈現(xiàn)����。因此,若基準(zhǔn)值來自藥理學(xué)或毒理學(xué)研究����,可能需要將其轉(zhuǎn)換為質(zhì)量/天單位。進(jìn)行單位轉(zhuǎn)換時(shí)����,可假設(shè)體重為50千克,體表面積為37千克/平方米或1.35平方米����。有觀點(diǎn)認(rèn)為����,與其他文獻(xiàn)中建議的60千克或70千克體重相比����,以50千克體重為標(biāo)準(zhǔn)可提供額外的安全系數(shù)。
關(guān)于PDE和OEL
另外����,有時(shí)會(huì)用到職業(yè)暴露限值(OEL)推導(dǎo)PDE,但PDE與OEL還是有些區(qū)別的����。在為評(píng)估選擇用于計(jì)算PDE的調(diào)整因子時(shí),必須明確評(píng)估的目標(biāo)人群����,并確定是否存在易感亞群。例如����,PDE的目標(biāo)人群可能與OEL不同,OEL主要針對(duì)健康的在職成年人����。工作場(chǎng)所中可能也存在一定規(guī)模的敏感亞群(如育齡女性����、哮喘患者等)����,但在OEL場(chǎng)景中,推導(dǎo)暴露限值時(shí)納入兒童����、老年人或重病患者可能并不合適;而計(jì)算PDE時(shí)����,可能需要考慮這些亞群及其他群體,因?yàn)镻DE值通常適用于使用藥品的全體人群����。OEL和PDE的其他差異還包括暴露途徑和暴露持續(xù)時(shí)間����,因此用于推導(dǎo)PDE的調(diào)整因子可能與OEL不同。鑒于這些差異����,OEL僅應(yīng)作為估算PDE的篩選工具����,用于識(shí)別高風(fēng)險(xiǎn)產(chǎn)品����,且需在合格毒理學(xué)家或其他專家的協(xié)助下進(jìn)行。但OEL和PDE的推導(dǎo)基礎(chǔ)相似����,通常都基于相同的基礎(chǔ)數(shù)據(jù)庫,采用許多相同的科學(xué)原理����,且在OEL或PDE推導(dǎo)方面的進(jìn)展通常對(duì)兩種限值都適用。
PoD選擇
治療效應(yīng)����、亞治療效應(yīng)與藥效學(xué)(PD)效應(yīng)
將臨床劑量用作PoD時(shí),可把最敏感人群中推薦的最低治療劑量作為基準(zhǔn)值����。在進(jìn)行PDE外推時(shí),需考慮藥品的給藥方案:對(duì)于每日給藥不止一次的原料藥(例如每日兩次分劑量給藥)����,應(yīng)采用人類每日總治療劑量����;對(duì)于每日給藥不足一次的原料藥(如每周一次等給藥方案)����,通常可將按比例折算的每日劑量用作基準(zhǔn)值����,即單次劑量除以給藥間隔天數(shù)。若劑量(如抗癌藥物劑量)按體表面積計(jì)算����,可采用50千克成年人體表面積1.35平方米的數(shù)據(jù)。
治療劑量雖可作為合適的基準(zhǔn)值����,但在某些情況下,來自藥效學(xué)數(shù)據(jù)的基準(zhǔn)值可能更為精確����。在部分案例中����,可從PK/PD模型中確定最小預(yù)期生物效應(yīng)水平(MABEL)����,或從人類PK/PD模型中外推得出無預(yù)期生物效應(yīng)水平����。盡管1期臨床試驗(yàn)的藥效學(xué)數(shù)據(jù)不如2期和3期數(shù)據(jù)全面,但由于該階段會(huì)測(cè)試亞治療劑量并測(cè)定敏感生物標(biāo)志物����,因此對(duì)于基準(zhǔn)值的選擇仍具有重要價(jià)值。無不良效應(yīng)報(bào)告的劑量水平也可作為基準(zhǔn)值����。根據(jù)藥效學(xué)效應(yīng)推導(dǎo)PDE時(shí),所采用的不確定系數(shù)通常低于基于治療劑量或不良效應(yīng)計(jì)算時(shí)的系數(shù)����。
仿制藥的PoD
仿制藥通常已經(jīng)上市很多年,推導(dǎo)HBELs時(shí)����,常面臨的問題是詳細(xì)數(shù)據(jù)的可獲得性。在許多情況下����,僅能獲取藥品的摘要或說明書����,而缺乏非臨床或臨床研究中的NOAEL或劑量反應(yīng)相關(guān)信息����。這種情況下,可謹(jǐn)慎將臨床劑量����、后期臨床試驗(yàn)的人類數(shù)據(jù)、藥物警戒數(shù)據(jù)����、遵循良好流行病學(xué)實(shí)踐指南的流行病學(xué)研究及病例報(bào)告用作PoD。對(duì)于相同終點(diǎn)(如藥代動(dòng)力學(xué)����、藥理效應(yīng)及不良效應(yīng)的劑量依賴性),人類數(shù)據(jù)比動(dòng)物數(shù)據(jù)更具相關(guān)性����。
遺傳毒性物質(zhì)的PoD
推導(dǎo)遺傳毒性物質(zhì)的PDE時(shí),ICH M7指南中描述的原則十分有用����。該指南建議在以下情況應(yīng)用毒理學(xué)關(guān)注閾值(TTC):(i)在細(xì)菌試驗(yàn)中顯示有致突變性,但缺乏充足的體內(nèi)嚙齒類動(dòng)物致癌性數(shù)據(jù)的化合物����;(ii)無法確定遺傳毒性閾值的化合物;(iii)通過計(jì)算機(jī)模型預(yù)測(cè)在細(xì)菌試驗(yàn)中可能有致突變性����,但無致突變性數(shù)據(jù)的化合物。若缺乏體外數(shù)據(jù)����,ICH M7要求采用兩種計(jì)算機(jī)建模方法預(yù)測(cè)致突變性。
對(duì)于無致突變性結(jié)構(gòu)警示的非致突變遺傳毒性化合物����,ICH M7建議采用假設(shè)存在閾值機(jī)制的風(fēng)險(xiǎn)評(píng)估方法。在體外和/或體內(nèi)染色體畸變?cè)囼?yàn)中呈陽性����,但在體外Ames試驗(yàn)(或其他等效致突變性試驗(yàn))中呈陰性的化合物,可能不會(huì)直接與DNA發(fā)生反應(yīng)����。對(duì)于僅體外細(xì)胞遺傳學(xué)毒性數(shù)據(jù)呈陽性的化合物����,在最終確定PDE前����,需對(duì)該化合物和/或其所屬化學(xué)類別的現(xiàn)有數(shù)據(jù)進(jìn)行進(jìn)一步評(píng)估。
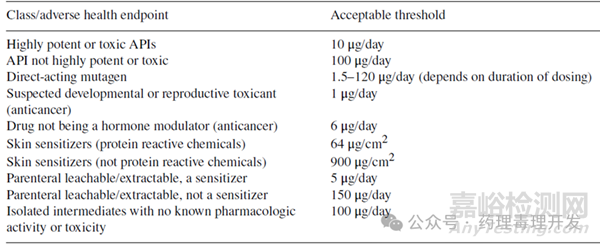
若能確定致突變性的閾值機(jī)制����,可將估算的NOAEL用作推導(dǎo)PDE的基準(zhǔn)值。若已證實(shí)明確的遺傳毒性作用機(jī)制����,且有可靠的動(dòng)物致癌性數(shù)據(jù),可對(duì)腫瘤數(shù)據(jù)進(jìn)行建模����,基于1/10?超額癌癥風(fēng)險(xiǎn)的基準(zhǔn)值推導(dǎo)PDE。若化合物顯示出遺傳毒性作用機(jī)制����,但缺乏可靠的體內(nèi)數(shù)據(jù),可將1.5μg/天的TTC視為PDE����。
用于嚴(yán)重或危及生命適應(yīng)癥的原料藥(API)的PoD
對(duì)于用于嚴(yán)重或危及生命適應(yīng)癥(如癌癥)的藥物����,NOAEL缺失是常見問題����。此外����,抗癌藥對(duì)患者的風(fēng)險(xiǎn)容忍度更高。用于嚴(yán)重適應(yīng)癥的原料藥的劑量選擇通常由耐受性和療效決定����,且由于無法規(guī)要求建立NOAEL,這類藥物的研發(fā)往往在缺乏該信息的情況下推進(jìn)����。抗癌藥非臨床研究中得出的10%嚴(yán)重毒性翻譯劑量(STD10)或未引發(fā)嚴(yán)重毒性反應(yīng)的最高劑量(HNSTD)可用作基準(zhǔn)值����。
此類適應(yīng)癥的臨床研究通常在不良事件背景發(fā)生率較高的患者人群中開展,難以確定適用于PDE計(jì)算的關(guān)鍵效應(yīng)����。在這些情況下����,建議考慮有充足臨床信息支持的治療日劑量數(shù)據(jù)����。
生物藥物的PoD
生物藥物的PoD選擇與小分子藥物類似,但也有些差異����。就生物藥而言,受其固有特性影響����,部分?jǐn)?shù)據(jù)(如遺傳毒性和致癌性數(shù)據(jù))無法獲取。生物藥大多不會(huì)表現(xiàn)出脫靶毒性����,但可能因放大的藥理學(xué)作用和/或免疫原性而產(chǎn)生不良效應(yīng)。因此����,研究中可能在最高劑量下確定NOAEL,但較低劑量下仍可能存在藥理效應(yīng)����。所以在這類情況下����,PK/PD模型和人體數(shù)據(jù)對(duì)于基準(zhǔn)值的選擇更具相關(guān)性����。
抗生素、抗病毒藥和抗真菌藥的PoD
非人類靶點(diǎn)藥物(即抗生素����、抗病毒藥和抗真菌藥)的PoD選擇應(yīng)個(gè)案處理����。這些藥物以外來病原體為靶點(diǎn),而非人體自身����。在這種情況下,藥理效應(yīng)可能并不相關(guān)����,因?yàn)閷?duì)于無外來病原體的人群而言,藥物不會(huì)產(chǎn)生作用����。同時(shí)還需考慮:藥物殘留水平不應(yīng)導(dǎo)致外來病原體對(duì)藥物產(chǎn)生耐藥性����,且藥物不應(yīng)影響正常的腸道菌群����。微生物學(xué)PDE的推導(dǎo)可借鑒獸醫(yī)領(lǐng)域的方法——該領(lǐng)域會(huì)利用體外或體內(nèi)抗菌數(shù)據(jù),為消費(fèi)品(如肉類和牛奶)中的抗菌殘留制定基于健康的限值����。
數(shù)據(jù)存在缺口的藥物的PoD
在藥物研發(fā)過程中,由于許多研究仍在開展或尚未開展����,必然會(huì)存在數(shù)據(jù)缺失的情況。因此����,隨著時(shí)間推移,更多數(shù)據(jù)得以獲取后����,PoD可能會(huì)發(fā)生變化。對(duì)于此類情況����,應(yīng)選定基準(zhǔn)值并進(jìn)行后續(xù)的PDE計(jì)算����,同時(shí)在計(jì)算中納入考慮數(shù)據(jù)不確定性或不完整性的系數(shù)����。由于該方法存在不確定性,在某些情況下����,根據(jù)數(shù)據(jù)的可獲得性,或許可放棄PDE推導(dǎo)����,轉(zhuǎn)而采用危險(xiǎn)分級(jí)或TTC方法����。此外,也可采用交叉參照法����,借助同類相關(guān)化合物或結(jié)構(gòu)相似化合物的數(shù)據(jù)來選擇基準(zhǔn)值。
眼部藥物的PoD
若缺乏動(dòng)物或人體眼部給藥途徑的研究數(shù)據(jù)����,應(yīng)將最小局部眼部治療劑量或最低藥理有效劑量(以毫克/眼/天表示)用作PoD����。根據(jù)觀察到的效應(yīng)的顯著性����,該劑量可視為L(zhǎng)OAEL或NOAEL。根據(jù)已發(fā)表的文獻(xiàn)����,局部眼部藥物的眼內(nèi)生物利用度低于5%。因此����,生物利用度因子可按以下方式推導(dǎo):
生物利用度因子(α)=5%(局部給藥)/100%(靜脈給藥)
由于自然屏障的存在,用于全身給藥的藥物在眼部的生物利用度預(yù)計(jì)也在5%或以下����。
若需將全身PDE轉(zhuǎn)換為眼部允許日暴露量,可使用系數(shù)150����,如下式所示:
眼部PDE[微克/眼/天]=靜脈給藥ADE[微克/天]/(3000×0.05)=靜脈給藥ADE[微克/天]/150
成人單眼重量約為7.5克,占總體重的比例不足0.05%——與全身重量相比����,這相當(dāng)于約3000的系數(shù)(假設(shè)雙眼重量為15克����,人體體重為50千克����,則轉(zhuǎn)換系數(shù)為:50千克/15克=3333,取整為3000)����。
妥布霉素眼部PDE計(jì)算
以妥布霉素(CAS號(hào):32986-56-4)為例,一種氨基糖苷類抗生素����,市售有吸入劑、靜脈注射劑和眼用制劑等劑型����。該藥物無遺傳毒性����、生殖毒性及致癌性。其眼用制劑為0.3%溶液(3mg/ml)����,對(duì)于輕����、中度眼部疾病����,推薦每4小時(shí)向患病眼滴入1-2滴;若為嚴(yán)重感染����,則需每小時(shí)滴2滴,直至病情好轉(zhuǎn)����。
妥布霉素眼用溶液的不良反應(yīng)包括過敏反應(yīng)和局部眼部毒性,如眼瞼瘙癢����、腫脹及結(jié)膜充血,這些反應(yīng)在受試患者中的發(fā)生率低于3/100����。
在計(jì)算眼部PDE時(shí),考慮到每日總滴數(shù)為4滴����,按每毫升20滴的標(biāo)準(zhǔn)計(jì)算����,每滴含藥0.15mg(3mg÷20滴)����,以此確定最低劑量為0.6mg,即PoD����。
眼部PDE的計(jì)算公式為:
PDEocular=PoD÷(UF×PK)=LOAEL÷(UF×PK)
計(jì)算過程如下:
PDEocular=0.6÷(10×3×1)=20μg/天
其中,考慮的系數(shù)情況為:人群內(nèi)變異系數(shù)取10����;由于局部不良反應(yīng)僅在少數(shù)患者中報(bào)告,故將最低治療劑量視為觀察到的LOAEL����,系數(shù)取3;因給藥途徑與暴露途徑相同����,生物利用度系數(shù)取1����。
發(fā)育和生殖毒性(DARTs)的PoD
對(duì)于數(shù)據(jù)豐富的化學(xué)品����,可采用標(biāo)準(zhǔn)風(fēng)險(xiǎn)評(píng)估方法����,包括種屬結(jié)合差異,基于最相關(guān)種屬的DART數(shù)據(jù)來選擇PoD����。ICH建議,針對(duì)發(fā)育毒性����、生殖毒性等潛在嚴(yán)重效應(yīng),默認(rèn)調(diào)整因子(AF)最高為10����。不過,根據(jù)PoD對(duì)應(yīng)的DART效應(yīng)可能性����、效應(yīng)的嚴(yán)重程度或可逆程度,以及是否存在母體毒性,AF可能會(huì)降低����。
TTC概念已從致癌性和慢性全身毒性擴(kuò)展到發(fā)育和生殖毒性領(lǐng)域。有研究提出分級(jí)TTC法:根據(jù)作用機(jī)制����、化學(xué)結(jié)構(gòu)和藥理活性,對(duì)DART可能性低的化合物����,PDE設(shè)為100μg/天;DART風(fēng)險(xiǎn)中等的����,PDE設(shè)為10μg/天;具有高風(fēng)險(xiǎn)生殖毒性(即涉及細(xì)胞增殖或生殖/發(fā)育功能機(jī)制)的化合物����,PDE設(shè)為1μg/天。通過對(duì)大量抗腫瘤藥的DART數(shù)據(jù)進(jìn)行分析����,建議:疑似發(fā)育毒性藥物的DART-TTC值為1μg/天;發(fā)育和生殖毒性未知的����,為3μg/天;若藥物非激素調(diào)節(jié)劑����,則為6μg/天。
免疫調(diào)節(jié)劑的PoD
當(dāng)I型超敏反應(yīng)為關(guān)鍵效應(yīng)時(shí)����,毒理學(xué)家在設(shè)定PDE時(shí)需考慮多個(gè)方面。首先����,即時(shí)過敏反應(yīng)被視為閾值效應(yīng)。PoD的確定應(yīng)基于誘導(dǎo)或激發(fā)I型超敏反應(yīng)的劑量����。若無法針對(duì)這些效應(yīng)估算NOAEL,則需根據(jù)現(xiàn)有LOAEL與NOAEL的差值大小����,以及致敏個(gè)體中是否引發(fā)超敏反應(yīng)的劑量相關(guān)信息,對(duì)LOAEL應(yīng)用額外的調(diào)整因子����。
盡管尚未明確具體閾值����,但將暴露量降至低于藥理活性劑量����,應(yīng)能減少對(duì)表現(xiàn)出極罕見II型和III型超敏反應(yīng)的化合物的擔(dān)憂。皮膚IV型致敏通常屬于職業(yè)性問題����,不用于推導(dǎo)口服或胃腸外給藥的PDE。不過����,它可用于推導(dǎo)經(jīng)皮給藥制劑的PDE。對(duì)于免疫抑制劑����,PoD為不會(huì)對(duì)個(gè)體免疫反應(yīng)產(chǎn)生不利影響的劑量。臨床應(yīng)用中罕見的IV型過敏反應(yīng)報(bào)告(如皮疹)����,并不意味著該藥物因在另一種藥物中存在微量污染而可能引發(fā)嚴(yán)重的全身性過敏。局部淋巴結(jié)試驗(yàn)預(yù)測(cè)的IV型過敏反應(yīng)����,無法預(yù)測(cè)人類的全身性過敏����,因此����,若沒有來自人類的其他陽性數(shù)據(jù)����,不能僅憑此就認(rèn)為這些藥物需要在專用設(shè)施中生產(chǎn)。
抗體藥物偶聯(lián)物(ADCs)的PoD
ADC由針對(duì)腫瘤細(xì)胞抗原的特異性抗體與非特異性細(xì)胞毒劑(或稱為“載荷”)連接而成����。雖然整個(gè)ADC對(duì)患者的毒性可能低于載荷,但與抗體連接的載荷具有極強(qiáng)的活性����,因此存在顯著危害。盡管ADC的設(shè)計(jì)初衷是使載荷僅作用于患病靶細(xì)胞����,但這一目標(biāo)的實(shí)現(xiàn)依賴于連接子技術(shù)的結(jié)合效率和抗體的特異性。ADC的脫靶效應(yīng)可能源于抗體并非100%針對(duì)靶細(xì)胞——盡管這些抗體被選擇用于靶向過度表達(dá)特定蛋白的細(xì)胞����,但可能存在其他細(xì)胞(雖表達(dá)量較低)仍會(huì)吸引這些抗體����。
HBEL值的推導(dǎo)需綜合評(píng)估臨床前和臨床數(shù)據(jù)����。快速估算時(shí)����,結(jié)合載荷的分子量與ADC的總分子量,以及藥物的HBEL����,可較好地近似得出ADC的HBEL。例如����,若某載荷的PDE為1μg/天,且ADC總分子量的10%為該載荷分子����,則該ADC的PDE約為10μg/天。
對(duì)于含抗腫瘤載荷的ADC����,不同暴露途徑(如口服����、吸入)的PDE相同����。原因是����,即使ADC的大分子部分在胃腸道中被分解代謝����,藥物分子仍會(huì)被吸收;或在肺部����,藥物分子會(huì)在沉積部位發(fā)揮局部作用。因此����,蛋白質(zhì)類產(chǎn)品通常關(guān)于生物利用度的假設(shè)(即口服途徑為0%,吸入途徑<5%)在此不適用����。
因此����,需重點(diǎn)考慮載荷毒性����、偶聯(lián)物的穩(wěn)定性(在靶組織中釋放前與抗體保持連接的能力)以及觀察到相關(guān)結(jié)果的毒性測(cè)試模型。早期開發(fā)中ADC的PDE推導(dǎo)方法需考慮:載荷在ADC中的分子量占比����、載荷-抗體偶聯(lián)率(DAR)以及連接子/載荷與抗體的解離百分比(游離載荷比例)。ADC的分子量約為150kDa����。PDE(ADC)基于載荷在ADC中的質(zhì)量占比,分子量占比將作為調(diào)整因子應(yīng)用于根據(jù)載荷數(shù)據(jù)確定的PoD����。在缺乏其他數(shù)據(jù)的情況下,該方法假設(shè)殘留ADC的毒性主要源于載荷����。由于載荷的分子量遠(yuǎn)小于ADC的分子量,估算的PDE(ADC)將遠(yuǎn)大于PDE(載荷)����。
計(jì)算公式如下:
PDE(ADC)=PDE(載荷)÷(DAR×MWR×D)
其中:
PDE(ADC):抗體藥物偶聯(lián)物的PDE(μg/天)����;
PDE(載荷):游離載荷的PDE(μg/天)����;
DAR:藥物-抗體比率(摩爾載荷/摩爾抗體);
D:游離載荷比例����;
MWR:分子量貢獻(xiàn)比=(載荷的克/摩爾)÷(ADC的克/摩爾)。
大分子的PoD
在操作層面����,影響小分子與大分子APIs生產(chǎn)的因素存在一些重要差異����。蛋白質(zhì)類產(chǎn)品在清潔過程中易降解為小分子片段或氨基酸,尤其是在pH值變化����、高溫等極端條件下。鑒于可通過適當(dāng)方法和分析技術(shù)證實(shí)大分子的降解/滅活情況����,因此有建議提出����,可將證實(shí)大分子降解/滅活作為PDE的替代方法����。目前已提出多種分析方法����,包括總有機(jī)碳(TOC)檢測(cè),或通過ELISA證實(shí)降解等其他方法����。
在評(píng)估蛋白質(zhì)類治療藥物經(jīng)口服或皮膚給藥的PDE時(shí),無需關(guān)注生物利用度����。當(dāng)?shù)鞍踪|(zhì)進(jìn)入酸性消化道后����,會(huì)被降解為人體自身含有的小分子肽和氨基酸;同時(shí)����,蛋白質(zhì)無法穿過完整的皮膚屏障����。因此����,口服或經(jīng)皮給藥的生物利用度可視為可忽略不計(jì),通常無需確定口服PDE(PDEoral)或經(jīng)皮PDE(PDEdermal)����。
玻璃體內(nèi)(IVT)給藥藥物的PoD
玻璃體內(nèi)給藥藥物的玻璃體內(nèi)PDE(PDEIVT)可基于人體治療劑量或非臨床玻璃體內(nèi)給藥劑量推導(dǎo)。若缺乏玻璃體內(nèi)給藥劑量數(shù)據(jù)����,有建議提出可采用500的默認(rèn)系數(shù)——將其應(yīng)用于靜脈注射PDE(PDEiv),雖屬保守方法����,但被認(rèn)為對(duì)患者安全����。
由于眼后段屬于相對(duì)封閉的腔室,因此更適合通過比較玻璃體液體積(4-5mL)與血漿體積(50kg患者約2500mL)����,從全身靜脈注射PDE(PDEiv)推導(dǎo)玻璃體內(nèi)給藥途徑的PDE����。從血漿體積(2500mL)外推至玻璃體液(5mL)的系數(shù)約為500����,計(jì)算公式如下:
PDEIVT(μg/天)=PDEiv(μg/天)÷500
當(dāng)無法針對(duì)特定化合物通過數(shù)據(jù)驅(qū)動(dòng)計(jì)算PDEIVT時(shí),應(yīng)采用500的系數(shù)����。
兒科人群的PoD
兒科人群的PDE可基于治療每日劑量計(jì)算,因?yàn)橄嚓P(guān)的臨床前或臨床研究可能尚未開展����。對(duì)于兒科人群,應(yīng)采用更低的體重?cái)?shù)值(兒童=10kg����,新生兒=3.5kg,早產(chǎn)兒=0.5kg)����。針對(duì)額外不確定性(如兒童酶系統(tǒng)未成熟)的額外修正因子,需由專家基于科學(xué)判斷確定����。
非原料藥(APIs)類化學(xué)品的PDE要求
除原料藥外����,其他化合物也需確定PDE����,具體如下文所述。
起始物料(SMs)與工藝中間體(PIs)
起始物料與工藝中間體可在用于其他原料藥或其他與原料藥相關(guān)的起始物料及工藝中間體的設(shè)備中生產(chǎn)����。針對(duì)起始物料和工藝中間體的毒理學(xué)測(cè)試通常僅限于急性研究,要么是為確保職業(yè)安全����,要么是為按照ICH M7指南解決與致突變雜質(zhì)相關(guān)的問題。
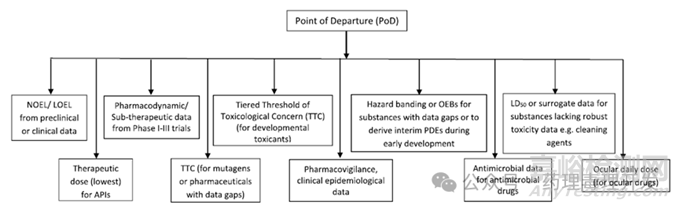
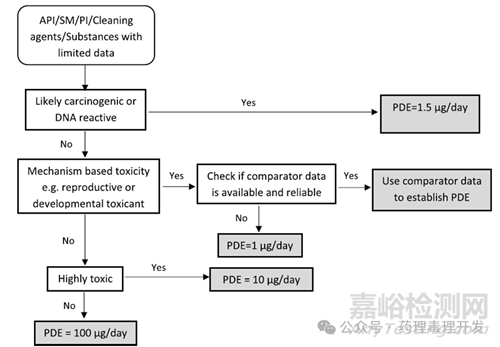
若預(yù)測(cè)某化合物具有危害性(例如致突變性)或具有較強(qiáng)的藥理學(xué)活性����,則應(yīng)考慮設(shè)定更低的控制限度。下圖展示了針對(duì)數(shù)據(jù)有限的物質(zhì)(原料藥����、起始物料����、工藝中間體����、清潔劑等)確定PDE的流程����。
清潔劑
清潔劑通常是多種物質(zhì)的混合物����,例如酸、堿����、洗滌劑等。然而����,其中許多已明確的成分往往缺乏推導(dǎo)允許日接觸量(PDE)所需的可靠毒理學(xué)數(shù)據(jù)。鑒于這些數(shù)據(jù)方面的限制����,清潔劑的限度通常通過不夠全面的默認(rèn)方法來推導(dǎo)����,比如將急性終點(diǎn)指標(biāo)(如半數(shù)致死量 LD50)除以較大的調(diào)整系數(shù)����,或是采用其他默認(rèn)數(shù)值����。
可提取物與浸出物(E&Ls)
對(duì)于可提取物與浸出物(E&Ls)����,需對(duì)現(xiàn)有毒理學(xué)信息進(jìn)行全面審查,以確定是否可通過調(diào)整系數(shù)����、動(dòng)物研究與人體的安全邊際對(duì)比來計(jì)算基于健康的暴露限度;若存在顯著數(shù)據(jù)缺口����,則需確定是否可采用類推法或通用默認(rèn)限度。
臨時(shí)PDEs
在原料藥的早期開發(fā)階段����,由于數(shù)據(jù)不完整而無法得出PDE數(shù)值時(shí),需采用臨時(shí)方法設(shè)定PDE����。設(shè)定臨時(shí)PDE的方法有多種:
此前,針對(duì)各類化學(xué)品/藥物采用了TTC法(如下表所示)����。該方法通常用于數(shù)據(jù)匱乏的物質(zhì),根據(jù)原料藥是否具有致突變性����、致敏性,是否為生殖或發(fā)育毒物����,或是否具有高毒性,存在多種TTC數(shù)值����。
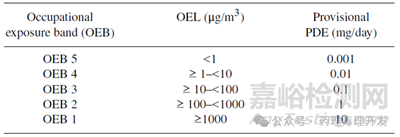
較新的臨時(shí)PDE設(shè)定方法是利用現(xiàn)有工人安全/職業(yè)暴露限度(OELs)中已包含的信息。在原料藥早期開發(fā)階段設(shè)定OELs面臨的挑戰(zhàn)����,可通過在設(shè)定OELs之前確定職業(yè)暴露帶(OEBs)來解決(見下表)。由于OEBs的設(shè)定早于殘留限度所需的PDE����,且兩者所依據(jù)的基礎(chǔ)數(shù)據(jù)集相似����,因此這些OEBs可用于確定臨時(shí)PDE����。
阿司匹林的PDE計(jì)算示例
阿司匹林是一種非甾體抗炎藥,在治療中用作抗凝血?jiǎng)?���、纖維蛋白溶解劑和血小板聚集抑制劑。ASA的理化性質(zhì)����、藥理學(xué)、作用機(jī)制����、藥代動(dòng)力學(xué)、非臨床及臨床安全性數(shù)據(jù)在公共領(lǐng)域可大量獲取����,其中包括部分監(jiān)管機(jī)構(gòu)和科學(xué)機(jī)構(gòu)對(duì)這些數(shù)據(jù)的評(píng)估結(jié)果。
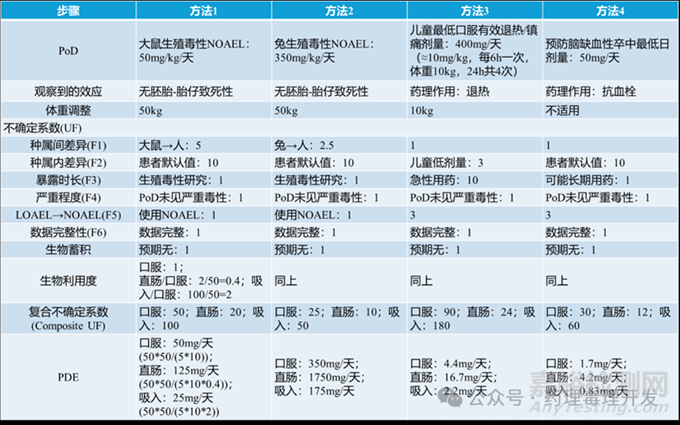
采用4個(gè)不同的PoD來推導(dǎo)ASA的PDE數(shù)值:
兩個(gè)非臨床PoD分別為ASA在大鼠和兔子中生殖毒性研究的NOAEL����。相比兔子����,大鼠對(duì)阿司匹林的生殖毒性更敏感����。
人類PoD分別為兒童和成人不同適應(yīng)癥的最低臨床治療劑量����。
雖然非臨床NOAEL數(shù)據(jù)可用作PoD,且能提供劑量-反應(yīng)曲線����,但這些數(shù)據(jù)可能與人體不相關(guān)。臨床試驗(yàn)中的多劑量研究數(shù)據(jù)優(yōu)先于非臨床數(shù)據(jù)����,但這類數(shù)據(jù)并不容易獲取。將藥物的最低治療劑量作為PoD是另一種選擇����,因?yàn)橹委焺┝渴墙?jīng)過大量臨床試驗(yàn)及對(duì)不同劑量下不良反應(yīng)的研究后確定的。類風(fēng)濕關(guān)節(jié)炎患者服用阿司匹林的最大劑量可達(dá)每日4000mg����。成人中與雙嘧達(dá)莫聯(lián)用作為抗血小板藥物時(shí)的最低口服劑量50mg(Aggrenox說明書)����,以及12歲以下兒童用作鎮(zhèn)痛/退熱藥時(shí)的口服劑量400mg(10mg/kg����,24小時(shí)內(nèi)共4次給藥,平均體重為10kg)����。
由于ASA在治療中可通過口服、直腸和吸入途徑給藥����,因此計(jì)算了這三種給藥途徑的PDE,如下表所示����。
成人人群的體重調(diào)整采用50kg,兒童劑量的體重調(diào)整采用10kg����。
種屬間轉(zhuǎn)換系數(shù)方面,從大鼠到人類的外推采用系數(shù)5����,從兔子到人類的外推采用系數(shù)2.5����。種屬內(nèi)變異系數(shù)方面����,方法1、2和4采用10����,而方法3因采用了兒童劑量(兒童是極為敏感的亞人群)����,故采用系數(shù)3。
對(duì)于涵蓋整個(gè)器官發(fā)生期的生殖毒性研究����,持續(xù)時(shí)間系數(shù)采用1。
兒童劑量因用于退熱時(shí)為急性給藥����,故持續(xù)時(shí)間系數(shù)采用10;成人治療劑量因用于抗血栓時(shí)需長(zhǎng)期給藥����,故持續(xù)時(shí)間系數(shù)采用1����。
美國預(yù)防服務(wù)工作組(US PSTF)建議����,50-59歲成人若10年心血管疾病(CVD)風(fēng)險(xiǎn)≥10%����、無出血風(fēng)險(xiǎn)增加、預(yù)期壽命至少10年且愿意每日服用低劑量阿司匹林至少10年����,可服用低劑量阿司匹林預(yù)防CVD和結(jié)直腸癌。
在從LOAEL到NOAEL的轉(zhuǎn)換中����,方法1和2因采用NOAEL作為PoD,故轉(zhuǎn)換系數(shù)采用1����;方法3和4因采用治療劑量作為PoD,故轉(zhuǎn)換系數(shù)采用3����。數(shù)據(jù)完整性系數(shù)采用1����,通常而言����,獲批藥物無需使用該系數(shù),因?yàn)楂@批前已生成所需數(shù)據(jù)����。
阿司匹林的半衰期較短,約為0.35小時(shí)����,因此給藥后1-2小時(shí)血漿中基本檢測(cè)不到其含量����,不存在生物蓄積的可能,故生物蓄積系數(shù)采用1����。ASA的口服生物利用度為50%,直腸生物利用度為20%����,因此將口服綜合不確定系數(shù)乘以0.4(20/50=直腸/口服生物利用度)����,即可得到直腸途徑的綜合不確定系數(shù)����。吸入生物利用度與靜脈注射相同,均為100%����,因此將口服綜合不確定系數(shù)乘以2(100/50=吸入/口服生物利用度),即可得到吸入途徑的綜合不確定系數(shù)����。
方法1和2得出的PDE數(shù)值處于治療劑量范圍內(nèi),因此我們認(rèn)為其不具相關(guān)性����。有研究表明,即使低劑量服用阿司匹林(每日30-50mg)����,也可能導(dǎo)致嚴(yán)重的胃腸道出血;另有研究報(bào)道����,每日服用10mg����、持續(xù)3個(gè)月會(huì)造成胃黏膜損傷����。因此,推薦采用方法4推導(dǎo)的PDE����,即口服PDE為1.7mg/天,該數(shù)值對(duì)阿司匹林長(zhǎng)期給藥時(shí)的所有不良反應(yīng)和藥理學(xué)效應(yīng)均具有充分的保護(hù)性����。
此示例表明,只有對(duì)現(xiàn)有完整的非臨床和臨床數(shù)據(jù)進(jìn)行全面審查后����,才能推導(dǎo)出基于健康的暴露限度(HBEL)數(shù)值。
數(shù)據(jù)來源
浙江省藥品監(jiān)督管理與產(chǎn)業(yè)發(fā)展研究會(huì)給出了PDE計(jì)算數(shù)據(jù)來源的一些建議����。
優(yōu)先選擇國際主流藥品監(jiān)管機(jī)構(gòu)的公開數(shù)據(jù)信息����,如EMA����、FDA����、NMPA和PMDA等,確認(rèn)以上來源是否有完整的動(dòng)物數(shù)據(jù)及人體數(shù)據(jù)����。如遇到藥品監(jiān)管機(jī)構(gòu)公開數(shù)據(jù)有限的情況,應(yīng)進(jìn)行其它權(quán)威數(shù)據(jù)庫和文獻(xiàn)的檢索����,可用數(shù)據(jù)庫包括但不限于PubMed、PubChem����、Toxline、Drugdex����、RTECS(化學(xué)物質(zhì)毒性數(shù)據(jù)庫)、NTP(美國國家毒理學(xué)計(jì)劃)����、CPDB(致癌性數(shù)據(jù)庫)����、IARC(國際癌癥研究機(jī)構(gòu))����、HSDB(有害物質(zhì)數(shù)據(jù)庫)、EFSA(歐洲食品安全局)����、ECHA(歐洲化學(xué)品管理局)等。