摘要
軟膏劑及乳膏劑是一種半固體制劑,通過局部給藥達到治療效果�����。本文結(jié)合該類劑型國內(nèi)外的開發(fā)及申報情況�,從處方工藝、質(zhì)量控制等多方面對該類劑型的藥學(xué)開發(fā)進行探討���,就該類劑型,僅以一隅之見從基質(zhì)的選擇���、工藝優(yōu)化及對制劑質(zhì)量影響等方面淺談該類制劑的藥學(xué)開發(fā)重點及難點,旨在為研發(fā)提供借鑒和參考�。
【關(guān)鍵詞】皮膚局部外用制劑�; 藥學(xué)研究�;生產(chǎn)工藝;質(zhì)量控制
皮膚外用藥是一類作用于皮膚發(fā)揮局部或全身治療作用的制劑�,劑型包括軟膏劑��、乳膏劑�����、凝膠劑�、散劑�����、水劑及洗劑等���。其中軟膏劑、乳膏劑處方組成復(fù)雜��,多為半固體制劑����,具有多相�����、熱力學(xué)不穩(wěn)定等特點[1]����。皮膚給藥具有諸多優(yōu)勢�,可避免藥物在口服給藥后受胃中酸性環(huán)境和胃腸道黏液的影響[2]�����;減少血藥濃度峰谷變化�����,從而降低藥物的不良反應(yīng)���;直接作用于靶位發(fā)揮藥理作用;;減少給藥次數(shù)��,且患者可自主用藥����,用藥依從性較高[3]����。隨著局部給藥優(yōu)勢的不斷擴大�,近年來軟膏劑及乳膏劑逐漸成為企業(yè)研發(fā)和申報的熱點�,目前國內(nèi)外已批準(zhǔn)多個軟膏劑����、乳膏劑產(chǎn)品上市�。本文結(jié)合國內(nèi)外軟膏劑及乳膏劑產(chǎn)品的申報情況�����,著重從化藥類軟膏劑及乳膏劑的處方工藝、質(zhì)量控制等方面對該類皮膚局部外用制劑的藥學(xué)研究進行探討�����,望研發(fā)主體針對該類劑型進行差異化參考����,借鑒契合部分���。
01���、軟膏劑����、乳膏劑的定義及分類
《中國藥典》2020 年版通則<0109>軟膏劑 乳膏劑項下,將軟膏劑定義為原料藥物與油脂性或水溶性基質(zhì)混合制成的均勻半固體外用制劑; 將乳膏劑定義為原料藥物溶解或分散于乳狀液型基質(zhì)中形成的均勻半固體制劑[4]����?����!睹绹幍洹? USP NF2024)通則<1151>項下�,將軟膏劑定義為外用于皮膚或黏膜的半固體制劑��,活性成分局部起效或全身吸收���,軟膏基質(zhì)通常含水分及揮發(fā)性物質(zhì)低于 20%,以烷烴����、蠟質(zhì)或多元醇等基質(zhì)為主( 占比 50%以上) ��。軟膏基質(zhì)通常分為 4 大類: 烷烴基質(zhì)��、吸水性基質(zhì)���、水洗性基質(zhì)以及水溶性基質(zhì); 將乳膏劑定義為外用于皮膚或粘膜的半固體制劑��,乳膏基質(zhì)通常含水分及揮發(fā)性物質(zhì)超過 20%����,烷烴�、蠟質(zhì)或多元醇等基質(zhì)占比低于 50%��,按劑型分為 W /O 型( 油包水型) 或O /W 型( 水包油型) �?!稓W洲藥典》( EP11.8) 通則<0132>項下,將軟膏劑定義為軟膏是用于皮膚的半固體制劑����,由單相基質(zhì)組成,該基質(zhì)可以分散液體或固體; 將乳膏劑定義為乳膏是外觀均勻的半固體制劑�����,由親酯相和水相組成�,其中一相可以在另外一相中很好的分散��。
02���、軟膏劑����、乳膏劑的國內(nèi)外監(jiān)管及上市情況介紹
2.1 國內(nèi)外監(jiān)管情況
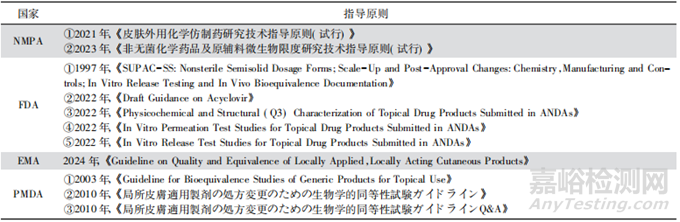
國內(nèi)外監(jiān)管機構(gòu)發(fā)布了一些與軟膏劑���、乳膏劑相關(guān)的指南,表1匯總了現(xiàn)階段各主流國家的藥學(xué)研究相關(guān)的指導(dǎo)原則����。
▲表1-國內(nèi)外監(jiān)管機構(gòu)軟膏劑����、乳膏劑相關(guān)指導(dǎo)原則
2.2 上市情況介紹
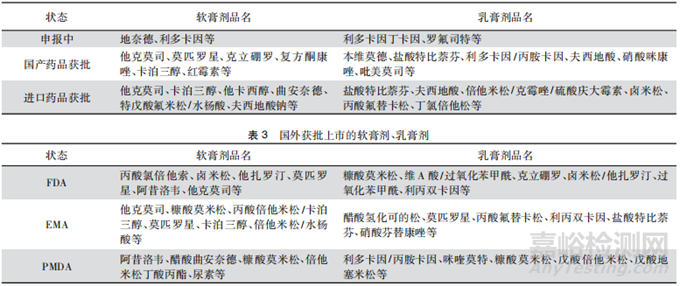
目前已獲批上市的軟膏劑�、乳膏劑適應(yīng)證主要集中在皮膚疾病治療���、抗感染���、抗炎�、鎮(zhèn)痛麻醉等領(lǐng)域�,表2列出了部分國內(nèi)申報及獲批的軟膏劑��、乳膏劑品種����,表 3 列出了部分國外上市獲批的軟膏劑����、乳膏劑品種����。
▲表2-國內(nèi)申報及批準(zhǔn)的軟膏劑�����、乳膏劑
03、軟膏劑、乳膏劑藥學(xué)研究
3.1 軟膏劑����、乳膏劑的構(gòu)成
《中國藥典》2020 年版載明����,軟膏劑因原料藥物在基質(zhì)中分散狀態(tài)的不同�,分為溶液型和混懸型軟膏劑[4]��。乳膏劑由于基質(zhì)不同����,可分為 W /O 型或 O /W 型乳膏劑����。軟膏劑���、乳膏劑主要由活性成分�����、基質(zhì)( 如抗氧劑、增稠劑�、保濕劑及皮膚吸收促進劑等) 組成����。
此外,因 O /W 型乳膏基質(zhì)中藥物的釋放和透皮吸收較快�、易涂抹皮膚等優(yōu)點�,除在臨床皮膚科中廣泛應(yīng)用外��,近年來在化妝品及醫(yī)美領(lǐng)域的臨床價值也日益凸顯����。
3.2 開發(fā)目標(biāo)
人用藥品技術(shù)要求國際協(xié)調(diào)會( The International Council of Harmonisation of Technical Requirements for Pharmaceuticals for Human Use�,ICH) Q8 藥品研發(fā)指出�,藥品研發(fā)的目的在于設(shè)計一個高質(zhì)量的產(chǎn)品�����,以及能持續(xù)生產(chǎn)出符合其預(yù)期質(zhì)量水平的產(chǎn)品���。并引入了質(zhì)量源于設(shè)計( QbD) 的理念,強調(diào)了這一理念的重要性以及基本原則��。將QbD 原則應(yīng)用于軟膏劑���、乳膏劑這類復(fù)雜制劑中�����,更容易高效地實現(xiàn)產(chǎn)品開發(fā)�、優(yōu)化處方以及連續(xù)且穩(wěn)定的生產(chǎn)��,顯著降低生產(chǎn)成本、減少產(chǎn)品的不可控性以及缺陷等[12]�。
理想的軟膏劑����、乳膏劑產(chǎn)品的性質(zhì)應(yīng)包括分散體系均一穩(wěn)定、不脫水無引濕性���,粘附性良好,無刺激性����、致敏指數(shù)低����,不改變皮膚的功能等��。實際研發(fā)過程中需要全面調(diào)研原料藥及基質(zhì)的相關(guān)信息�����,盡可能全面地掌握原料藥及基質(zhì)的理化性質(zhì)及生物化學(xué)特性�,充分了解可能對產(chǎn)品的皮膚滲透過程的影響因素及控制措施[13]���。
根據(jù)調(diào)研的相關(guān)文獻和專利信息��,結(jié)合 ICH Q8進行開發(fā)研究,確定處方組成��,同時結(jié)合原料藥以及基質(zhì)的相關(guān)性質(zhì)選擇合適的制備工藝����,避免藥物發(fā)生降解���、釋放速率下降等,不能達到預(yù)期的治療效果�����。同時還應(yīng)保證產(chǎn)品質(zhì)量符合藥典及相關(guān)法規(guī)的要求�。
3.3 處方研究
原料藥及基質(zhì)對軟膏劑���、乳膏劑的質(zhì)量屬性有較大影響,不同基質(zhì)的結(jié)構(gòu)���、組成和性質(zhì)有諸多差別����?;|(zhì)作為賦形劑或藥物載體����,能夠影響藥物的穩(wěn)定性、釋放速率��、經(jīng)皮吸收等性能[13]����。故而需要全面掌握原料藥及基質(zhì)的相關(guān)信息,特別是可能影響產(chǎn)品質(zhì)量屬性的功能性指標(biāo)����,對輔料種類( Q1) 及用量( Q2) 進行充分的篩選研究,并結(jié)合其功能進行合理性論證����。另外�,開發(fā)產(chǎn)品時應(yīng)充分考慮可能引起的皮膚刺激性或敏感性��,對于可能引起上述反應(yīng)的輔料,盡量避免使用�,如無法避免�,則應(yīng)盡量減少使用,一般使用常用量的成熟輔料[14]�����。
3.3.1 原料藥
原料藥作為軟膏劑及乳膏劑的活性成分���,對制劑的質(zhì)量特性影響較大����。需要全面地掌握原料藥的理化及生物化學(xué)性質(zhì),如分子量�����、熔點( 沸點�����,如適用) ���、分配系數(shù)( logP) 、pKa���、溶解度、晶型( 如果活性成分在產(chǎn)品中以晶態(tài)形式存在) ����、pH、粒徑�����、對 光/熱/空 氣/濕 度 的 敏 感 性、降 解 途 徑等[14-16]��,以期制得質(zhì)量可控��、療效良好的產(chǎn)品����。以下著重從溶解性與分散性���、晶型與粒徑��、原料藥的穩(wěn)定性 3 個方面舉例說明:
①溶解性與分散性: 對于軟膏劑、乳膏劑��,原料藥在不同油相�����、有機相及乳化劑等中的溶解度對于提高藥物溶解度或載藥量以及減少非水組分的用量具有重要意義����。如��,親脂性原料藥更適用于油性基質(zhì); 而親水性或兩親性原料藥則更適用于乳膏劑,有利于實現(xiàn)產(chǎn)品的均勻分散��。
②晶型與粒徑: 原料藥的晶型及其穩(wěn)定性��、微粉化程度等均可能影響產(chǎn)品的物理均一性�、藥物釋放速率及皮膚滲透性。如�,非晶態(tài)或無定形態(tài)原料藥通常溶解速度更快���,但可能因其熱力學(xué)不穩(wěn)定從而影響制劑的穩(wěn)定性; 而高濃度微粉化的原料藥可能會增加產(chǎn)品的黏度,從而影響涂抹的延展性及流變學(xué)特性等�����。另外���,原料藥的載藥量還需要平衡療效與安全性,如過量的原料藥可能引起局部刺激性或毒性���,而濃度不足則會導(dǎo)致療效下降。
③原料藥的穩(wěn)定性:部分原料藥可能對光���、熱、空氣��、濕度或 pH 等條件敏感�����,需要通過基質(zhì)或包裝進行保護�。如����,易氧化的原料藥需要添加抗氧劑( 如維生素 E) ����,對光敏感的原料藥( 如維 A 酸) 需要采用避光條件進行實驗,并添加對光穩(wěn)定或耐光的基質(zhì)或不透光的包裝容器�。
3.3.2 輔料
軟膏劑及乳膏劑中常用輔料具有多種功能及作用���,如油相基質(zhì)、水相基質(zhì)���、乳化劑�、促滲劑等�。輔料的加入可以提高產(chǎn)品的溶解度、控制產(chǎn)品釋放和產(chǎn)品黏度�、改變皮膚屏障性能和產(chǎn)品滲透/擴散作用��、增加產(chǎn)品的穩(wěn)定性以及防止微生物生長等�。
EMA[14]指出�,需要詳細列出輔料在產(chǎn)品中的用量及發(fā)揮的作用( 如發(fā)揮多個作用�,需要全部列出) ,通常需要關(guān)注輔料的批次及來源信息�,如烷烴的同系物組成����、不飽和度、分子量和/或黏度���、多晶型等,上述信息可能會引起產(chǎn)品流變學(xué)性質(zhì)����、微觀結(jié)構(gòu)/物理性質(zhì)��、活性成分或其他成分的晶型���、穩(wěn)定性或生物利用度的變化,在處方開發(fā)過程中需要考慮輔料的不同批次及來源對產(chǎn)品質(zhì)量的影響�。需要高度關(guān)注各輔料的篩選��、用量信息以及相關(guān)的關(guān)鍵質(zhì)量屬性[CQA�,如 HLB 值( hydrophile lipophile balance) ���、聚合度�、羥值���、皂化值、pH 等]�,并結(jié)合其功能性指標(biāo)進行充分的論證��,輔料的 CQA 應(yīng)在其質(zhì)量標(biāo)準(zhǔn)中進行控制�,并論證其限度的合理性。EMA[14]強調(diào)�����,某些輔料可能對活性物質(zhì)滲透和生物利用度有影響����,應(yīng)予以關(guān)注�����,需要提供這類輔料的詳細信息�,如級別信息以及品牌名( 商品名) ( 如可獲得) ,以便可持續(xù)的生產(chǎn)并保證產(chǎn)品質(zhì)量����,必要時固定輔料的級別信息( 如活性成分的生物利用度、產(chǎn)品的可生產(chǎn)性和/或質(zhì)量發(fā)生變化時) ; 對于復(fù)合輔料需要明確各輔料的定性和定量信息��,并對其進行表征�,包括流變學(xué)性質(zhì)( 如適用) ; 對于新型輔料�����,需要提供其完整且詳細的信息��。
另外�����,基質(zhì)的熱力學(xué)不穩(wěn)定性是皮膚局部外用制劑研發(fā)的核心挑戰(zhàn)���,對于部分乳膏劑及軟膏劑可能會使用乳化劑�,某些揮發(fā)性成分( 如乙醇�����、薄荷腦等) 或酸性過強的乳化劑����、離子強度失衡�����、體系pH過低或過高�、微生物污染等均會使乳化劑分解�����,導(dǎo)致發(fā)生破乳現(xiàn)象�����,研發(fā)過程中需要重點關(guān)注基質(zhì)的種類和性質(zhì)�,尤其是可能影響乳化性能的質(zhì)量特性���。需要根據(jù) ICH Q8 ~ Q11 指南建立關(guān)鍵物料屬性與關(guān)鍵質(zhì)量屬性( CQA) 的關(guān)聯(lián)模型�����,進行充分的研究。
3.4 工藝研究
軟膏劑及乳膏劑的制備方法主要包括冷和法��、熔和法����、乳化法等���,其中受活性成分溶解性的影響�,制備工藝復(fù)雜�、質(zhì)量控制困難等原因冷和法應(yīng)用較少��,對于受熱不穩(wěn)定的基質(zhì)/輔料可采用冷和法�,熔和法主要用于油膏劑的制備��,多數(shù)乳膏劑采用乳化法制備[13]��。
生產(chǎn)中原料藥的預(yù)處理工藝( 如微粉化、溶解于輔料中) ��,原輔料的加入順序以及溶解溫度���,乳化及均質(zhì)工藝的溫度、攪拌速度/剪切力�����、時間�����、頻率等[1]�,冷卻工藝中降溫速度���、時間���、真空度等,灌裝工藝中的傾點溫度��、充填溫度和凝固點���,灌裝機的螺旋輸送器的攪動速度、頻率等均會影響軟膏���、乳膏的性質(zhì)[13],需要高度關(guān)注��。同時���,還需要關(guān)注過程控制及中間產(chǎn)品的控制,如中間產(chǎn)品的黏度����、離心穩(wěn)定性( 如是否發(fā)生油水分離) 等。此外���,還需要關(guān)注研究過程中放大效應(yīng)對產(chǎn)品的影響,充分考慮生產(chǎn)設(shè)備與批量的匹配性���。EMA 指明[14]如果關(guān)鍵臨床試驗批次與申報批和/或商業(yè)批之間的處方�����、生產(chǎn)工藝等存在差異�����,需要提供依據(jù)及相關(guān)的研究資料�����,必要時應(yīng)提供產(chǎn)品的等效性對比研究、體外研究或體內(nèi)研究結(jié)果。
3.5 質(zhì)量研究
軟膏劑及乳膏劑的關(guān)鍵質(zhì)量屬性主要包括外觀及質(zhì)地���、水分、比重�����、pH 值�、黏度、流變特性�、混懸藥物的晶型��、粒度分布�����、液滴粒徑�����、含量均勻度��、微生物限度��、有關(guān)物質(zhì)���、抑菌劑含量及抗氧劑含量�、無 菌 以 及 體 外 釋 放 實 驗 和 體 外 透 皮 實驗等[14-17]�。
以下著重從流變學(xué)特性、體外透皮�����、體外釋放與液滴粒徑及分布 4 個方面進行說明���。
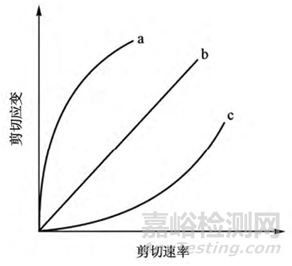
①流變學(xué)主要是表征物質(zhì)的流動與變形[18]�。流變曲線是指流體的剪切應(yīng)力與剪切速率之間的關(guān)系曲線�,可以通過公式 η = τ /γ 來描述�����,其中: τ 為剪切應(yīng)力�,γ 為剪切速率���,η 為黏度,黏度可通過流變曲線的斜率獲得; 根據(jù)流變曲線���,可以得到流體的黏度隨剪切速率的變化[19]���。當(dāng)流體受到剪切作用時,可以根據(jù)剪切應(yīng)力隨剪切速率的變化趨勢來判斷流體的類型( 如圖 1) [19]���。流體一般分為牛頓流體和非牛頓流體���,非牛頓流體包括塑性流體���、假塑性流體�����、脹塑性流體�,假塑性流體具有剪切稀化現(xiàn)象,脹塑性流體具有切變增稠現(xiàn)象[13]�����。
▲圖1-假塑性流體( a) ���、牛頓流體( b) 和脹塑性流體( c) 的流變曲線
流變學(xué)特性是半固體制劑研發(fā)、生產(chǎn)和質(zhì)量控制的核心指標(biāo)����,流變學(xué)特性可以維持產(chǎn)品物理結(jié)構(gòu)的穩(wěn)定性,如 W /O 型的乳膏需要具備合適的流變特性( 如黏彈性���、觸變性等) 可防止油水兩相分離,混懸型的軟膏需要具備高黏度或高屈服應(yīng)力防止發(fā)生沉降; 流變學(xué)特性能夠控制藥物遞送性能���,如使用高黏度的基質(zhì)可以延緩產(chǎn)品的釋放,假塑性流體在剪切力下黏度降低����,促進透皮滲透; 此外��,流變學(xué)還可以優(yōu)化生產(chǎn)工藝���,如最近新興的半固體 3D 打印技術(shù)對屈服應(yīng)力等提出了明確的要求����。
②體外釋放����,反映藥物釋放的速度和完全程度�,主要用于外用產(chǎn)品的藥學(xué)質(zhì)量控制���,也可用于藥品開發(fā)過程中處方工藝的篩選研究[1]。體外釋放是處方優(yōu)化�����、質(zhì)量控制的重要手段����,為體外透皮實驗提供數(shù)據(jù)支撐�����,明確產(chǎn)品釋放模型,輔助透皮實驗進行處方優(yōu)化���,幫助分析透皮實驗結(jié)果�,從而更準(zhǔn)確的評估藥物的透皮行為�。
③體外透皮實驗的設(shè)計目的是模擬外用藥物在生理條件下的透皮過程��,以反映外用制劑的質(zhì)量[1]�。體外透皮在處方開發(fā)��、質(zhì)量評價及作用機制研究方面均具有重要意見,如通過體外透皮研究�����,比較不同基質(zhì)( 如水溶性基質(zhì)��、乳劑型基質(zhì)) 制成的產(chǎn)品透皮速率和透皮量��,篩選出最適合產(chǎn)品透皮的基質(zhì)。
④液滴粒徑及分布,反映體系的穩(wěn)定性�,同時也影響體系的流變學(xué)性質(zhì)�,如黏度�����、流動性等; 對于混懸體系�����,需要根據(jù)活性成分的粒徑分布和晶型進行額外的表征( 如激光衍射、拉曼成像以及顯微鏡檢查等) ��,據(jù)此可以區(qū)分單相體系���、多相體系和混懸體系[1,17]�。
穩(wěn)定性研究期間���,需要重點關(guān)注上述考察指標(biāo),此外,還需要評估溫度變化以及產(chǎn)品穩(wěn)定性放置期間是否存在析晶�、沉淀�、轉(zhuǎn)晶或脫水收縮等現(xiàn)象,若引起可能影響生物利用度的活性成分特性發(fā)生變化�,需要在穩(wěn)定性研究中進行適當(dāng)?shù)目疾臁?/span>
04�、總結(jié)
軟膏類及乳膏類皮膚局部外用制劑��,具有給藥方便�����、致敏指數(shù)低����、在作用部位持久發(fā)揮作用�����,從而延長藥物釋放時間等優(yōu)點����,使其成為研發(fā)的熱點。但由于藥物在基質(zhì)中的溶解度有限��,藥物釋放速率會受到影響�,進而影響藥物的透皮吸收����。未來�����,隨著我國科研水平的逐步提高,新材料的不斷涌現(xiàn)���,制劑技術(shù)的改進����,以及對皮膚藥理學(xué)和藥劑學(xué)的深入研究���,藥物遞送系統(tǒng)的優(yōu)化以及針對性藥物的研發(fā)���,軟膏劑和乳膏劑將更好地滿足不同患者的需求�,提高治療效果和患者依從性�,從而在臨床治療和其他領(lǐng)域發(fā)揮更大的作用���。
參考文獻[1]
國家藥品監(jiān)督管理局藥品審評中心.關(guān)于發(fā)布《皮膚外用化學(xué)仿制藥研究技術(shù)指導(dǎo)原則( 試行) 》的通告( 2021 年第 23 號) [EB/OL].( 2021-03-03) [2025-03-22]. https: / /www.cde.org.cn/main/ news /viewInfoCommon/4e790f4ad1cb21091e5a8bf4a107c535.
[2] MASMOUDI H,PICCERELLE P�����,LE DRÉAU Y��,et al.Arheological method to evaluate the physical stability ofhighly viscous pharmaceutical oil - in - water emulsions[J].Pharm Res,2006�,23( 8) : 1937-1947.
[3] JORGE L L,F(xiàn)ERES C C�����,TELES V E P.Topical preparations for pain�����,relief: efficacy and patient adherence[J]. JPain Res����,2010( 4) : 11-24.
[4] 國家藥典委員會.中華人民共和國藥典 2020 年版( 四部) [S].北京: 中國醫(yī)藥科技出版社,2020: 11.
[5] 國家藥品監(jiān)督管理局藥品審評中心.關(guān)于發(fā)布《非無菌化學(xué)藥品及原輔料微生物限度研究技術(shù)指導(dǎo)原則( 試行) 》的通告( 2023 年第 11 號) [EB/OL].( 2023-02-17) [2025-03-22].https: / /www.cde.org.cn/main/ news/viewInfoCommon/ b522b0ea49412b5edc52f002a1d1036a.
[6] FDA. Guidance for Industry Nonsterile Semisolid Dosage Forms Scale -Up and Postapproval Changes: Chemistry��,Manufacturing���,and Controls; In Vitro Release Testing andIn Vivo Bioequivalence Documentation[EB/OL].( 1997-05-01) [2025 - 03 - 22]. https: / /www. fda. gov /media /71141/ download.
[7] FDA.Draft Guidance In Vitro Permeation Test Studies for Topical Drug Products Submitted in ANDAs[EB/OL].( 2022-10- 21) [2025- 03 - 22]. https: / /www. fda. gov /media /162475/ download.
[8] FDA. Draft Guidance In Vitro Release Test Studies forTopical Drug Products Submitted in ANDAs[EB/OL].( 2022-10- 21) [2025- 03 - 22]. https: / /www. fda. gov /media /162476/ download.
[9] PMDA. Guideline for Bioequivalence Studies of GenericProducts for Topical Use[EB/OL].( 2003-07-07) [2025- 03 - 22]. https: / /www. nihs. go. jp/ drug / be - guide%28e%29/Topical_BE-E.pdf.
[10] PMDA.局所皮膚適用製剤の処方変更のための生物學(xué)的同等性試験ガイドライン[EB/OL].( 2010-11-01) [2025 - 03 - 22]. https: / /www. nihs. go. jp/ drug / be -guide /GL101101_hifu_shohou.pdf.
[11] PMDA.局所皮膚適用製剤の処方変更のための生物學(xué)的同等性試験ガイドラインQ&A[EB/OL].( 2010-11- 01) [2025- 03- 22]. https: / /www. nihs. go.jp/ drug /be-guide /QA101101_hifu_shohou.pdf.
[12] SIMOES A�����,VEIGA F,VITORINO C���,et al. A tutorial for developing a topical cream formulation based on the quality by design approach[J].J Pharm Sci�,2018( 107) :2653-2662.
[13] 平其能��,屠錫德�����,張鈞壽�,等.藥劑學(xué)( 4 版) [M].北京:人民衛(wèi)生出版社�����,2013: 563-585.
[14] EMA.Guideline on quality and equivalence of locally applied�����,locally acting cutaneous products[EB/OL].( 2024-10- 01) [2025 - 03 - 22]. https: / /www. ema. europa. eu/en/ quality-equivalence-locally-applied-locally-acting-cutaneous-products-scientific-guideline.
[15] FDA.Draft Guidance on Acyclovir[EB/OL].( 2024-10-21) [2025 - 03 - 22]. https: / /www. accessdata. fda. gov /drugsatfda_docs / psg /PSG_021478.pdf.
[16] FDA.Draft Guidance on Acyclovir[EB/OL].( 2024-10-21) [2025 - 03 - 22]. https: / /www. accessdata. fda. gov /drugsatfda_docs / psg /PSG_018604.pdf.
[17] FDA.Physicochemical and Structural ( Q3) Characterizationof Topical Drug Products Submitted in ANDAs[EB/OL].( 2022-10-21) [2025-03-22].https: / /www.fda.gov/media/162471/ download.
[18] 吳其曄���,巫靜安.高分子材料流變學(xué)( 第 2 版) [M].北京: 高等教育出版社,2014: 1-12.
[19] 劉智豪����,衡偉利,錢帥���,等.皮膚外用制劑的流變學(xué)研究進展[J].中國藥科大學(xué)學(xué)報�����,2022�����,53( 1) : 105-112.