一.數(shù)字療法發(fā)展過(guò)程
數(shù)字療法(Digital Therapeutics, DTx)是指利用軟件程序����、數(shù)字化科技以單獨(dú)或結(jié)合藥物/器械/療法的方式進(jìn)行預(yù)防��、管理或治療疾病��,并有證據(jù)基礎(chǔ)(Evidence-based)達(dá)到優(yōu)化病患照護(hù)和治療的效果��。
自 2015 年起�����,數(shù)字化科技應(yīng)用于醫(yī)療領(lǐng)域快速發(fā)展�,從早期遠(yuǎn)距醫(yī)療等數(shù)字化診斷工具到現(xiàn)今數(shù)字療法工具的開發(fā)與使用����,多項(xiàng)數(shù)字化療法已陸續(xù)被核準(zhǔn)使用于治療慢性疾病、物質(zhì)濫用��、精神疾病���、失眠癥及癌癥等相關(guān)適應(yīng)癥[2]��,如 reSET (治療物質(zhì)濫用,
DEN160018)��、EndeavorRx(治療兒童 ADHD, DEN200026)����、Somryst(治療失眠癥, K191716)等。近年來(lái)����,數(shù)字療法的適應(yīng)癥持續(xù)增加,美國(guó) FDA 于 2024 年核準(zhǔn)了首個(gè)用于重度抑郁癥的數(shù)字療法產(chǎn)品 (Dejoyn, K231209)��,并于 2025 年批準(zhǔn)了首個(gè)用于治療偏頭痛的數(shù)字療法產(chǎn)品(CT-132, DEN240064)����。精神疾病、物質(zhì)使用障礙�����、失眠癥和腰痛等慢性或難治性疾病的增加���,以及醫(yī)護(hù)人員的嚴(yán)重短缺都與數(shù)字療法的蓬勃發(fā)展與廣泛應(yīng)用有一定程度的關(guān)聯(lián)。
Wang 等人在 2023 年發(fā)表了一篇關(guān)于數(shù)字療法的統(tǒng)合分析研究�����,該研究綜整學(xué)術(shù)期刊、臨床試驗(yàn)資料庫(kù)及多國(guó)法規(guī)管理文獻(xiàn)�����。研究指出在 2010-2022 年間�����,使用關(guān)鍵字「digital therapeutics」搜尋美國(guó)衛(wèi)生研究院(NIH)的全球臨床試驗(yàn)數(shù)據(jù)庫(kù)-ClinicalTrials.gov 網(wǎng)站�����,并檢索與數(shù)字療法相關(guān)的臨床試驗(yàn)�。該研究分析了 2011 年至2022 年間數(shù)字療法產(chǎn)品之臨床試驗(yàn)注冊(cè)或發(fā)表時(shí)間、適應(yīng)癥��、申請(qǐng)者類型��、試驗(yàn)執(zhí)行地點(diǎn)�����、臨床試驗(yàn)類型����、研究設(shè)計(jì)方法和主要結(jié)果之間的關(guān)系�。分析資料顯示���,在過(guò)去 10年間�,業(yè)界與開發(fā)者廣泛嘗試各種的應(yīng)用領(lǐng)域�����,并積極投入臨床試驗(yàn)驗(yàn)證數(shù)字療法在不同適應(yīng)癥中的治療��、診斷和預(yù)防效果��。其中����,大多數(shù)的臨床試驗(yàn)案采用隨機(jī)對(duì)照試驗(yàn)及平行研究的方法���,并以治療標(biāo)的作為主要結(jié)果�����,顯見數(shù)字療法正逐漸被廣泛的接受與使用�。此外,該研究亦分析 2015-2022 年間數(shù)字療法產(chǎn)品的適應(yīng)癥類型�����、產(chǎn)品上市途徑及法規(guī)管理模式�����。藉由分析產(chǎn)品的適應(yīng)癥類型��、產(chǎn)品上市途徑及法規(guī)管理模式��,可發(fā)現(xiàn)數(shù)字療法早期的發(fā)展方向著重于慢性病和神經(jīng)科學(xué)相關(guān)的適應(yīng)癥����。而自 2020 年起,才開始大量出現(xiàn)應(yīng)用于精神醫(yī)學(xué)的數(shù)字療法產(chǎn)品��?�?傮w而言�����,數(shù)字療法產(chǎn)品呈現(xiàn)逐年增加的趨勢(shì)�,數(shù)字療法憑借科學(xué)實(shí)證的基礎(chǔ)及個(gè)人化醫(yī)療的特色,正逐漸成為臨床醫(yī)學(xué)上不可或缺的重要工具�����。從產(chǎn)品上市途徑的角度觀察可發(fā)現(xiàn)����,許多數(shù)字療法產(chǎn)品都已獲得了上市許可(如 FDA clearance 或 CE mark)。大多數(shù)獲得美國(guó) FDA clearance 的數(shù)字療法產(chǎn)品被判定為二類醫(yī)療器械����;但很高比例獲得 CE mark 的數(shù)字療法產(chǎn)品卻是被歸類在一類醫(yī)療器械。其主因系過(guò)去歐盟依醫(yī)療器械指令(MDD)監(jiān)管時(shí)�����,多將數(shù)字療法產(chǎn)品視為低風(fēng)險(xiǎn)醫(yī)療器械(Class I)���,開發(fā)者得以透過(guò)自我聲明的方式取得 CE mark����,但現(xiàn)行歐盟實(shí)施的醫(yī)療器械法規(guī)(MDR)則已將用于診斷或治療用途的軟件歸類為 Class IIa 以上的醫(yī)療器械。
二.數(shù)字療法的特點(diǎn)
數(shù)字療法做為一個(gè)以軟件為主要治療介面�、經(jīng)臨床驗(yàn)證并可取代或輔助傳統(tǒng)臨床治療的數(shù)字化工具,具有下列特點(diǎn):
• 明確的適應(yīng)癥:DTx 必須符合特定醫(yī)療適應(yīng)癥(如焦慮�、失眠、注意力不足ADHD����、物質(zhì)濫用等),且其預(yù)期用途����、工作原理及理論依據(jù)大多可與現(xiàn)行臨床實(shí)證或治療指引之原則相符。
• 通過(guò)臨床實(shí)證驗(yàn)證:目前�,多數(shù)應(yīng)用于精神醫(yī)學(xué)治療的非藥物干預(yù)治療方法(如認(rèn)知訓(xùn)練、懷舊療法�����、音樂(lè)治療����、芳香療法等),尚無(wú)充分臨床驗(yàn)證以支持其治療效果�����。與此不同,DTx 須經(jīng)由嚴(yán)謹(jǐn)?shù)呐R床試驗(yàn)驗(yàn)證����,提供完整的安全性及功能性的驗(yàn)證資料�����,如臨床試驗(yàn)���、隨機(jī)對(duì)照試驗(yàn)(RCT)或其他嚴(yán)謹(jǐn)研究成果�����,并遵循主管機(jī)關(guān)指南要求����,以佐證其臨床收益與安全性得到科學(xué)證實(shí)����。
• 可獨(dú)立或輔助治療使用:透過(guò)觀察現(xiàn)階段臨床實(shí)務(wù)常見的問(wèn)題��,患有精神疾病、糖尿病等慢性疾病的病患常因現(xiàn)有藥物治療之服藥期長(zhǎng)且療效有限�,造成患者服藥遵從性難以掌控。因此數(shù)字療法亦被期待能成為幫助病患遵守用藥指示的工具�。數(shù)字療法可單獨(dú)用于疾病治療�;或與藥物、心理治療搭配使用���,借由提升病患對(duì)治療與服藥的遵從性��,進(jìn)而提升整體治療計(jì)畫之效果���。
整體而言,數(shù)字療法作為融合數(shù)字化科技與醫(yī)學(xué)知識(shí)的創(chuàng)新治療模式����,逐漸從概念驗(yàn)證走向臨床應(yīng)用。但在技術(shù)創(chuàng)新與產(chǎn)品開發(fā)的過(guò)程中�,仍須面臨管理法規(guī)����、臨床驗(yàn)證、經(jīng)濟(jì)模型與倫理法規(guī)的考驗(yàn)��。
FDA對(duì)于數(shù)字療法的監(jiān)管
一、DTx 的監(jiān)管制度
美國(guó) FDA 曾在 2013 年發(fā)布(2019 年更新)指南《Policy for Device Software Functions and Mobile Medical Applications》�����,說(shuō)明行動(dòng)器械上的醫(yī)療應(yīng)用程序須遵循的管理模式�。該指南于 2019 年更新后,反映了 FDA 對(duì)數(shù)字療法產(chǎn)品的管理模式���,與 2016 年美國(guó)發(fā)布的法案《21st Century Cures Act》中對(duì)于醫(yī)用軟件的相關(guān)規(guī)定(Medical Devices; Medical Device Classification Regulations To Conform to Medical Software Provisions)相符����。
目前�,美國(guó) FDA 將數(shù)字療法產(chǎn)品做為醫(yī)療器械軟件 (Software as a Medical Device, SaMD)來(lái)管理。根據(jù)國(guó)際醫(yī)療器械主管機(jī)關(guān)論壇IMDRF的定義��,SaMD 指軟件本身即是醫(yī)療器械預(yù)期用于 1 個(gè)或多個(gè)醫(yī)療用途的醫(yī)療器械軟件���,且其不屬于醫(yī)療器械硬件的一部分。這些醫(yī)療用途包括疾病的診斷�����、治療、緩解或預(yù)防等�����。SaMD 產(chǎn)品依據(jù)醫(yī)療器械的管理原則����,對(duì)患者的潛在風(fēng)險(xiǎn)進(jìn)行評(píng)估,并依其風(fēng)險(xiǎn)等級(jí)分為三類:Class I(低風(fēng)險(xiǎn))�����;Class II(中度風(fēng)險(xiǎn))�����;Class III(高風(fēng)險(xiǎn))����。數(shù)字療法產(chǎn)品通常被歸類于 Class II。此類醫(yī)療器械通常須遵循一般監(jiān)管控制(General Regulatory Controls)����,并且通常亦須符合特別監(jiān)管控制(Special Regulatory Controls)���,以確認(rèn)其安全性和有效性,或證明其與同類型醫(yī)療器械為實(shí)質(zhì)等同��。
二����、FDA 已批準(zhǔn)的代表性數(shù)字療法產(chǎn)品案例
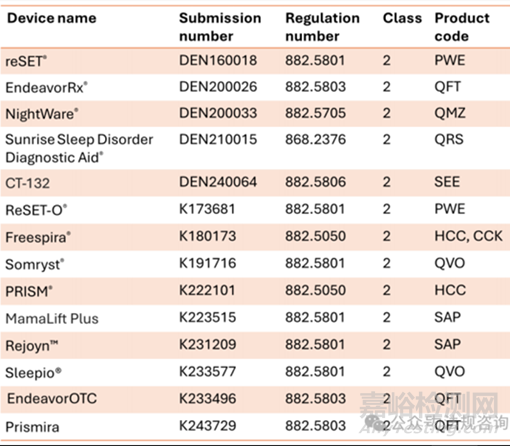
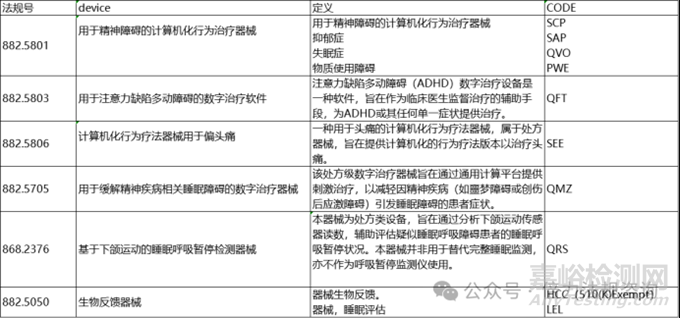
目前美國(guó) FDA 核準(zhǔn)的數(shù)字療法產(chǎn)品皆屬于處方用數(shù)字療法產(chǎn)品(Prescription Digital Therapeutics, PDTs),參考 2025 年公開文獻(xiàn)并盤點(diǎn)美國(guó)醫(yī)療器械許可證資料庫(kù)最新資訊��,主要用于物質(zhì)成癮�����、睡眠障礙���、注意力不足及ADHD等多項(xiàng)代表性的數(shù)字療法產(chǎn)品資訊(許可證字號(hào)、法規(guī)代碼���、風(fēng)險(xiǎn)等級(jí)及產(chǎn)品代碼)��,整理如表一����。另外,將與處方數(shù)字療法產(chǎn)品相關(guān)的產(chǎn)品分類資訊呈現(xiàn)于表二�����。
表一��、近年代表性處方用數(shù)字療法產(chǎn)品
表二���、處方用數(shù)字療法產(chǎn)品相關(guān)的產(chǎn)品分類資訊
在處方用數(shù)字療法產(chǎn)品產(chǎn)品開發(fā)與商業(yè)化的過(guò)程中��,制造商與開發(fā)者必須共同面對(duì)多層面的挑戰(zhàn)與決策���,特別是針對(duì)產(chǎn)品安全性、有效性����、可用性與市場(chǎng)進(jìn)入策略等關(guān)鍵問(wèn)題。下一章將以表一中的代表性處方用數(shù)字療法產(chǎn)品為例��,說(shuō)明產(chǎn)品生命周期中會(huì)遭遇的問(wèn)題�����。
數(shù)字療法產(chǎn)品研發(fā)的關(guān)鍵考量
一�、醫(yī)療器械軟件的全生命周期管理
數(shù)字療法產(chǎn)品作為醫(yī)療器械軟件�,研發(fā)階段應(yīng)考量醫(yī)療器械質(zhì)量管理����、軟件確效及網(wǎng)絡(luò)安全中對(duì)產(chǎn)品全生命周期管理(Total Product Life Cycle, TPLC)的要求,包含產(chǎn)品設(shè)計(jì)開發(fā)��、上市前審查�����、量產(chǎn)及上市后監(jiān)督����,以確保市售醫(yī)療器械之安全、效能及質(zhì)量�。在美國(guó)FDA于2025年發(fā)布的網(wǎng)絡(luò)安全指南,亦說(shuō)明安全產(chǎn)品開發(fā)框架(Secure Product Development Framework, SPDF)應(yīng)涵蓋產(chǎn)品生命周期的所有階段����,包括設(shè)計(jì)��、開發(fā)����、發(fā)布��、支援及停用��,且應(yīng)符合下列安全目標(biāo):真實(shí)性(包含完整性)���、授權(quán)原則、可用性��、保密性�����、以及安全且及時(shí)的更新與更新能力��。
隨著醫(yī)療器械軟件使用族群的擴(kuò)大以及產(chǎn)品快速的創(chuàng)新��,開發(fā)者需頻繁地進(jìn)行軟件更新�。此現(xiàn)象在安裝于移動(dòng)設(shè)備上的醫(yī)療器械軟件中更為顯著,產(chǎn)品必須與手機(jī)或平板等裝置的操作系統(tǒng)OS版本相容��。隨著操作系統(tǒng)定期升級(jí)����,若數(shù)字療法軟件未能同步進(jìn)行相容性調(diào)整,可能導(dǎo)致功能異常或資料遺失���,進(jìn)而影響治療過(guò)程的穩(wěn)定性與患者安全����。以美國(guó) FDA 核準(zhǔn)的 reSET 和 reSET-O 為例���,兩者均須安裝于使用者的手機(jī)上��。然而�,使用者常反映�����,某些軟件功能在更新操作系統(tǒng)或軟件版本后會(huì)出現(xiàn)無(wú)法正常運(yùn)作的情況����,顯示即使產(chǎn)品已上市,仍須透過(guò)產(chǎn)品全生命周期管理來(lái)維護(hù)其可靠性與使用體驗(yàn)�����。
此外���,許多數(shù)字療法產(chǎn)品透過(guò)導(dǎo)入人工智慧與機(jī)器學(xué)習(xí)(AI/ML)技術(shù)���,實(shí)現(xiàn)個(gè)人化的治療建議與即時(shí)回饋。然而�,此類個(gè)人化功能常伴隨軟件功能的調(diào)整,一旦調(diào)整范圍超出原有適應(yīng)癥或預(yù)期用途���,可能會(huì)涉及額外的產(chǎn)品變更或向FDA重新提交產(chǎn)品上市申請(qǐng)的需求���。建議開發(fā)者在產(chǎn)品開發(fā)初期建立完整的「醫(yī)療器械軟件預(yù)定變更控制計(jì)劃」
(Predetermined Change Control Plan, PCCP)。透過(guò) PCCP�����,開發(fā)者可預(yù)先界定產(chǎn)品生命周期中可能進(jìn)行的軟件變更范疇�����,例如模型更新�、使用者界面改版、效能提升等�,并規(guī)劃對(duì)應(yīng)的風(fēng)險(xiǎn)評(píng)估、驗(yàn)證程序與監(jiān)管溝通機(jī)制�。如此一來(lái)����,便能在確保產(chǎn)品安全性與療效的前提下����,迅速地依照計(jì)劃進(jìn)行變更,確保數(shù)字療法產(chǎn)品能迅速回應(yīng)市場(chǎng)需求與技術(shù)變化����。
二、醫(yī)療器械人因/可用性工程評(píng)估
使用者與數(shù)字療法產(chǎn)品之間的互動(dòng)模式���,對(duì)其臨床療效具有關(guān)鍵影響���。數(shù)字療法多透過(guò)手機(jī)、平板或電腦界面進(jìn)行操作��,若設(shè)計(jì)未能妥善考量使用者行為����、認(rèn)知負(fù)荷、理解能力或界面易用性����,將可能導(dǎo)致治療依從性下降�����、療效不彰,甚至造成錯(cuò)誤使用的風(fēng)險(xiǎn)���。因此��,在產(chǎn)品設(shè)計(jì)與評(píng)估過(guò)程中���,須嚴(yán)格納入人因工程(Human Factors Engineering, HFE)的考量,確保系統(tǒng)符合使用者需求并能降低使用錯(cuò)誤風(fēng)險(xiǎn)����。此外,部分廠商有意將原本屬于處方等級(jí)(Prescription, Rx)的數(shù)字療法產(chǎn)品轉(zhuǎn)型為非處方產(chǎn)品(Over-the-Counter, OTC)�����,以擴(kuò)大潛在用戶基礎(chǔ)與市場(chǎng)規(guī)模����。此類轉(zhuǎn)變?cè)?近 年 已 有 實(shí) 例 , 例 如 獲 FDA 審核通過(guò)的 EndeavorRx( 用 于 ADHD 治 療, DEN200026)與 Freespira(用于驚恐癥與 PTSD 治療, K180173)等產(chǎn)品�����,均申請(qǐng)將其從 Rx 改列為 OTC。然而�����,Rx 與 OTC 產(chǎn)品在實(shí)際使用情境上有明顯差異���。處方級(jí)產(chǎn)品通常在醫(yī)療專業(yè)人員的指導(dǎo)下使用����,錯(cuò)誤風(fēng)險(xiǎn)相對(duì)較低���;而 OTC 產(chǎn)品則完全仰賴使用者自行判斷與操作����。因此���,當(dāng)業(yè)者擬進(jìn)行此類級(jí)別轉(zhuǎn)換時(shí)�,必須針對(duì)使用場(chǎng)域��、人因風(fēng)險(xiǎn)�、界面設(shè)計(jì)與使用說(shuō)明等面向重新評(píng)估����,并另行向監(jiān)管機(jī)構(gòu)提出申請(qǐng)����,以確保產(chǎn)品在缺乏臨床監(jiān)督的環(huán)境下仍具備安全性與有效性����。監(jiān)管機(jī)構(gòu)在審查此類 OTC 申請(qǐng)時(shí),通常會(huì)要求提供補(bǔ)充的臨床或使用者研究數(shù)據(jù)��,證明產(chǎn)品能在無(wú)醫(yī)師介入的條件下正確使用并達(dá)成預(yù)期療效����。
三、臨床證據(jù)與療效驗(yàn)證策略
數(shù)字療法在取得上市許可前�����,必須針對(duì)其臨床療效與使用安全性進(jìn)行嚴(yán)格驗(yàn)證��。最常見且具高度信度的方法為隨機(jī)對(duì)照試驗(yàn)(Randomized Controlled Trials, RCTs)���,此類試驗(yàn)被視為驗(yàn)證療效的黃金標(biāo)準(zhǔn)��,能提供具說(shuō)服力的因果關(guān)系證據(jù)����。然而��,考量到實(shí)際應(yīng)用場(chǎng)景與特定族群的差異����,監(jiān)管機(jī)構(gòu)也認(rèn)可利用真實(shí)世界數(shù)據(jù)(Real-World Data,RWD)產(chǎn)出適當(dāng)之真實(shí)世界證據(jù)(Real-World Evidence����,RWE),作為醫(yī)療器械效能或安全性資料之依據(jù)或補(bǔ)充的佐證資料���。惟 RWD 所產(chǎn)生的 RWE 須具備充足的質(zhì)量�,才能用于輔助特定的審查決策���。
RWD 可反映產(chǎn)品在一般臨床或日常生活環(huán)境中的實(shí)際表現(xiàn)��,有助于補(bǔ)充臨床試驗(yàn)中可能無(wú)法涵蓋的族群或狀況���,并支援療效與安全性在更廣泛人群中的外部效度�����。此外,對(duì)于以行為介入為主的數(shù)字療法����,療效指標(biāo)不一定侷限于生理或醫(yī)療數(shù)值�����,也可采用行為改變的指標(biāo)來(lái)評(píng)估療效。例如���,在治療物質(zhì)使用障礙的產(chǎn)品中,可能會(huì)以「停止使用物質(zhì)的天數(shù)」作為主要成效指標(biāo)���;在處理注意力缺陷相關(guān)疾患時(shí),則可能采用「注意力集中分?jǐn)?shù)的改善幅度」等心理行為測(cè)量工具�����。
四、醫(yī)療器械軟件的可互通性及網(wǎng)絡(luò)資訊安全
現(xiàn)今的醫(yī)療器械產(chǎn)品越來(lái)越依賴復(fù)雜�����、多元的軟件架構(gòu)����,不僅具備基本的診斷或監(jiān)測(cè)功能,還能跨器械整合的可互通性(Interoperability)���。例如����,多數(shù)數(shù)字醫(yī)療系統(tǒng)可透過(guò)標(biāo)準(zhǔn)化通訊協(xié)定或中央控制模組�����,實(shí)現(xiàn)不同醫(yī)療器械之間的資料共享與聯(lián)動(dòng)運(yùn)作�����。
此外���,這些器械常被串聯(lián)進(jìn)更大型的網(wǎng)絡(luò)架構(gòu)中����,與云端平臺(tái)�����、移動(dòng)設(shè)備或電子病歷系統(tǒng)整合����,形構(gòu)出具備診斷、即時(shí)監(jiān)控��、資料儲(chǔ)存���、遠(yuǎn)距回饋等功能的智慧型整合醫(yī)療系統(tǒng)。然而�����,這種跨平臺(tái)�����、高互聯(lián)性的發(fā)展也為監(jiān)管帶來(lái)顯著網(wǎng)絡(luò)安全(Cybersecurity)挑戰(zhàn)。包括產(chǎn)品組成模組化程度提高����、更新頻率變快、資料流動(dòng)更廣泛�����,皆使得風(fēng)險(xiǎn)管理與法規(guī)遵循的難度大幅提升���。監(jiān)管單位必須重新評(píng)估如何針對(duì)這類復(fù)雜系統(tǒng)進(jìn)行功能驗(yàn)證�����、安全審查與持續(xù)監(jiān)測(cè)��,特別是在系統(tǒng)元件來(lái)自不同開發(fā)者或供應(yīng)鏈的情況下�。
此外��,產(chǎn)品生命周期與營(yíng)運(yùn)模式的變動(dòng)�,也帶來(lái)另一層風(fēng)險(xiǎn)。以 reSET 和 reSETO 為例���,這兩款由 Pear Therapeutics開發(fā)的處方數(shù)字療法����,雖已獲得 FDA 核準(zhǔn)并進(jìn)入市場(chǎng),卻因公司于 2023 年破產(chǎn)并被拆分出售����,使得其產(chǎn)品后續(xù)的維運(yùn)與用戶資料管理成為重大疑慮。此事件凸顯出:一旦產(chǎn)品營(yíng)運(yùn)方退出市場(chǎng)�,如何確保使用者的個(gè)人醫(yī)療資料安全、服務(wù)不中斷��、產(chǎn)品持續(xù)符合法規(guī)�����,將是未來(lái)數(shù)字療法發(fā)展中無(wú)法忽視的核心課題��。
五��、醫(yī)療器械上市后安全管理及不良反應(yīng)
在實(shí)際應(yīng)用情境中�����,數(shù)字療法(DTx)所引發(fā)的安全性疑慮逐漸浮現(xiàn)���,特別是與間接性副作用相關(guān)的風(fēng)險(xiǎn)���。由于這類產(chǎn)品多數(shù)依賴移動(dòng)設(shè)備執(zhí)行,副作用可能不如傳統(tǒng)藥物般明確或立即可察覺��,導(dǎo)致某些不良事件在治療過(guò)程中未被即時(shí)識(shí)別或回報(bào)�。此外,隨著移動(dòng)設(shè)備與APP的廣泛使用�����,APP間的互動(dòng)(App–AppInteractions)變得越來(lái)越不可預(yù)測(cè)�。例如,一個(gè)用于焦慮癥的數(shù)字療法應(yīng)用可能與用戶手機(jī)上其他健康管理或社交媒體軟件產(chǎn)生資訊沖突�、干擾通知機(jī)制,甚至影響使用者行為�����,間接導(dǎo)致治療中斷或心理負(fù)擔(dān)增加����。在目前數(shù)位健康環(huán)境尚未全面規(guī)范的情況下,這類互動(dòng)潛藏的風(fēng)險(xiǎn)值得高度關(guān)注�����。
根據(jù)FDA的現(xiàn)行規(guī)范,制造商有責(zé)任通報(bào)導(dǎo)致死亡或嚴(yán)重傷害的不良事件(Adverse Events)�����。然而����,針對(duì)較輕微但仍可能影響治療結(jié)果或使用者體驗(yàn)的副作用,目前法規(guī)尚缺乏明確界定與報(bào)告機(jī)制��。例如使用者可能因內(nèi)容設(shè)計(jì)不當(dāng)而產(chǎn)生焦慮��、依賴性�����,或在界面操作過(guò)程中產(chǎn)生沮喪與挫折感等�,這些雖未達(dá)嚴(yán)重等級(jí),卻可能影響療效與依從性���。
結(jié)論與建議
數(shù)字療法(DTx)已成為各醫(yī)療先進(jìn)國(guó)家積極發(fā)展的方向��。這類產(chǎn)品透過(guò)整合臨床實(shí)證、互動(dòng)式數(shù)字界面與個(gè)人化醫(yī)療�,在精神健康���、慢性病管理、兒童神經(jīng)發(fā)展障礙等領(lǐng)域�����,逐步展現(xiàn)出具體療效與應(yīng)用潛力�����。然而���,若要使數(shù)字療法走向常規(guī)臨床應(yīng)用��,尚須跨越多項(xiàng)關(guān)鍵門檻與挑戰(zhàn):
1. 法規(guī)框架須因應(yīng)科技演進(jìn)調(diào)整隨著數(shù)字療法工具在醫(yī)療領(lǐng)域日益普�,目前監(jiān)管制度仍以傳統(tǒng)醫(yī)療器械架構(gòu)為主�����,透過(guò)提升對(duì)軟件全生命周期管理與網(wǎng)絡(luò)安全的要求�����,確保數(shù)字療法產(chǎn)品的設(shè)計(jì)���、開發(fā)��、發(fā)布��、支援及停用�����,皆能符合相關(guān)規(guī)定以維持產(chǎn)品的安全及有效性����。
2. 臨床驗(yàn)證與使用者體驗(yàn)須同步強(qiáng)化數(shù)字療法的成功不僅取決于科學(xué)證據(jù),更深受使用者界面�、人因設(shè)計(jì)與患者參與度影響,真實(shí)世界資料的應(yīng)用將更加重要��。此外����,設(shè)計(jì)上須優(yōu)化互動(dòng)性、可用性與個(gè)別化體驗(yàn)�����,以提升對(duì)使用者的可近性。
3. 倫理與資料治理是長(zhǎng)期信任基礎(chǔ)數(shù)字療法涉及大量敏感個(gè)人健康資訊����,若無(wú)健全的資料治理機(jī)制�����,將可能削弱患者信任與社會(huì)接受度��。因此�����,應(yīng)強(qiáng)化個(gè)資保護(hù)�、數(shù)據(jù)透明性與臨床監(jiān)督機(jī)制,確保資料使用符合倫理與合規(guī)要求��,并預(yù)防演算法偏誤對(duì)特定族群造成不利影響�。