時隔十五載,我國醫(yī)藥工業(yè)潔凈環(huán)境監(jiān)測的核心標(biāo)準(zhǔn)——GB/T 16293《醫(yī)藥工業(yè)潔凈室(區(qū))浮游菌的測試方法》迎來了里程碑式的更新�。近日��,國家市場監(jiān)管總局正式發(fā)布了2025年版標(biāo)準(zhǔn)����,將替代已實施十余年的2010年版,并于2026年11月1日正式落地����。該標(biāo)準(zhǔn)自1996年首次發(fā)布����、2010年首次修訂以來��,此次“第二次修訂”堪稱“15年磨一劍”,它不僅凝聚了行業(yè)技術(shù)與監(jiān)管實踐的最新共識����,更標(biāo)志著潔凈室微生物監(jiān)控理念的根本性變革��。本文旨在通過系統(tǒng)對照新舊兩版標(biāo)準(zhǔn),剖析其從“規(guī)范性操作手冊”到“風(fēng)險管理指南”的核心轉(zhuǎn)變����,精準(zhǔn)解讀其在技術(shù)細(xì)節(jié)�、評估原則與責(zé)任主體等方面的關(guān)鍵修訂�,進(jìn)而為制藥人員厘清思路�、提供應(yīng)對策略��。
PART.01結(jié)構(gòu)與章節(jié)
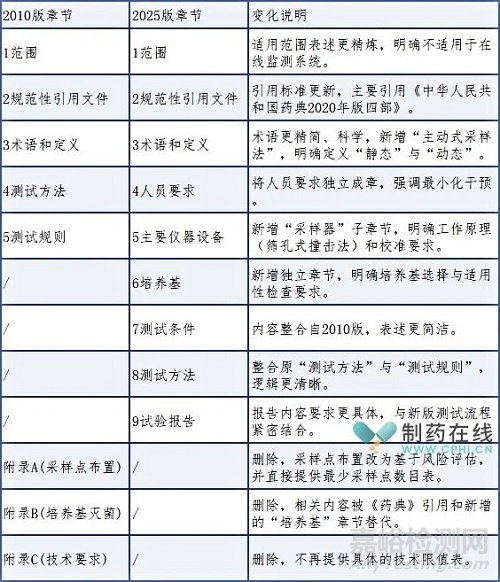
本次《醫(yī)藥工業(yè)潔凈室(區(qū))浮游菌的測試方法》的修訂在章節(jié)結(jié)構(gòu)與技術(shù)內(nèi)容上均實現(xiàn)了顯著優(yōu)化��。結(jié)構(gòu)重組��,邏輯清晰:新版按照“人員-設(shè)備-物料-條件-方法-報告”的質(zhì)量管理體系邏輯重組,結(jié)構(gòu)更合理�,易于理解和執(zhí)行����。舊版中的“結(jié)果評定”、“日常監(jiān)控”及全部附錄均被刪除�,顯示出標(biāo)準(zhǔn)從提供具體限值的“操作規(guī)定”向側(cè)重方法科學(xué)性與風(fēng)險管理��、強(qiáng)調(diào)企業(yè)責(zé)任的“方法學(xué)指南”的根本性轉(zhuǎn)變��,整體結(jié)構(gòu)更清晰��,與國際先進(jìn)標(biāo)準(zhǔn)進(jìn)一步接軌。新舊章節(jié)結(jié)構(gòu)對比如下表:
PART.02新舊版《醫(yī)藥工業(yè)潔凈室(區(qū))浮游菌的測試方法》對照看
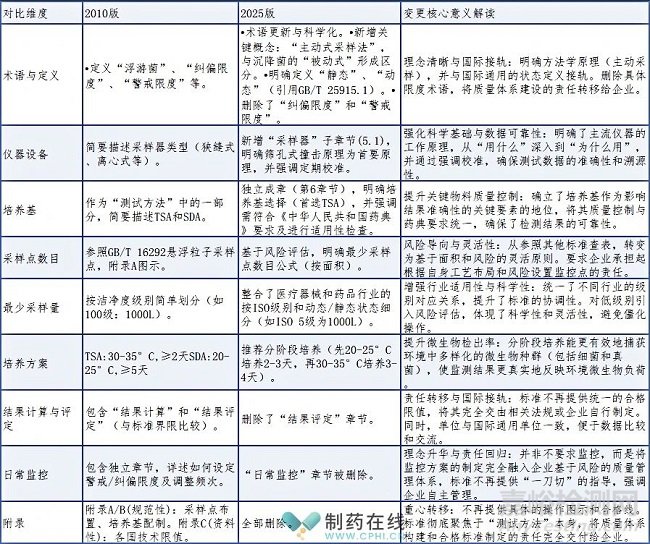
本次《醫(yī)藥工業(yè)潔凈室(區(qū))浮游菌的測試方法》的修訂�,標(biāo)志著標(biāo)準(zhǔn)理念的根本性轉(zhuǎn)變:從一份提供具體操作指令的“規(guī)范性操作手冊”�,演進(jìn)為一部強(qiáng)調(diào)“科學(xué)性與風(fēng)險管理為導(dǎo)向的方法學(xué)指南”。新版標(biāo)準(zhǔn)通過明確儀器工作原理����、強(qiáng)化培養(yǎng)基質(zhì)量控制和優(yōu)化微生物培養(yǎng)條件����,顯著提升了方法的科學(xué)性與數(shù)據(jù)的可靠性����。同時��,它將“風(fēng)險評估”確立為核心原則��,用于指導(dǎo)采樣點布置、采樣量確定等關(guān)鍵決策�,要求企業(yè)必須基于自身產(chǎn)品與工藝特性做出科學(xué)判斷�。此外��,標(biāo)準(zhǔn)刪除了統(tǒng)一的微生物限值與監(jiān)控頻次規(guī)定,將制定“警戒限度”�、“糾偏限度”和“合格標(biāo)準(zhǔn)”的責(zé)任明確轉(zhuǎn)移給企業(yè),強(qiáng)調(diào)了企業(yè)作為質(zhì)量第一責(zé)任人的主體角色����。在結(jié)構(gòu)上����,新版將原有附錄內(nèi)容整合至正文�,使標(biāo)準(zhǔn)更清晰易用;在技術(shù)上��,通過采用ISO潔凈級別�、允許分段培養(yǎng)等細(xì)節(jié),提升了方法的嚴(yán)謹(jǐn)性與靈活性��。這一系列變化在術(shù)語�、單位及結(jié)構(gòu)理念上均與國際先進(jìn)標(biāo)準(zhǔn)(如ISO、EU GMP)全面接軌����,有力推動了我國醫(yī)藥行業(yè)潔凈環(huán)境監(jiān)測水平的全球化進(jìn)程與質(zhì)量管理的成熟度提升。GB/T 16293-2010與2025對比分析如下表:
參考文獻(xiàn):
[1] 國家市場監(jiān)管總局官網(wǎng)等