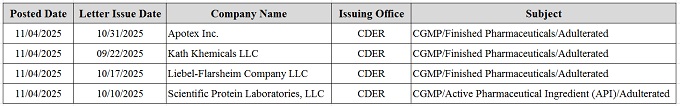
2025年11月04日,FDA發(fā)布了針對四家制藥企業(yè)的警告信���,揭露了從無菌注射劑到非處方外用藥�、從原料藥到成品制劑等多個環(huán)節(jié)存在的嚴重質(zhì)量控制缺陷。這些警告信不僅指向具體的技術違規(guī)�,更暴露出制藥行業(yè)在質(zhì)量管理體系、調(diào)查機制�、無菌保障和供應商控制等方面存在的深層次問題。這些問題的嚴重程度足以威脅患者安全�,同時也反映出企業(yè)質(zhì)量體系的漏洞,值得整個制藥行業(yè)高度警惕����。
Apotex Inc.:無菌保障體系失靈
Apotex Inc.的無菌藥品生產(chǎn)體系存在系統(tǒng)性失靈。FDA檢查發(fā)現(xiàn)����,從2023年9月到2025年4月間����,Apotex Inc.至少有8次關鍵的泄漏測試失敗未得到充分調(diào)查。更為嚴重的是����,生產(chǎn)人員并未尋找根本原因,而是通過重復測試直至獲得合格結(jié)果的方式來“解決”問題——這種做法本質(zhì)上是在掩蓋潛在的質(zhì)量風險����,而非真正解決問題���。這種文化導致在超過一年的時間里,生產(chǎn)人員在不確認設備完整性的情況下繼續(xù)進行無菌灌裝操作���,將無數(shù)患者的健康置于風險之中����。
檢查期間���,監(jiān)管人員發(fā)現(xiàn)超過30個獨立區(qū)域的隔離器系統(tǒng)存在泄漏���,包括多個用于引入無菌部件的接口點。值得注意的是����,在FDA檢查之前,已有另一監(jiān)管機構指出了類似的隔離器完整性問題���,但公司未能及時采取有效措施����。另一個典型案例涉及容器密封完整性問題的處理:2024年6月,公司發(fā)現(xiàn)某溶液穩(wěn)定性樣品蓋下有殘留物����,調(diào)查確定根本原因是產(chǎn)品配方與容器密封蓋內(nèi)襯不兼容,導致內(nèi)襯腐蝕和產(chǎn)品泄漏�。盡管公司將風險評定為“不可接受/高風險”,卻未對已在美國市場分銷的產(chǎn)品采取任何市場行動�。
在無菌保障方面,Apotex的表現(xiàn)同樣令人擔憂�。檢查人員觀察到隔離器手套變色、設備內(nèi)表面有殘留物����、隔離器環(huán)境內(nèi)有明顯變色的塑料器具,以及密封墊圈老化等問題�。更嚴重的是����,人員未遵守既定的凈化程序——手套在凈化周期中出現(xiàn)多處褶皺���,而程序明確要求手套應“無褶皺”�。這些褶皺導致內(nèi)表面無法完全暴露于凈化劑,直接影響凈化效果�。此外,使用膠帶粘貼“假蓋”以維持密封環(huán)境的做法�,進一步暴露了公司在維護管理上的隨意性。
環(huán)境監(jiān)控體系的缺陷同樣明顯:關鍵區(qū)域缺乏連續(xù)的非活性粒子監(jiān)測�,僅依靠單個遠離關鍵開放操作區(qū)域的監(jiān)測探頭。這種不充分的監(jiān)控無法提供有意義的數(shù)據(jù)來評估生產(chǎn)過程中的產(chǎn)品風險���。最令人不安的是三批不同藥品生產(chǎn)過程中發(fā)生的隔離器手套破裂事件���,其中一次出現(xiàn)了6毫米的破洞,工作人員竟用“電纜扎帶”封閉破洞后繼續(xù)生產(chǎn)����。這種臨時修補做法完全無法緩解因手套完整性喪失導致的污染風險����,公司后來雖然召回這些產(chǎn)品�,但這是在FDA檢查后才采取的被動反應。
Kath Khemicals LLC:質(zhì)量體系缺失
與Apotex高度專業(yè)化的問題相比����,Kath Khemicals的違規(guī)行為更顯基礎性���,反映出該公司質(zhì)量體系幾乎從零開始。該公司生產(chǎn)的非處方抗菌洗手液和手部消毒劑缺乏基本的成品檢驗——批記錄顯示公司并非始終對最終配方進行成品檢測���,例如在某批次抗菌洗手液生產(chǎn)中,僅在A階段取樣���,未記錄是否抽取了最終放行檢測樣品�。此外���,公司使用市政用水作為藥品成分����,卻未對水或成品進行任何微生物檢測�,這種疏忽在非無菌藥品中同樣不可接受。
成分控制方面的問題尤為令人擔憂:公司對包括甘油在內(nèi)的進廠成分缺乏充分的鑒別檢驗���,特別是甘油鑒別方法未包含對二甘醇和乙二醇的限度檢測。歷史上����,這兩種污染物曾導致多起致命中毒事件�,F(xiàn)DA已發(fā)布專門指南要求對高風險成分進行嚴格檢測����。然而,該公司的回應對此問題缺乏詳細計劃���,也未考慮對已分銷產(chǎn)品進行回顧性評估。
公司的穩(wěn)定性考察計劃同樣形同虛設——僅將留樣視為穩(wěn)定性樣品�,僅對其進行顏色和外觀的視覺檢查,且不記錄結(jié)果����。沒有適當?shù)姆€(wěn)定性研究,公司就缺乏科學證據(jù)證明其產(chǎn)品在12個月的有效期內(nèi)能保持質(zhì)量屬性�。質(zhì)量部門的失職更是觸目驚心:公司缺乏質(zhì)量部門職責、調(diào)查����、變更控制、CAPA���、召回�、返工和批拒絕等方面的標準操作規(guī)程,批記錄中混合時間�、活性成分批號和放行檢測結(jié)果等關鍵信息缺失。
Liebel-Flarsheim Company LLC:微生物控制失守
Liebel-Flarsheim公司生產(chǎn)的終端滅菌注射劑面臨著嚴重的微生物控制問題���。自2022年以來���,盡管有過濾步驟,公司仍有至少40個生物負載檢測結(jié)果超過微生物限度���,包括“多不可計”的結(jié)果���。這些生物負載中包含革蘭氏陰性微生物,可能導致內(nèi)毒素水平升高����。然而,公司對這些偏差的調(diào)查缺乏科學合理的根本原因分析����,常以“根本原因未確定”或籠統(tǒng)歸因于“人員”或“環(huán)境”作為結(jié)論。
公司在處理OOS內(nèi)毒素結(jié)果時的做法同樣存在問題:多次通過重新稀釋使不合格結(jié)果變?yōu)楹细?���,繼而無效原始OOS結(jié)果���,卻未進行充分的根本原因調(diào)查�。例如,對某批產(chǎn)品OOS內(nèi)毒素結(jié)果的調(diào)查最初未找到可識別根本原因���,重新測試使用新稀釋液獲得合格結(jié)果后����,公司便無效了OOS�。調(diào)查結(jié)論是“初始稀釋意外交叉污染”導致OOS,卻未能確定污染源����。更矛盾的是,糾正措施是向分析員提供“加強意識培訓”�,這與調(diào)查最初認定分析員和程序非問題原因的結(jié)論相矛盾。
設施和設備的老化問題加劇了微生物風險:潔凈室(如ISO 5灌裝線和ISO 7稱量配制室)設計維護不當����,過多填縫料和膠帶用于修補HEPA過濾器、通風口和隔離器周圍的縫隙�,多處設備生銹。水系統(tǒng)狀況更是嚴重——絕緣層剝落����、嚴重生銹和腐蝕���,多處泄漏導致水聚集,甚至有一處泄漏點用水桶接水�。這些條件可能導致污物和微生物在整個生產(chǎn)區(qū)域擴散。
環(huán)境監(jiān)測計劃自2019年以來一直顯示設施內(nèi)尤其是ISO 5灌裝線潔凈室存在過度微生物污染���,分離出的菌種被鑒定為水微生物�,暗示水系統(tǒng)是潛在污染源����。盡管公司在2023年和2024年啟動了CAPA和變更控制以整改環(huán)境偏差,但2025年的檢查發(fā)現(xiàn)微生物在設施內(nèi)持續(xù)存在�。公司承諾在2026年8月前重建潔凈室,2027年4月前更換水系統(tǒng)主要組件�,但FDA認為這些時間表不可接受,要求加速整改����。
Scientific Protein Laboratories,LLC:原料藥外來污染調(diào)查不足
該公司作為原料藥生產(chǎn)企業(yè)����,面臨著動物源性API特有的挑戰(zhàn)�,但其質(zhì)量控制問題同樣嚴重�。檢查人員觀察到API接觸表面的工作臺有眾多凹槽和劃痕,這些缺陷可能導致金屬顆粒污染API�。公司回應稱已維修受影響的工作臺,檢查了所有在用工作臺����,并停用更換了類似單元�,同時通過檢測控制顆粒。然而����,F(xiàn)DA認為回應不充分,缺乏預防性維護計劃確保維修后工作臺適用于生產(chǎn)���,也未評估工作臺材料是否足以最大限度減少外來金屬顆粒引入API���,更未對可能已受污染的有效期內(nèi)API進行風險評估。
調(diào)查不足的問題在API領域同樣存在:對甲狀腺粉末批次穩(wěn)定性研究中測定失敗的調(diào)查將取樣程序確定為潛在根本原因���,修訂程序要求從API桶內(nèi)多個位置取樣����,使用修訂后程序?qū)π聵悠愤M行測定并獲得合格結(jié)果。但調(diào)查未包含支持所謂根本原因的充分證據(jù)或理由���,F(xiàn)DA擔憂混合取樣可能掩蓋個別不合格測試結(jié)果�,這對治療窗狹窄的藥物尤為關鍵���。另一例胰腺酶濃縮物中殘留溶劑限度失敗的調(diào)查確定了工藝中某個步驟為潛在根本原因�,實施了CAPA�,但2024年再次出現(xiàn)類似失敗。雖然這些批次未被放行���,但調(diào)查缺乏充分的根本原因分析以評估制造過程中所有可能導致失敗的可變因素���。
最令人擔憂的是多批產(chǎn)品因病毒檢測陽性被拒——FDA承認公司拒絕了這些批次,并認識到病毒是動物源性API的已知風險因素����。甲狀腺和胰脂肪酶產(chǎn)品的制造過程本身風險較高,因為傳統(tǒng)病毒清除方法通常不可行�,因此需要丟棄任何病毒陽性材料的控制策略。然而�,對胰脂肪酶產(chǎn)品陽性病毒結(jié)果調(diào)查的關鍵差距包括未充分評估污染批次間的清潔程序、未將調(diào)查擴展到陽性批次之外的所有來源材料,以及未評估甲狀腺批次和受感染胰腺材料是否來自同一供應商���。
行業(yè)啟示
四家不同企業(yè)����、不同類型的產(chǎn)品���,卻面臨著相似的質(zhì)量管理困境�,這揭示出制藥行業(yè)一些共通的系統(tǒng)性漏洞�。最突出的問題是調(diào)查機制的形式化——企業(yè)未能對偏差����、OOS結(jié)果和失敗進行徹底、基于科學的調(diào)查�,缺乏合理的根本原因分析,糾正措施流于表面�,未能防止問題復發(fā)。無論是Apotex對泄漏測試失敗的漠視���,Liebel-Flarsheim對生物負載超標的輕描淡寫���,還是Scientific Protein Laboratories對病毒污染調(diào)查的局限,都反映出企業(yè)未能建立強有力的調(diào)查文化。
其次�,預防性質(zhì)量管理的缺失在這些案例中尤為明顯。企業(yè)普遍采取被動應對而非主動預防的策略——Apotex在泄漏發(fā)生后才更換關鍵部件���,Kath Khemicals在缺乏基本質(zhì)量體系的情況下投入生產(chǎn)�,Liebel-Flarsheim對設施老化的漠視直至微生物污染頻發(fā)才著手整改����。這種“事后補救”而非“事前預防”的思維方式直接導致了質(zhì)量風險的持續(xù)存在。
最后���,質(zhì)量部門未能有效履行其監(jiān)督職責是這些企業(yè)的通病���。質(zhì)量部門或缺乏足夠授權和資源,或未能獨立于生產(chǎn)壓力做出決策����,導致質(zhì)量問題被忽視、淡化或掩蓋����。
這四封警告信共同描繪了制藥行業(yè)質(zhì)量管控的嚴峻現(xiàn)狀,也為整個行業(yè)敲響了警鐘����。在患者安全和產(chǎn)品質(zhì)量這一底線問題上���,任何妥協(xié)都可能導致不可挽回的后果。制藥企業(yè)需要從根本上重新審視其質(zhì)量文化����,實施預防性質(zhì)量策略,確保質(zhì)量部門的獨立運行�。在監(jiān)管日趨嚴格、患者期望不斷提高的今天���,質(zhì)量不再是一種選擇�,而是制藥企業(yè)生存與發(fā)展的基石����。
來源:FDA官網(wǎng)