在臨床實踐中�����,窄治療指數(shù)(NTI)藥物指需要謹(jǐn)慎調(diào)整劑量并進(jìn)行常規(guī)臨床監(jiān)測才能實現(xiàn)有效治療的藥物����。NTI藥物一般用于預(yù)防或治療嚴(yán)重疾?���。ㄈ绨d癇、心力衰竭�����、心律失常����、甲狀腺功能減退��、血栓栓塞����、靜脈血栓形成�����、哮喘�����、慢性阻塞性肺疾病和器官移植)的患者群體��。與常規(guī)藥物相比��,NTI藥物的有效濃度與中毒濃度之間的差異較小�����,劑量的微小變化可能導(dǎo)致藥理作用的顯著變化��,從而增加患者(尤其是老年患者�����、合并多種疾病、依從性差或同時使用多種藥物的患者)發(fā)生嚴(yán)重不良事件或療效不佳的風(fēng)險����。因此,臨床醫(yī)生通常會監(jiān)測使用NTI藥物患者的系統(tǒng)藥物濃度和/或藥效學(xué)(PD)效應(yīng)�����,以安全地調(diào)整劑量并提供個體化治療��。
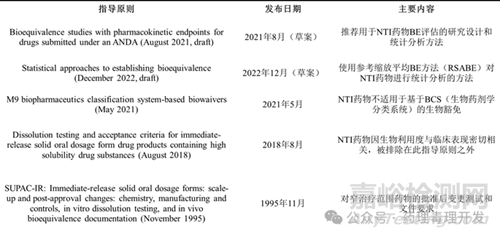
過去��,NTI藥物的識別主要基于臨床實踐的經(jīng)驗����。通常被認(rèn)為具有NTI的藥物包括華法林�����、碳酸鋰����、地高辛����、苯妥英����、茶堿和他克莫司等。目前����,各監(jiān)管機(jī)構(gòu)對NTI藥物尚缺乏統(tǒng)一接受的術(shù)語、定義和標(biāo)準(zhǔn)化定量標(biāo)準(zhǔn)����。例如,歐洲藥品管理局(EMA)使用“NTI藥物”這一術(shù)語�����,日本藥品安全局(PSB)使用“窄治療范圍藥物”��,加拿大衛(wèi)生部則使用“關(guān)鍵劑量藥物”這一術(shù)語�����。加拿大衛(wèi)生部對“關(guān)鍵劑量藥物”的定義為:那些劑量或濃度的微小差異可能導(dǎo)致嚴(yán)重治療失敗和/或嚴(yán)重藥物不良反應(yīng)的藥物����。EMA沒有提供明確的定義或評估NTI藥物的標(biāo)準(zhǔn)��,但通常建議基于臨床考慮進(jìn)行逐案NTI評估��。日本PSB提供了一份窄治療范圍藥物清單�����,但未提供定義或納入該清單的具體標(biāo)準(zhǔn)��。
美國聯(lián)邦法規(guī)(21 CFR 320.33)將窄治療比藥物定義為:1)半數(shù)致死劑量(LD50)和半數(shù)有效劑量(ED50)的中位數(shù)差異小于2倍�����,或者血液中毒性濃度下限和有效濃度下限的差異小于2倍;2)需要謹(jǐn)慎調(diào)整劑量和患者監(jiān)測才能確保藥物的安全��、有效使用�����。然而��,這一定義的實用性存在一些挑戰(zhàn)����。1995年����,美國食品藥品監(jiān)督管理局(FDA)發(fā)布了行業(yè)指南文件��,提供了一份窄治療范圍藥物清單����,但未提供定義和標(biāo)準(zhǔn)。1999年����,F(xiàn)DA首次發(fā)布(后經(jīng)修訂)的草案指南將窄治療范圍藥物定義為“那些需要進(jìn)行治療藥物監(jiān)測的藥物物質(zhì),和/或產(chǎn)品標(biāo)簽中注明該藥物為窄治療范圍藥物”��。隨后����,F(xiàn)DA在2006年和2012年發(fā)布了(后經(jīng)修訂并納入其他指南)的草案指南,列出了具有窄治療范圍的細(xì)胞色素P-450(CYP)底物�����。窄治療范圍的CYP底物是指那些暴露-反應(yīng)關(guān)系表明,由于同時使用CYP抑制劑導(dǎo)致暴露水平的小幅增加可能引發(fā)嚴(yán)重安全問題的藥物��。2010年和2011年��,F(xiàn)DA召開了咨詢委員會會議�����,討論了這些藥物的術(shù)語和定義等問題��。根據(jù)咨詢委員會的建議�����,FDA目前使用“NTI藥物”這一術(shù)語�����,定義為“那些劑量或血液濃度的微小差異可能導(dǎo)致危及生命的嚴(yán)重治療失敗和/或?qū)е鲁掷m(xù)或顯著的殘疾或喪失能力的藥物不良反應(yīng)的藥物”�����。鑒于這些術(shù)語的不一致����,各監(jiān)管機(jī)構(gòu)之間為NTI藥物的術(shù)語和定義進(jìn)行協(xié)調(diào)合作,可能有助于在藥物開發(fā)和監(jiān)管審查過程中增強(qiáng)清晰度和一致性�����。
NTI仿制藥
鑒于藥品的高成本�����,美國各州已通過法律和/或法規(guī)�����,鼓勵用仿制藥替代創(chuàng)新藥��。此外����,F(xiàn)DA實施了藥物競爭行動計劃(Drug Competition Action Plan, DCAP),旨在進(jìn)一步促進(jìn)仿制藥市場的競爭�����,提高仿制藥審評的效率和透明度�����。
無論藥物是否為NTI藥物,創(chuàng)新藥都可以被治療等效的仿制藥替代�����,且替代產(chǎn)品在標(biāo)簽規(guī)定的條件下使用時����,預(yù)期具有與原研藥相同的臨床效果和安全性。為了達(dá)到治療的生物等效性(BE)��,仿制藥必須滿足以下條件:
1)是藥品等效物(含有相同劑量����、相同活性成分、相同劑型和給藥途徑)��;
2)已證明生物等效性�����;
3)在標(biāo)簽規(guī)定的條件下使用時�����,預(yù)期具有相同的臨床效果和安全性��。
BE是指在相同摩爾劑量下��,藥品等效物(或藥品替代品)在藥物作用部位的活性成分或活性部分的釋放速率和程度沒有顯著差異�����。FDA通過發(fā)布《經(jīng)治療等效性評價批準(zhǔn)藥品》(即“橙皮書”)來識別批準(zhǔn)的藥品信息��、專利和市場獨占信息等����。此外,F(xiàn)DA還發(fā)布產(chǎn)品特定指南(PSGs)��,分享其對創(chuàng)新藥和仿制藥之間建立治療等效性的最合適方法的當(dāng)前觀點和建議�����。
對于NTI藥物����,F(xiàn)DA在指南中發(fā)布了針對這類藥物的獨特建議,以促進(jìn)NTI藥物的仿制藥開發(fā)�����。
常規(guī)藥物的BE要求
對于大多數(shù)常規(guī)藥物,BE研究的重點是藥物從制劑中釋放進(jìn)入系統(tǒng)循環(huán)的過程����。在BE研究中,申請人將受試制劑(T�����,通常是仿制藥)的系統(tǒng)暴露特征與參比制劑(R����,也稱為參考產(chǎn)品,RS)進(jìn)行比較����。RS是由FDA選定的,用于ANDA(簡化新藥申請)審批所需的體內(nèi)BE研究的藥物��。通常情況下�����,F(xiàn)DA會選擇橙皮書中指定的參比制劑(RLD)作為RS�����。但在某些情況下,如RLD因安全性和有效性以外的原因撤市時��,RS和RLD可能會有所不同��。
BE研究通常依賴藥代動力學(xué)(PK)終點��,如達(dá)峰濃度(Cmax)和曲線下面積(AUC)����,通過測定生物基質(zhì)(如全血�����、血漿或血清)中的藥物濃度來評估藥物的吸收速率和程度�����。對于大多數(shù)劑型�����,F(xiàn)DA推薦采用單劑量��、兩周期�����、兩序列、兩處理(如兩交叉)設(shè)計�����,受試者在不同周期分別接受T和R制劑����。在統(tǒng)計分析中,采用雙單側(cè)檢驗(TOST)方法比較T和R制劑的平均PK值�����,這種方法也被稱為平均生物等效性分析(ABE)�����。
在ABE分析中����,主要比較的是T和R制劑的平均PK參數(shù)的比值,而不是差異����。由于統(tǒng)計分析建議對PK數(shù)據(jù)進(jìn)行對數(shù)轉(zhuǎn)換����,因此可以在對數(shù)尺度上推斷兩種均值的差異����,并將其重新轉(zhuǎn)換為原始尺度上兩種平均值(幾何均值)的比值。對于常規(guī)藥物(非高變異性藥物或NTI藥物)�����,BE接受標(biāo)準(zhǔn)要求每個PK參數(shù)的幾何均值比的90%置信區(qū)間(CI)完全落在80.00%到125.00%之間����。這點����,相信大多數(shù)朋友是熟知的。那么對于NTI類藥物�����,也參照這一標(biāo)準(zhǔn)嗎��?FDA針對NTI藥物的相關(guān)指南如下��。
NTI藥物BE要求
與常規(guī)藥物相比,F(xiàn)DA建議對NTI藥物采用更嚴(yán)格的質(zhì)量和BE標(biāo)準(zhǔn)�����,以確保其與RLD的治療等效性����。這些更嚴(yán)格的BE標(biāo)準(zhǔn)的制定,主要基于之前的咨詢委員會建議����、對NTI藥物的建模與模擬研究,以及FDA內(nèi)部討論����。
對于NTI藥物的BE評估,F(xiàn)DA推薦采用體內(nèi)BE研究����,使用參考縮放平均生物等效性(RSABE)方法,并采用四周期��、完全重復(fù)交叉設(shè)計�����。在這種設(shè)計中,受試者在四個周期內(nèi)分別接受兩次T和R�����,采用T-R-T-R或R-T-R-T的序列����。通過重復(fù)給藥,可以計算受試制劑(sWT)和參比制劑(sWR)的個體內(nèi)標(biāo)準(zhǔn)差��,用于評估兩者的個體內(nèi)變異性(WSV)��。這種WSV比較被認(rèn)為是評估NTI藥物的關(guān)鍵�����,因為測試產(chǎn)品的藥物濃度變異性增加可能會導(dǎo)致治療失敗或嚴(yán)重不良事件����。
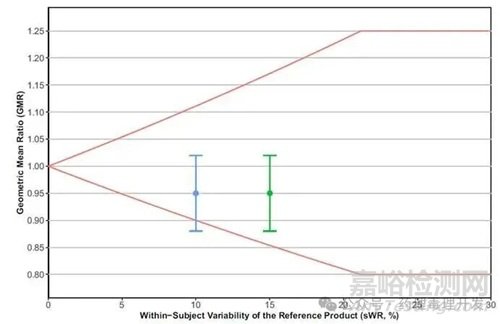
此外��,NTI藥物的BE評估使用比常規(guī)藥物更嚴(yán)格的BE限值�����。由于大多數(shù)NTI藥物的藥代動力學(xué)參數(shù)具備低至中等程度的WSV(≤30%),F(xiàn)DA根據(jù)參比制劑的sWR調(diào)整BE限值����,但上限不超過常規(guī)BE限值80.00%~125.00%。例如��,當(dāng)sWR為0.1時��,BE限值為90.00%~111.11%����;當(dāng)sWR不是0.1時,BE限值會根據(jù)sWR調(diào)整��。當(dāng)sWR<0.1時�����,BE限值比90.00%~111.11%更窄��。當(dāng)sWR>0.1時����,BE限值比90.00%~111.11%更寬��,但不會超過80.00%~125.00%��。如下圖紅線所示����。圖中還給了兩個示例��,當(dāng)sWR為15%時�����,BE接受范圍為0.85-1.17��,綠色的90% CI為0.88-1.02����,完全落在等效范圍內(nèi)��。當(dāng)sWR為10%時��,BE接受范圍為0.90-1.11�����,受試藥物90% CI(0.88-1.02),下限落在等效范圍以外�����,即不再生物等效����。
FDA還建議,NTI藥物的BE研究需滿足以下標(biāo)準(zhǔn):
1)使用參考縮放平均BE分析��,95%上限置信區(qū)間小于或等于零�����;
2)使用未縮放平均BE分析��,幾何均值比的90%置信區(qū)間在80.00%~125.00%之間��;
3)受試制劑與參比制劑個體內(nèi)標(biāo)準(zhǔn)差比值(σWT/σWR)的90%置信區(qū)間上限不超過2.5����。
此外,F(xiàn)DA的產(chǎn)品特定指南還可能建議進(jìn)行體外BE研究(如溶出度測試)或提供其他BE標(biāo)準(zhǔn)����。
另外��,尚未獲批的ANDA申請可能會受到藥品NTI特性認(rèn)定的影響�����。一旦確定某藥物符合NTI藥物的一般特征�����,F(xiàn)DA將更新PSG����,推薦采用NTI藥物的BE研究方法��,包括四周期����、完全重復(fù)交叉設(shè)計以及NTI藥物的BE標(biāo)準(zhǔn)。如果申請人在新的或修訂的PSG推薦的NTI藥物BE標(biāo)準(zhǔn)之前��,已經(jīng)開始了體內(nèi)BE研究����,申請人可以請求PSG電話會議��,以獲取機(jī)構(gòu)對其開發(fā)計劃可能受到的影響的反饋。
在某些情況下����,ANDA可能在FDA認(rèn)定該藥物為NTI藥物之前獲批,因此未采用四周期�����、完全重復(fù)交叉設(shè)計和NTI藥物的BE標(biāo)準(zhǔn)����。通常,F(xiàn)DA在批準(zhǔn)時會認(rèn)定藥物與RLD生物等效且治療等效��。盡管FDA會認(rèn)為其當(dāng)前的NTI藥物BE方法是最準(zhǔn)確��、靈敏和可重復(fù)��,但并不意味著之前進(jìn)行的BE研究無法檢測到仿制藥與RLD在PK特征上的臨床顯著性差異����。除非FDA發(fā)現(xiàn)證據(jù)表明ANDA產(chǎn)品可能與相應(yīng)RLD不具有治療等效性,或者申請人計劃對已批準(zhǔn)的藥物進(jìn)行變更并需要新的BE研究來支持變更的批準(zhǔn)����,否則FDA通常不期望已獲批ANDA的持有人根據(jù)獲批后修訂的BE建議重新按照新的標(biāo)準(zhǔn)進(jìn)行BE驗證�����。