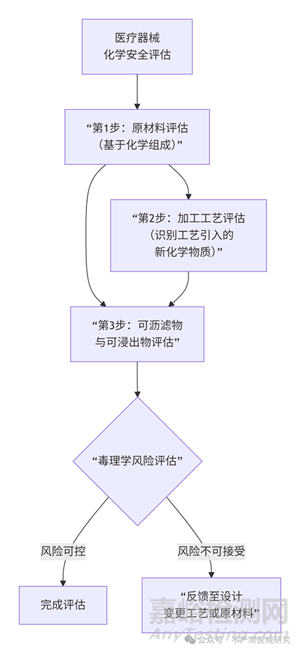
醫(yī)療器械的臨床前化學安全評估是一個系統(tǒng)性工程�,其核心邏輯是:從原材料到成品���,逐步識別�、評估和控制所有潛在的化學風險���。
評估順序和方式遵循一個由寬到窄、由淺入深的原則����。下圖清晰地展示了這一整體評估流程與策略:
第1步:原材料評估
這是化學安全評估的起點和基礎,目標是了解構成醫(yī)療器械的基本化學材料的本質安全性�。
評估方式:
供應商信息收集與確認:
化學組成: 準確的聚合物型號、添加劑(如增塑劑�、抗氧化劑����、穩(wěn)定劑)清單及其含量。
合規(guī)性聲明: 證明材料符合相關法規(guī)或藥典(如USP <87>, <88>, EP 3.1)的聲明����。
生物學安全性數(shù)據(jù): 供應商可能提供的已有毒理學測試報告(如ISO 10993系列測試報告)���。
方式: 向原材料供應商索取詳細的材料信息���,包括:
目的: 建立材料的“身份檔案”,并利用已有的安全數(shù)據(jù)作為評估基礎����。
化學表征:
傅里葉變換紅外光譜: 用于確認材料的基本化學結構。
熱重分析-差示掃描量熱法: 用于分析材料的熱穩(wěn)定性����、結晶度和成分���。
氣相色譜-質譜聯(lián)用/液相色譜-質譜聯(lián)用: 用于定性和定量分析材料中的揮發(fā)性/半揮發(fā)性及非揮發(fā)性有機物(如殘留單體����、添加劑)。
方式: 如果供應商信息不足���,或需要獨立驗證,實驗室會進行化學表征測試���。
目的: 客觀地揭示原材料中的化學成分���,包括預期和非預期的物質。
風險評估:
方式: 將識別出的化學成分(尤其是已知有毒性的物質�,如某些增塑劑、重金屬�、多環(huán)芳烴�、亞硝胺等)與已知的毒理學數(shù)據(jù)庫進行比較,評估其潛在風險�。
目的: 判斷原材料本身的化學組成是否安全,是否需要尋找更安全的替代品����。
第2步:加工工藝評估
此階段評估制造過程如何改變原材料����,以及是否會引入新的化學風險���。
評估方式:
工藝助劑識別:
脫模劑: 在注塑成型中使用。
清潔劑/消毒劑: 用于部件清洗����。
粘合劑: 用于組件組裝。
潤滑劑: 用于注射器或導管等����。
滅菌劑殘留: 如環(huán)氧乙烷、過氧化氫等����。
方式: 詳細審查生產(chǎn)工藝流程����,識別所有使用的加工助劑,例如:
目的: 列出所有可能殘留在最終產(chǎn)品上的外來化學物質清單�。
化學變化分析:
聚合物降解: 高溫加工可能導致聚合物鏈斷裂,產(chǎn)生新的低分子量物質���。
新物質生成: 如輻照滅菌可能產(chǎn)生新的降解產(chǎn)物�。
方式: 評估加工條件(如高溫�、高壓、輻射)是否會導致材料發(fā)生化學變化�。
目的: 預測并識別因加工過程而新產(chǎn)生的化學物質。
清潔驗證:
方式: 通過取樣和化學分析(如TOC分析����、特定殘留物檢測)���,驗證清潔工藝能有效去除工藝助劑至安全水平����。
目的: 確保工藝助劑不會以不安全水平殘留于產(chǎn)品上����。
第3步:可瀝濾物與可浸出物評估
這是化學安全評估的核心和最關鍵的環(huán)節(jié),評估在臨床使用條件下���,醫(yī)療器械中哪些化學物質會釋放到患者體內���。
重要概念區(qū)分:
可浸出物: 在加速實驗室條件下(如極端溶劑、高溫����、長時間),從器械中提取出的化學物質���。其研究目的是預測潛在的可瀝濾物����。
可瀝濾物: 在正常的臨床使用條件下����,從器械中釋放到患者或藥液(如血液����、注射液)中的化學物質���。這是直接的風險評估對象�。
評估方式:
可浸出物研究:
模擬浸提: 使用與產(chǎn)品接觸的液體(如注射液����、模擬體液)或在更嚴苛的條件下(如不同pH值的溶劑����、高溫����、長時間)對最終產(chǎn)品或其代表性樣品進行浸提�。
全面分析: 利用高分辨率的分析技術(如GC-MS, LC-MS, LC-HRMS, ICP-MS)對浸提液進行未知物篩查和目標物定量。這被稱為“基于風險的分析化學評估”�。
方式:
目的: 建立一個全面的、可能從器械中瀝濾出來的化學物質“候選清單”���。
可瀝濾物研究 / 毒理學風險評估:
實際使用條件浸提: 在模擬實際臨床使用的條件下(如正確的溫度���、時間�、介質)進行浸提,定量分析在E&E研究中識別的關鍵物質����。
毒理學風險評估: 這是將化學數(shù)據(jù)轉化為安全結論的關鍵一步。
識別: 確定檢測到的每種可瀝濾物是什么���。
定量: 確定其從器械中釋放的濃度或總量(如μg/device)�。
評估: 查閱毒理學數(shù)據(jù)庫(如通過ISO 10993-17, ICH M7指南)���,為每種物質建立安全的接觸限值(如PDE - 允許日暴露量)����。
結論: 比較“估計的患者暴露量”與“毒理學關注閾值”�。如果暴露量遠低于安全限值,則風險可接受����;如果接近或超過,則風險不可接受����。
方式:
目的: 最終證明器械在化學上是安全的�,其釋放的有害物質不會對患者造成不可接受的風險�。
總結:順序與邏輯
這個順序是不可顛倒的,因為它遵循了風險管理的邏輯:
源頭控制: 先確保原材料是安全的�。
過程控制: 再確保加工工藝不會引入不可控的風險。
終點驗證: 最后通過可瀝濾物研究來驗證���,盡管前兩步都做得很好�,但在最苛刻的臨床使用條件下,最終產(chǎn)品是否真的安全�。
整個評估過程都遵循ISO 10993(醫(yī)療器械的生物學評價)系列標準,特別是ISO 10993-18:2020《材料的化學表征》 和ISO 10993-17:2023《可瀝濾物允許限量的建立》���,這兩個標準為上述流程提供了詳細的框架和方法學指導。