本文通過“軟硬酸堿”的定義���、分類�����、作用規(guī)律��、應(yīng)用以及優(yōu)勢與局限性�����,系統(tǒng)性地介紹了“軟硬酸堿”理論���,讀者可通過本文加深對“軟硬酸堿”的理解���,并學(xué)習(xí)如何應(yīng)用“軟硬酸堿”理論對化學(xué)問題進(jìn)行探究。
一���、“軟硬酸堿”的定義
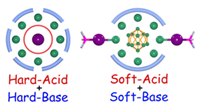
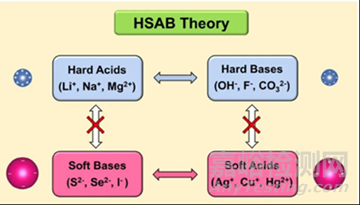
軟硬酸堿理論(Hard and Soft Acids and Bases��,簡稱HSAB理論)是由皮爾遜在20世紀(jì)60年代提出的化學(xué)理論���,核心是根據(jù)酸堿的“硬度”(Hardness)與“軟度”(Softness)分類,解釋和預(yù)測化合物的穩(wěn)定性��、反應(yīng)活性及化學(xué)鍵類型��,彌補(bǔ)了傳統(tǒng)酸堿理論在成鍵規(guī)律和反應(yīng)選擇性上的局限性���。
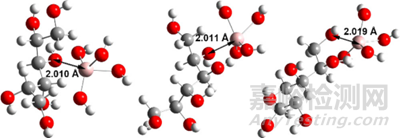
DOI: 10.1039/d3dt02387g
硬酸(Hard Acids)
硬酸的本質(zhì)是電子對接受體的“硬”�����,這源于電子云的“剛性”�����。硬酸的電子云難以被外界電場(如堿的孤對電子)極化�����,其成鍵時傾向于形成離子鍵或極性共價鍵��。
硬酸具有陽離子半徑小�����、電荷高��、極化性低等特點(diǎn)���,其價層電子被核緊緊束縛�����,不易給出或接受電子對��。
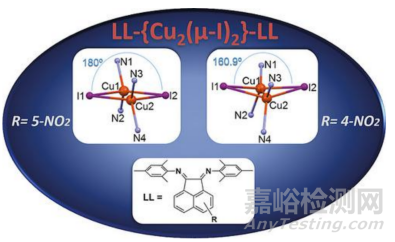
DOI: 10.1016/j.nanoen.2025.110714
軟酸(Soft Acids)
軟酸的本質(zhì)是電子對接受體的“軟”��,這一性質(zhì)來源于電子云的“柔性”���。軟酸的電子云易被堿的孤對電子極化,成鍵時傾向于形成共價鍵(尤其是配位共價鍵)���。
軟酸具有陽離子半徑大��、電荷低��、極化性高等特點(diǎn)��,其價層電子受核束縛弱��,電子云流動性強(qiáng)�����。
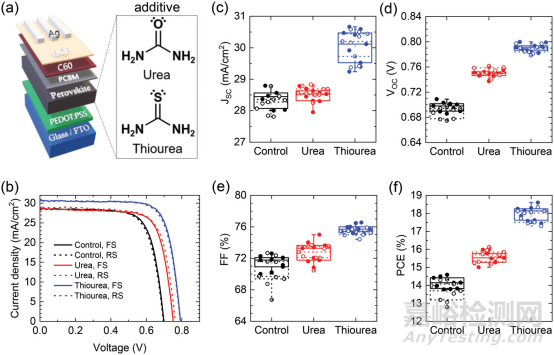
DOI: 10.1002/tcr.202300148
硬堿(Hard Bases)
硬堿的本質(zhì)是電子對給予體的“硬”�����,具體表現(xiàn)為硬堿孤對電子的“穩(wěn)定性”���。 硬堿的孤對電子不易被酸的正電荷極化���,成鍵時優(yōu)先與硬酸形成穩(wěn)定作用。
硬堿的特征包含陰離子半徑小���、電負(fù)性高�����、極化性低等���,其孤對電子被核緊緊束縛,給出電子對時選擇性強(qiáng)��。
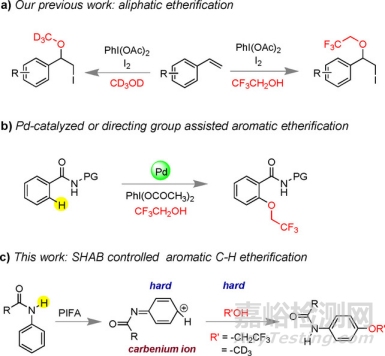
DOI:10.1016/S1386-1425(02)00230-5
軟堿(Soft Bases)
軟堿的本質(zhì)是電子對給予體的“軟”��,具體表現(xiàn)為軟堿孤對電子易被酸的正電荷極化�����,成鍵時優(yōu)先與硬酸形成穩(wěn)定作用��。
軟堿的特征包含陰離子半徑大��、電負(fù)性低、極化性高等��,其孤對電子受核束縛弱���,電子云易變形���,給出電子對的能力強(qiáng)���。
DOI: 10.1021/acs.cgd.6b01408
交界酸堿(BorderlineAcids/Bases)
其性質(zhì)介于硬酸堿與軟酸堿之間�����,極化性�����、電荷分布等參數(shù)處于中間范圍���,既能與硬酸堿作用,也能與軟酸堿作用��,穩(wěn)定性取決于具體體系�����。
例如,F(xiàn)e2+作為交界酸��,可與硬堿OH-形成Fe(OH)2沉淀���,也能與軟堿CN-形成穩(wěn)定的[Fe(CN)6]4-配離子�����;交界堿NO2-��,既可以和硬酸H+結(jié)合形成不穩(wěn)定的HNO2���,也能與軟酸Cu+形成配位能力較強(qiáng)的配合物。
這類酸堿的反應(yīng)選擇性相對較弱�����,需結(jié)合溶劑環(huán)境���、反應(yīng)溫度等條件綜合判斷其成鍵與反應(yīng)行為�����。
DOI: 10.1002/ejic.202000423
二���、軟硬酸堿的作用規(guī)律
1. 成鍵穩(wěn)定性
當(dāng)硬酸與硬堿結(jié)合時���,形成離子鍵或強(qiáng)極性共價鍵,化合物熱力學(xué)穩(wěn)定���、不易分解���;當(dāng)軟酸與軟堿結(jié)合時�����,形成共價鍵(或配位鍵)�����,電子云重疊程度高���,化合物動力學(xué)穩(wěn)定�����。
當(dāng)硬酸與軟堿�����、軟酸與硬堿結(jié)合時�����,形成的化合物穩(wěn)定性差��,易分解或發(fā)生配體取代反應(yīng)�����;當(dāng)交界酸堿結(jié)合時��,其穩(wěn)定性中等��,需結(jié)合溶劑���、溫度等具體環(huán)境判斷��,反應(yīng)選擇性較弱�����。
DOI: 10.1002/aenm.202202496
2. 反應(yīng)選擇性
反應(yīng)選擇性規(guī)律主要體現(xiàn)在兩方面:一方面���,競爭反應(yīng)中酸堿會優(yōu)先與“同類” 結(jié)合�����,例如硬酸H+在含F(xiàn)-(硬堿)和I-(軟堿)的混合體系中優(yōu)先與F-形成 HF�����,軟酸Ag+則優(yōu)先與I-形成AgI�����。
另一方面�����,配體取代反應(yīng)的方向呈現(xiàn)出明顯規(guī)律,硬酸的配合物中��,硬堿配體易被其他硬堿取代�����、軟堿配體難以取代,軟酸的配合物則相反���,如[Fe (H2O)6]3+(硬酸-硬堿)中��,H2O易被F-取代��、難被I-取代�����。
DOI: 10.1002/ajoc.201800069
3. 溶劑影響規(guī)律
硬溶劑(如H2O�����、甲醇)傾向于通過氫鍵或離子-偶極作用溶劑化硬酸堿��,降低其反應(yīng)活性�����;軟溶劑(如苯�����、四氯化碳)傾向于通過范德華力或疏水作用溶劑化軟酸堿��,降低其反應(yīng)活性���。
因此���,硬-硬反應(yīng)在軟溶劑中更易發(fā)生,軟-軟反應(yīng)在硬溶劑中更易發(fā)生�����,這是溶劑的“反同類”效應(yīng)在促進(jìn)反應(yīng)��。
DOI: 10.1039/D0CY02011G
三�����、應(yīng)用場景
化合物穩(wěn)定性與存在形式預(yù)測:軟硬酸堿理論可用于解釋自然界中礦物的存在形態(tài)��,如硬酸Ca2+���、Mg2+多與硬堿O2-、CO32-形成碳酸鹽�����、氧化物,軟酸Cu+��、Ag+多與軟堿 S2-形成硫化物���。
除此之外���,軟硬酸堿理論還能預(yù)測配合物穩(wěn)定性,判斷金屬離子與配體的結(jié)合能力�����,例如硬酸Al3+與硬堿EDTA形成穩(wěn)定配合物用于滴定分析���,軟酸Pt2+與軟堿CO���、CN-形成穩(wěn)定配合物用于催化反應(yīng)。
DOI: 10.1021/acsomega.2c01393
無機(jī)合成與分離提純:軟硬酸堿理論可指導(dǎo)合成路線設(shè)計�����,制備穩(wěn)定的軟酸-軟堿化合物時選擇軟堿配體��,制備硬酸-硬堿化合物時選擇硬堿原料(如合成AlF3時用HF而 HI);還能用于分離金屬離子��,利用軟硬酸堿的選擇性結(jié)合分離混合離子�����。
例如用Cl-(硬堿)分離硬酸Fe3+與軟酸Cu+��,F(xiàn)e3+與Cl-形成可溶性[FeCl6]3-�����,Cu+與Cl-形成難溶性CuCl沉淀��。
DOI: 10.1007/s40843-025-3591-6
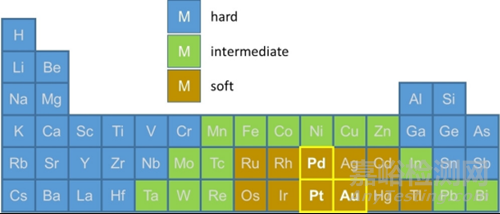
催化反應(yīng)機(jī)理闡釋:在催化領(lǐng)域���,多相催化中金屬催化劑的活性中心(如Pt��、Pd等軟酸)會與反應(yīng)物中的軟堿基團(tuán)(如烯烴的C=C鍵�����、CO的孤對電子)優(yōu)先結(jié)合�����,進(jìn)而活化反應(yīng)物分子�����,例如Pt催化烯烴加氫時�����,Pt2+與烯烴配位�����,降低加氫反應(yīng)的活化能��。
在均相催化中�����,配體的軟硬性質(zhì)可調(diào)控催化活性���,如軟堿配體與軟酸金屬中心結(jié)合,能增強(qiáng)催化劑對軟堿反應(yīng)物的選擇性��。
DOI: 10.1002/anie.202414721
四�����、理論優(yōu)勢與局限性
軟硬酸堿理論的優(yōu)勢在于其簡潔性與廣泛適用性。該理論無需復(fù)雜計算�����,僅通過酸堿的“軟”“硬”分類即可快速預(yù)測成鍵傾向與反應(yīng)趨勢���,有效彌補(bǔ)了路易斯理論僅區(qū)分酸堿而忽略類型差異的不足��。
同時�����,其應(yīng)用范圍廣�����,涵蓋無機(jī)���、有機(jī)、配位及生物化學(xué)等多個領(lǐng)域�����,能夠合理解釋離子鍵、共價鍵與配位鍵等多種鍵型的形成規(guī)律��。實(shí)用性強(qiáng)�����,能夠直接指導(dǎo)合成路徑設(shè)計��、分離方法開發(fā)�����、催化劑篩選以及藥物分子設(shè)計等工作�����,有助于降低實(shí)驗(yàn)探索成本��。
然而�����,軟硬酸堿理論也存在一定局限性���。首先���,該理論主要停留在定性層面,“硬度”與“軟度”缺乏嚴(yán)格的定量標(biāo)準(zhǔn)�����,其次該理論難以精確量化化合物的穩(wěn)定性與反應(yīng)速率�����,也未能充分考慮溫度�����、壓力��、溶劑極性等外部條件對反應(yīng)的影響���,因此在處理“軟硬交界”型體系時預(yù)測準(zhǔn)確性有限��。
此外�����,該理論主要聚焦于電子對的給予與接受���,對于涉及電子轉(zhuǎn)移的強(qiáng)氧化還原反應(yīng)��,其解釋力相對不足�����。
DOI:10.1021/acs.energyfuels.4c00817
總之��,本文介紹了什么是“軟硬酸堿”,“軟硬酸堿”是如何相互作用的���,以及“軟硬酸堿”的常用領(lǐng)域�����。通過該理論���,我們能夠解答廣泛的化學(xué)問題。