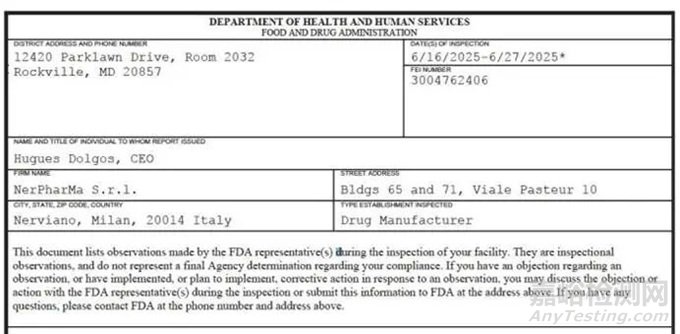
2025年06月16日至06月27日����,FDA對NerPharMa S.r.l.進行了一次為期近兩周的現(xiàn)場檢查。檢查結(jié)束后����,F(xiàn)DA向該公司簽發(fā)了一份長達13頁的FDA 483報告,詳細列出了八大類觀察項��,涉及無菌工藝驗證、環(huán)境監(jiān)控����、清潔消毒、調(diào)查系統(tǒng)�����、生產(chǎn)過程控制�����、質(zhì)量部門職責��、計算機系統(tǒng)管控及實驗室方法等多個關(guān)鍵質(zhì)量體系環(huán)節(jié)����。這些觀察項不僅暴露出該企業(yè)在無菌藥品生產(chǎn)質(zhì)量管理中的系統(tǒng)性漏洞,更對由其生產(chǎn)并已投放美國市場的注射劑藥品的安全性��、有效性及無菌保障提出了嚴峻質(zhì)疑��。
觀察項1:無菌工藝驗證存在嚴重缺陷��,缺乏對微生物污染的有效防控
該公司防止無菌藥品微生物污染的程序�����,在無菌工藝和滅菌過程的驗證方面不充分。首先����,按照公司程序TB021要求�����,無菌生產(chǎn)過程中固有的及糾正性的干預(yù)操作及其發(fā)生時間/持續(xù)時間��,并未在批生產(chǎn)記錄中始終如一地記錄�����。這意味著在日常生產(chǎn)中被執(zhí)行的����、具有最高次數(shù)和最長持續(xù)時間的干預(yù)操作,無法在培養(yǎng)基模擬灌裝試驗中得到準確模擬��,從而無法真實評估這些干預(yù)對無菌保證帶來的潛在風(fēng)險����。其次����,公司采用的培養(yǎng)基模擬灌裝試驗使用“分批次”方法����,即一部分單位被轉(zhuǎn)移至某處(以代表某一過程),而剩余部分則作為另一方式灌裝����,這種做法并不能代表常規(guī)生產(chǎn)操作,削弱了模擬試驗的可靠性����。再者,在無菌工藝模擬期間�����,程序要求模擬取樣時“不從灌裝線上取走任何西林瓶”��,然而在2023年12月及2024年進行的后續(xù)六次西林瓶灌裝線培養(yǎng)基灌裝中�����,為進行重量檢查而移除了西林瓶,導(dǎo)致部分培養(yǎng)基單位因被用于重量檢查而無法進行培養(yǎng)����,影響了模擬試驗的完整性。此外��,每次培養(yǎng)基灌裝中第一天和第二天最初灌裝的一定數(shù)量的西林瓶被取出用于無菌檢查����,這些西林瓶并未經(jīng)歷培養(yǎng)基灌裝所要求的倒置培養(yǎng)條件。尤為嚴重的是��,檢查人員審查了2024年針對西林瓶灌裝線進行的煙霧研究視頻��,視頻中觀察到了不良的無菌操作實踐����,并且煙霧研究未能提供單向氣流(首過氣流)始終得到維持的保證����。問題包括:對用于傳輸產(chǎn)品和所有無菌組件/附件的關(guān)鍵設(shè)備未進行煙霧研究;在操作過程中觀察到天花板HEPA過濾器下方金屬框架區(qū)域及擴展A級區(qū)域內(nèi)的上升氣流��;操作人員在移動西林瓶或處理卡住部件時��,用手、手臂或機械臂直接阻擋了首過氣流����,而受影響的西林瓶未被剔除。灌裝線在2024年進行了改造��,增加了新設(shè)備�����,但該設(shè)備的完整性測試程序未經(jīng)驗證以確保能充分檢測泄漏����、撕裂或缺陷;其泄漏測試儀的安裝��、運行��、性能確認均未完成�����;對該設(shè)備滅菌次數(shù)上限的設(shè)定缺乏驗證支持��,僅基于供應(yīng)商建議����;且每個設(shè)備缺乏唯一性標識以確?�?勺匪菪?���。最后����,檢查期間發(fā)現(xiàn)無菌操作人員佩戴的護目鏡存在多個孔洞,導(dǎo)致皮膚在灌裝線設(shè)置和無菌處理過程中暴露����,為污染物進入潔凈室環(huán)境提供了途徑。
觀察項2:環(huán)境監(jiān)控系統(tǒng)不完善��,無法確保無菌生產(chǎn)環(huán)境
該公司在無菌生產(chǎn)區(qū)域的環(huán)境條件監(jiān)控系統(tǒng)方面存在顯著不足�����。公司程序TF002要求對所有A級和B級區(qū)域回收的微生物鑒定至屬和種水平����。然而��,自2023年1月以來,在環(huán)境和人員監(jiān)控中從A級和B級區(qū)域回收的約457例微生物中��,僅有55例進行了鑒定�����,鑒定率僅為約12%�����,高達88%的微生物未被識別�����,這嚴重妨礙了對污染源的調(diào)查和糾正措施的制定����。此外,由于空間不足��,未在關(guān)鍵區(qū)域的A級西林瓶灌裝線內(nèi)進行主動空氣采樣��。非活性粒子監(jiān)測探頭也未放置在產(chǎn)品暴露的代表性A級位置�����,例如探頭距離某個站點和另一個站點過遠,而這些位置正是西林瓶等待傳輸?shù)年P(guān)鍵區(qū)域��。監(jiān)控點設(shè)置的不合理可能導(dǎo)致無法真實反映產(chǎn)品暴露點的空氣潔凈度�����。
觀察項3:清潔與消毒體系存在漏洞�����,難以保證無菌狀態(tài)
在保證無菌條件的清潔和消毒系統(tǒng)方面����,該公司同樣存在缺陷。首先是消毒劑效力研究不充分:研究未使用代表性微生物����,對于某些消毒劑,未評估革蘭氏陰性菌�����、酵母菌和孢子形成微生物��;對于另一種消毒劑�����,未評估革蘭氏陰性菌和酵母菌����。其次,未對A級灌裝線內(nèi)發(fā)現(xiàn)的特定表面材料進行消毒劑效力研究��。再者�����,對于A級西林瓶生產(chǎn)線及相鄰潔凈室的滅菌過程��,缺乏充分的驗證����。例如,生物指示劑和化學(xué)指示劑的放置位置并非基于風(fēng)險評估��,而是依據(jù)供應(yīng)商建議����;缺乏書面程序或記錄證明潔凈室在滅菌前已進行適當準備(如清潔、達到特定溫度和濕度要求)��。性能方面,對A級西林瓶灌裝線的消毒操作直到2024年7月5日才有記錄�����,無法保證此前進行了清潔����。記錄消毒的日志本未列出所使用的消毒劑。對于A/B級潔凈室和灌裝機的清潔記錄�����,未記錄消毒劑的接觸時間����,無法確保達到每種溶液所需的最短接觸時間。
觀察項4:偏差調(diào)查不及時不徹底�����,影響問題根本解決與批次質(zhì)量判定
該公司未能始終對無法解釋的差異以及批次或其組件不符合規(guī)格的情況進行書面調(diào)查記錄�����。具體表現(xiàn)為:針對A級和B級灌裝區(qū)微生物行動限超限發(fā)起的偏差未能及時關(guān)閉�����。例如��,2025年4月3日因B級區(qū)域沉降碟行動限超限開啟的偏差DP035/2025�����,由于其環(huán)境監(jiān)控樣品中回收的微生物未被鑒定�����,導(dǎo)致調(diào)查至今未完成��。另一例針對2025年4月4日B級區(qū)域沉降碟微生物警戒限超限的OOL(超限實驗室結(jié)果)�����,于2025年6月13日在未鑒定微生物的情況下關(guān)閉�����,后在FDA檢查期間(2025年6月23日)才將霉菌鑒定為諾氏青霉�����,但其他細菌仍未送檢鑒定。此外�����,某注射劑批次在可見異物檢查中����,主要類別缺陷的拒收率高達26.27%,遠超標準�����。公司僅對因產(chǎn)品在內(nèi)表面這一主要缺陷而被拒收的西林瓶進行了重新檢查����,并將部分西林瓶重新接受并放行至批次中,但偏差調(diào)查DP015/2025未說明為何未重新檢查最初可接受的西林瓶����,也未確定重新檢查是否應(yīng)采用新標準。該批次已被放行至美國市場�����。另外,針對某產(chǎn)品的三個批次超出規(guī)格(OOS)調(diào)查也未能及時關(guān)閉����,從開啟到關(guān)閉耗時長達數(shù)月��。
觀察項5:生產(chǎn)與過程控制程序不健全����,影響產(chǎn)品質(zhì)量一致性
該公司未能建立充分的書面生產(chǎn)和過程控制程序,以確保藥品具有其所聲稱的鑒別����、效價、純度和質(zhì)量����。主要體現(xiàn)在可見異物檢查人員的資格認證方面。用于認證的可見異物檢查工具包中西林瓶尺寸的選擇缺乏合理性論證����,例如,用于某種產(chǎn)品和某種西林瓶的認證工具包使用的毫升尺寸與實際生產(chǎn)的產(chǎn)品毫升尺寸不符�����;用于不同類型產(chǎn)品的認證工具包也存在類似尺寸不匹配的問題。更重要的是�����,這些工具包并未包含可見異物檢查中要求識別和拒收的所有缺陷類型����,例如,對于不同類型的產(chǎn)品�����,工具包中缺失了諸如關(guān)鍵缺陷(西林瓶不合格��、缺失密封件�����、缺失塞子等)和主要缺陷(空瓶�����、產(chǎn)品掛壁��、外部產(chǎn)品殘留�����、塞子臟污等)的代表性樣品。此外����,用于某種產(chǎn)品的可見異物檢查工具包不包含已知尺寸的顆粒、纖維和玻璃��。檢查人員的資格認證記錄也只記錄了缺陷類別�����,而未指明觀察到的具體缺陷是什么�����。
觀察項6:質(zhì)量部門職責履行不到位��,未能有效監(jiān)督與改進質(zhì)量體系
該公司質(zhì)量控制部門的職責和程序未得到充分書面規(guī)定和遵循��。質(zhì)量部門對記錄的審核未能確保報告數(shù)據(jù)的準確性����。例如�����,在某批次灌裝期間發(fā)生的一次干預(yù)操作記錄中,被識別為執(zhí)行干預(yù)的操作員與接受了所需A級更衣監(jiān)控的操作員并非同一人�����。此外��,在發(fā)生與可見異物檢查相關(guān)的偏差DP015/2025后��,未實施相應(yīng)的糾正與預(yù)防措施來更新某產(chǎn)品的可見異物檢查工具包�����,以包含代表“塞子上存在產(chǎn)品”這一主要缺陷的西林瓶����。
觀察項7:計算機系統(tǒng)控制不足,存在數(shù)據(jù)完整性風(fēng)險
該公司未對計算機及相關(guān)系統(tǒng)實施適當控制��,以確保主生產(chǎn)和控制記錄或其他記錄的變更僅由授權(quán)人員執(zhí)行��。生產(chǎn)和質(zhì)量部門在批放行或維護活動完成前��,未審核電子原始數(shù)據(jù)或?qū)徲嬜粉櫼源_保數(shù)據(jù)完整性����。例如��,操作員獲取并打印了某完整性測試的通過結(jié)果��,但未記錄或打印失敗結(jié)果�����。受影響的系統(tǒng)包括完整性測試儀�����、A級和B級集成環(huán)境監(jiān)測系統(tǒng)以及A級非活性粒子計數(shù)器。
觀察項8:實驗室控制方法不科學(xué)��,可能影響產(chǎn)品質(zhì)量判定
實驗室控制未能建立科學(xué)合理且適當?shù)娜佑媱澓蜏y試程序����,以確保組分和藥品符合相應(yīng)的鑒別、效價��、質(zhì)量和純度標準�����。具體而言,公司對成品進行的動態(tài)濁度法鱟試劑細菌內(nèi)毒素測試存在不足����。測試程序要求測試由多個容器組成的合并樣品,但SOP中的測試程序未允許根據(jù)樣品數(shù)量調(diào)整最大有效稀釋度(MVD)��。當前的MVD計算基于方法驗證時確定的單個成品容器�����,未能準確反映常規(guī)產(chǎn)品放行和穩(wěn)定性測試期間對合并樣品測試時的MVD�����。這種做法可能導(dǎo)致潛在的假陰性結(jié)果����,因為有可能將含有有害水平內(nèi)毒素的單位與含有較低、危害較小水平內(nèi)毒素的其他單位混合稀釋�����。公司管理層確認����,自質(zhì)量控制部門首次進行內(nèi)毒素測試以來�����,這一做法一直沿用�����。
這份FDA 483報告清晰地勾勒出NerPharMa在無菌藥品生產(chǎn)質(zhì)量管理系統(tǒng)上面臨的全面挑戰(zhàn)�����。從最核心的無菌保障工藝驗證��,到支持性的環(huán)境控制�����、清潔消毒,再到作為質(zhì)量保證基石的調(diào)查系統(tǒng)�����、過程控制�����、質(zhì)量監(jiān)督和數(shù)據(jù)完整性,均存在不同程度的不符合項��。這些缺陷若不能得到及時�����、徹底和系統(tǒng)的糾正����,不僅會直接影響其現(xiàn)有產(chǎn)品的市場供應(yīng),更會動搖監(jiān)管機構(gòu)和患者對其生產(chǎn)藥品安全性與有效性的根本信心�����。
參考資料:FDA官網(wǎng)����,https://www.fda.gov/media/189639/download.