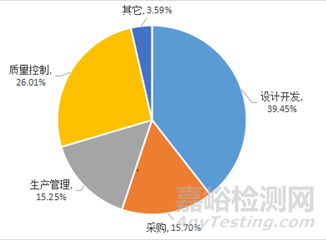
隨著貫徹落實(shí)國辦《關(guān)于全面深化藥品醫(yī)療器械監(jiān)管改革促進(jìn)醫(yī)藥產(chǎn)業(yè)高質(zhì)量發(fā)展的意見》和《2025年穩(wěn)外資行動(dòng)方案》的深入���,我國醫(yī)療器械行業(yè)的快速發(fā)展及政策環(huán)境的持續(xù)優(yōu)化��,越來越多的跨國企業(yè)選擇將進(jìn)口醫(yī)療器械轉(zhuǎn)移至中國境內(nèi)生產(chǎn)���。通過分析2025年上海市器審中心對(duì)進(jìn)口轉(zhuǎn)國產(chǎn)的有源醫(yī)療器械開展注冊(cè)現(xiàn)場核查的情況����,器審小編發(fā)現(xiàn)���,不符合項(xiàng)主要集中在設(shè)計(jì)開發(fā)�����、采購�、生產(chǎn)管理與質(zhì)量控制部分,合計(jì)占比96.41%�,如圖1所示。
圖1 進(jìn)口轉(zhuǎn)國產(chǎn)醫(yī)療器械注冊(cè)現(xiàn)場核查不符合項(xiàng)分布(有源)
常見問題 設(shè)計(jì)開發(fā)
1��、設(shè)計(jì)輸出:
(1)部分技術(shù)圖紙缺失��,如產(chǎn)品總裝圖����、電氣連接圖、電路原理圖等���;
(2)設(shè)計(jì)輸出的物料清單與產(chǎn)品樣機(jī)的實(shí)際組成不一致���;
(3)產(chǎn)品設(shè)計(jì)輸出的技術(shù)參數(shù)與產(chǎn)品技術(shù)要求不一致;
(4)產(chǎn)品說明書或軟件操作界面的相關(guān)內(nèi)容未轉(zhuǎn)換為中文���。
2�、設(shè)計(jì)轉(zhuǎn)移:
(1)產(chǎn)品由境外企業(yè)設(shè)計(jì)轉(zhuǎn)移而來����,但未與境外企業(yè)簽訂設(shè)計(jì)開發(fā)轉(zhuǎn)移協(xié)議;
(2)簽訂的轉(zhuǎn)移協(xié)議未明確轉(zhuǎn)移的技術(shù)文件清單和軟件版本信息�、未明確軟件的變更與維護(hù)、配置管理等相關(guān)的要求和責(zé)任���;
(3)簽訂的轉(zhuǎn)移協(xié)議明確了轉(zhuǎn)移產(chǎn)品設(shè)計(jì)輸入和輸出資料����,但現(xiàn)場未查見產(chǎn)品零部件圖紙�����、軟件安裝包等設(shè)計(jì)輸出文件�����。
3��、設(shè)計(jì)變更:
(1)境外企業(yè)已對(duì)軟件進(jìn)行了升級(jí)���,但現(xiàn)場查見企業(yè)未對(duì)軟件版本升級(jí)的具體內(nèi)容進(jìn)行識(shí)別�����、評(píng)審和風(fēng)險(xiǎn)分析���;
(2)產(chǎn)品技術(shù)要求的軟件版本編碼規(guī)則與境外企業(yè)的規(guī)定不一致����,且未查見明確的編碼對(duì)應(yīng)關(guān)系��。
4�、設(shè)計(jì)驗(yàn)證確認(rèn):
(1)生物相容性評(píng)價(jià)、產(chǎn)品有效期評(píng)價(jià)等直接使用境外企業(yè)的報(bào)告����,并未從原材料/關(guān)鍵部件及生產(chǎn)工藝等同性等方面對(duì)上述報(bào)告的適用性進(jìn)行評(píng)審;
(2)設(shè)計(jì)驗(yàn)證未考慮國內(nèi)相關(guān)強(qiáng)制性標(biāo)準(zhǔn)����;
(3)未對(duì)產(chǎn)品的全部工作模式進(jìn)行測試。
器審小編提示
設(shè)計(jì)開發(fā)是產(chǎn)品質(zhì)量的根源����,進(jìn)口轉(zhuǎn)國產(chǎn)醫(yī)療器械在設(shè)計(jì)開發(fā)方面的問題反映了轉(zhuǎn)產(chǎn)企業(yè)對(duì)境外原產(chǎn)企業(yè)的依賴性。建議境內(nèi)轉(zhuǎn)產(chǎn)企業(yè)健全設(shè)計(jì)開發(fā)體系�,系統(tǒng)全面地接收轉(zhuǎn)移技術(shù)文件,做好必要的驗(yàn)證確認(rèn)�,確保設(shè)計(jì)開發(fā)環(huán)節(jié)的實(shí)質(zhì)等同,并符合境內(nèi)法規(guī)要求和生產(chǎn)條件��。
常見問題 采購
1��、采購技術(shù)要求:未明確關(guān)鍵物料(例如馬達(dá)、傳感器等)的采購要求���,例如運(yùn)動(dòng)速率、精度�����、軟件版本����。
2、供應(yīng)商協(xié)議/采購合同:零部件均采購自境外企業(yè)�,但未能提供采購合同,或未與之簽訂質(zhì)量技術(shù)協(xié)議�����。
3�、進(jìn)貨檢驗(yàn)控制:(1)進(jìn)貨檢驗(yàn)記錄不規(guī)范,部分性能檢驗(yàn)項(xiàng)目未記錄實(shí)測數(shù)據(jù)����;(2)進(jìn)貨檢驗(yàn)規(guī)范中要求供應(yīng)商提供檢驗(yàn)報(bào)告,但并未明確需要確認(rèn)的性能指標(biāo)����。
器審小編提示
進(jìn)口醫(yī)療器械產(chǎn)品通常已建立較為成熟的供應(yīng)鏈體系�,進(jìn)口轉(zhuǎn)國產(chǎn)采購環(huán)節(jié)的挑戰(zhàn)在于供應(yīng)鏈的本地適配與合規(guī)轉(zhuǎn)換����。建議企業(yè)通過明確采購要求、簽訂責(zé)權(quán)清晰的質(zhì)量技術(shù)協(xié)議��、制訂科學(xué)合理的進(jìn)貨檢驗(yàn)規(guī)程等方式��,做好供應(yīng)商變更控制�����,確保采購物料質(zhì)量可控���。
常見問題 生產(chǎn)管理
1�、生產(chǎn)作業(yè)指導(dǎo)書:
(1)由境外企業(yè)的技術(shù)文件轉(zhuǎn)化而來�����,未清晰描述關(guān)鍵工序的操作(如校準(zhǔn)���、調(diào)試���、軟件燒錄等)����,缺乏指導(dǎo)性�;
(2)現(xiàn)場查見轉(zhuǎn)產(chǎn)后的生產(chǎn)作業(yè)指導(dǎo)書包含某工序,但實(shí)際生產(chǎn)過程并無上述工序�����,生產(chǎn)作業(yè)指導(dǎo)書與實(shí)際工序不符�。
2���、生產(chǎn)記錄:未記錄軟件版本�、關(guān)鍵部件(例如主板���、激光器等)的批號(hào)/編號(hào)�����、調(diào)試參數(shù)�����,生產(chǎn)記錄不完整��,軟件和關(guān)鍵部件無法追溯���。
器審小編提示
進(jìn)口轉(zhuǎn)國產(chǎn)醫(yī)療器械在生產(chǎn)管理方面的問題通常表現(xiàn)為技術(shù)文件與實(shí)際生產(chǎn)不符�、生產(chǎn)過程控制存在缺陷���。將境外生產(chǎn)工藝轉(zhuǎn)移到中國境內(nèi)時(shí)��,建議企業(yè)充分考慮法規(guī)��、人員����、設(shè)備�、環(huán)境的差異,開展工藝驗(yàn)證與確認(rèn)���,確保能夠有效指導(dǎo)實(shí)際轉(zhuǎn)產(chǎn)����。
常見問題 質(zhì)量控制
1、檢驗(yàn)規(guī)程:由境外企業(yè)的技術(shù)文件轉(zhuǎn)化而來�,但檢驗(yàn)規(guī)程未能覆蓋產(chǎn)品技術(shù)要求中的主要性能指標(biāo)(例如光學(xué)性能、電聲性能��、掃描精度等)�。
2、檢驗(yàn)方法:
(1)由境外企業(yè)的技術(shù)文件轉(zhuǎn)化而來�����,但具體檢驗(yàn)方法����、工具或體模與國內(nèi)標(biāo)準(zhǔn)存在差異��,企業(yè)未能提供檢驗(yàn)方法的等同性驗(yàn)證文件��;
(2)檢驗(yàn)工具(含軟件)由境外企業(yè)提供��,現(xiàn)場未查見檢驗(yàn)工具及軟件的確認(rèn)記錄����;
(3)檢驗(yàn)所用體模的計(jì)量證書由境外企業(yè)提供,未對(duì)檢驗(yàn)實(shí)際使用范圍進(jìn)行計(jì)量校準(zhǔn)�。
3、放行管理:轉(zhuǎn)產(chǎn)產(chǎn)品的型檢樣機(jī)的放行單與成品包裝記錄包含了未在申報(bào)注冊(cè)的產(chǎn)品結(jié)構(gòu)組成中的附件。
器審小編提示
醫(yī)療器械進(jìn)口轉(zhuǎn)國產(chǎn)并非“技術(shù)文件的翻譯轉(zhuǎn)移+場地變更”�,而是建立一套符合境內(nèi)法規(guī)、標(biāo)準(zhǔn)及本土條件的質(zhì)量管理體系�����。建議企業(yè)基于產(chǎn)品技術(shù)要求�����,全面梳理檢驗(yàn)規(guī)程(包括檢驗(yàn)工具及方法)����,確保轉(zhuǎn)產(chǎn)醫(yī)療器械產(chǎn)品的質(zhì)量可控。