NMPA《藥物非臨床藥代動力學研究技術(shù)指導原則》關(guān)于劑量選擇的建議是:動物體內(nèi)藥代動力學研究應設置至少三個劑量組���,低劑量與動物最低有效劑量基本一致,中��、高劑量按一定比例增加����。不同物種之間可根據(jù)體表面積或藥物暴露量進行劑量換算。
NMPA《藥物重復給藥毒性試驗技術(shù)指導原則》對于給藥劑量的要求是:重復給藥毒性試驗原則上至少應設低�、中、高 3個劑量組��,以及1個溶媒(或輔料)對照組,必要時設立空白對照組和/或陽性對照組����;高劑量原則上使動物產(chǎn)生明顯的毒性反應,低劑量原則上相當或高于動物藥效劑量或臨床使用劑量的等效劑量�,中劑量應結(jié)合毒性作用機制和特點在高劑量和低劑量之間設立,以考察毒性的劑量-反應關(guān)系���。
ICH M3(R2)認為如下四種劑量作為毒理研究高劑量均可以接受:1)MTD�;2)獲得足夠暴露倍數(shù)(≥50倍臨床暴露)的劑量��;3)暴露飽和劑量���;4)最大可行劑量(MFD)��。如果≥10倍臨床暴露且臨床日用量不到1g�����,則1000mg/kg/日可作為高劑量�����。其他情況不再贅述����。
ICH S6(R1)對于生物制品安全性評價高劑量選擇的要求:1)臨床前種屬預期最大藥理學作用的劑量;2)暴露量約為臨床最大暴露10倍的劑量�����。在臨床前毒性試驗中應該選擇上述兩種劑量中的較高者��,除非有合理的理由選用較低劑量(如最大的可行劑量)����。
ICH S3A毒代動力學指導原則指出:毒性試驗的劑量設置主要依據(jù)受試動物的毒理學發(fā)現(xiàn)和藥效反應確定���。下列毒代動力學原則將有助于劑量的設置:1)低劑量最好是無毒性反應劑量,任何毒性試驗中低劑量的動物暴露水平�,理想狀態(tài)下應等同或略高于患者擬用(或已知)的最高劑量。但該理想狀態(tài)并非總是可以達到��,故低劑量通常視毒理學考慮而定���。無論如何應進行全身暴露量測定���;2)中劑量的暴露通常是低劑量的適當倍數(shù)或高劑量的適當分數(shù)�����;3)高劑量通常依毒理學的要求而定�����,但所用劑量應達到可評價的暴露水平�。當毒代動力學數(shù)據(jù)表明化合物的吸收限制了原形化合物和/或代謝產(chǎn)物暴露��,且無其它劑量限制因素存在時�,化合物能達到最大暴露的最低劑量被視為可采用的最高劑量。
以上不難看出�����,對于毒理研究的高劑量�����,通常各個指南是比較重視的����,給出了詳細的規(guī)則和建議����。低劑量在ICH S3A和NMPA相關(guān)指南中也進行了約定���。低和高劑量設置完成后����,中劑量基本也就定了�。對于藥代動力學研究,則對低劑量設計有基本要求����,中高劑量要求比較模糊��。如果藥代動力學研究的低劑量與動物最低有效劑量基本一致����,中、高劑量按一定比例增加�����。而毒理研究的低劑量原則上相當或高于動物藥效劑量或臨床使用劑量(或患者擬用或已知最高劑量)的等效劑量��。那么藥代動力學研究的中高劑量和毒理研究的低劑量大概率就會交叉重疊。
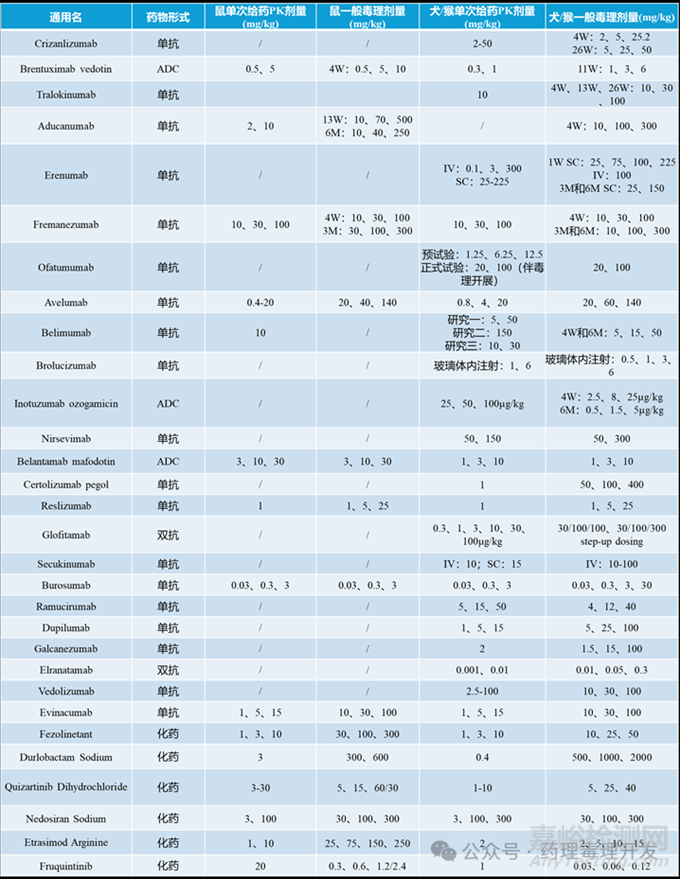
最近���,有群友聊到這個話題��,就翻了翻已經(jīng)上市的藥物��,找了大概30款藥物的臨床前PK和毒理研究的數(shù)據(jù)���,羅列如下,驗證下這一猜想�。那結(jié)論是不是我們想象中這樣呢?
有些藥物PK研究的高劑量與一般毒理研究的低劑量一致����,有些則介于一般毒理研究的低、中劑量之間���。這兩種情況應該占比最多�。也有些藥物的PK高劑量會超過毒理研究中劑量��,甚至達到或超過毒理高劑量的情況��。所以����,如前文所言��,PK研究的高劑量要求相對模糊�,上下浮動的空間比較大�����。對于一些安全窗比較小的藥物�����,比如表格中所列的兩款ADC藥物���,藥效劑量和毒理劑量沒有太大空間�����,就出現(xiàn)PK劑量設計和毒理劑量一致,甚至比毒理劑量更高的情況�����。畢竟���,PK研究為單次給藥����,動物耐受要強于重復給藥毒理研究。
總之���,建議先設計好毒理研究的高劑量�����,并根據(jù)動物藥效或臨床等效劑量或其它科學合理的依據(jù)歸置好PK和毒理研究的低劑量����,其它劑量則留有一定的靈活探索空間�。通常PK劑量會與毒理劑量接壤,就看互相“侵占”的比例有多大�����。