01、近五年藥品注冊(cè)申請(qǐng)審評(píng)及未獲批準(zhǔn)數(shù)據(jù)分析
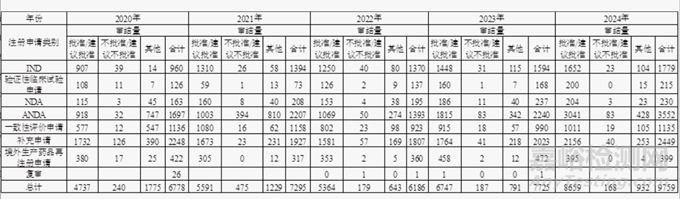
近五年需CDE開(kāi)展技術(shù)審評(píng)的化學(xué)藥品注冊(cè)申請(qǐng)審結(jié)件數(shù)呈明顯的增長(zhǎng)趨勢(shì)�,具體審評(píng)情況見(jiàn)表1。
▲表1-近五年需技術(shù)審評(píng)的化學(xué)藥品注冊(cè)申請(qǐng)審結(jié)情況(件)
注1:2020年“其他”是指申請(qǐng)人主動(dòng)申請(qǐng)撤回�、完成審評(píng)等待申請(qǐng)人補(bǔ)充完善申報(bào)資料的注冊(cè)申請(qǐng)等。
注2:2021年~2024 “其他 ”是指申請(qǐng)人未按規(guī)定繳納費(fèi)用����、撤回申請(qǐng)等原因?qū)е聦徳u(píng)審批終止的情形。
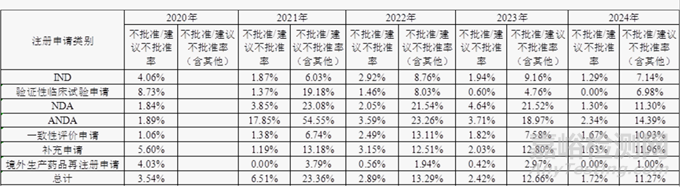
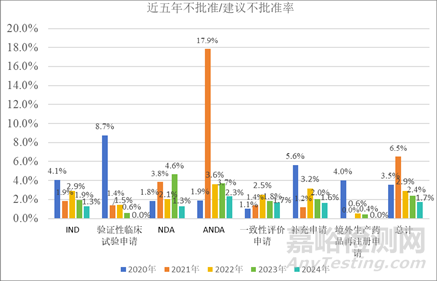
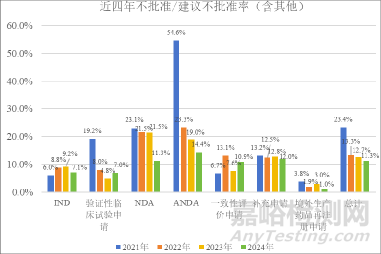
近五年需技術(shù)審評(píng)的化學(xué)藥品注冊(cè)申請(qǐng)不批準(zhǔn)/建議不批準(zhǔn)率整體呈波動(dòng)趨勢(shì)�,分別為3.54%、6.51%����、2.89%���、2.42%和1.72%,考慮到申請(qǐng)人主動(dòng)撤回申請(qǐng)?jiān)谀撤N意義上也是不批準(zhǔn)的一種形式���,因此同步將不批準(zhǔn)/建議不批準(zhǔn)率(含其他)也進(jìn)行了統(tǒng)計(jì)���,分別為23.36%、13.29%����、12.66%和11.27%,這一數(shù)據(jù)表明目前不批準(zhǔn)率還是比較高的�,詳細(xì)數(shù)據(jù)見(jiàn)表2、圖1和圖2�。
▲表2-近五年需技術(shù)審評(píng)的化學(xué)藥品注冊(cè)申請(qǐng)不批準(zhǔn)/不建議批準(zhǔn)率
注:2020年“其他”包括完成審評(píng)等待申請(qǐng)人補(bǔ)充完善申報(bào)資料的注冊(cè)申請(qǐng)的情形,因此未統(tǒng)計(jì)2020年“不批準(zhǔn)/建議不批準(zhǔn)率(含其他)�。
▲圖1 -近五年不批準(zhǔn)/建議不批準(zhǔn)率
▲圖2-近五年不批準(zhǔn)/建議不批準(zhǔn)率(含其他)
02、藥品注冊(cè)申請(qǐng)未獲批準(zhǔn)原因分析
1.行政管理方面
(1)未開(kāi)展溝通交流
①未溝通交流致使申報(bào)后發(fā)現(xiàn)研究信息嚴(yán)重缺項(xiàng)�,無(wú)法在發(fā)補(bǔ)時(shí)限內(nèi)完成補(bǔ)充研究;②未按溝通交流時(shí)監(jiān)管方提出的要求和標(biāo)準(zhǔn)提供研究數(shù)據(jù)或補(bǔ)充完善研究項(xiàng)目����。
(2)參比制劑選擇不當(dāng)
①未采用國(guó)家藥品監(jiān)督管理局發(fā)布的《化學(xué)仿制藥參比制劑目錄》中的產(chǎn)品為參比制劑或者選用的對(duì)照制劑的商品名���、持證商等信息與目錄不一致;
②參比制劑已撤市����,且已有更新?lián)Q代安全性更好的產(chǎn)品滿足臨床需求�。
(3)藥品注冊(cè)核查結(jié)果不符合規(guī)定
①注冊(cè)核查中發(fā)現(xiàn)研究數(shù)據(jù)存在真實(shí)性問(wèn)題;
②注冊(cè)核查中發(fā)現(xiàn)其他影響產(chǎn)品質(zhì)量的重大缺陷����。
(4)藥品注冊(cè)檢驗(yàn)結(jié)果不符合規(guī)定
①樣品復(fù)核檢驗(yàn)不符合規(guī)定或分析方法存在嚴(yán)重缺陷;
②注冊(cè)核查抽樣檢驗(yàn)不合格�。
(5)化學(xué)仿制藥選用的原料藥存在問(wèn)題未能獲準(zhǔn)備案上市
(6)審評(píng)中發(fā)現(xiàn)研究?jī)?nèi)容缺項(xiàng),無(wú)法支持注冊(cè)申請(qǐng)事項(xiàng)
(7)未能在規(guī)定期限內(nèi)繳納注冊(cè)費(fèi)用
(8)未能在規(guī)定時(shí)限內(nèi)補(bǔ)充資料
2021年����,藥品注冊(cè)申請(qǐng),化藥有475件不批準(zhǔn)/建議不批準(zhǔn)����,其中349件因申請(qǐng)人未能在規(guī)定時(shí)限內(nèi)補(bǔ)充資料的情形,占全年化藥不批準(zhǔn)/建議不批準(zhǔn)總量的73.5%�。
2.安全性
(1)早期(IND階段)研究結(jié)果提示毒性明顯或者安全窗過(guò)于狹窄,不宜進(jìn)行臨床人體試驗(yàn)或提示應(yīng)用于臨床可能綜合獲益非常有限���;
(2)臨床前安全性研究方法或研究質(zhì)量控制問(wèn)題���,或者研究數(shù)據(jù)不充分���,無(wú)法獲得充分的安全性信息以保障后續(xù)臨床試驗(yàn)受試者的安全;
(3)已有的臨床研究數(shù)據(jù)顯示存在嚴(yán)重不良反應(yīng)���,臨床應(yīng)用獲益和風(fēng)險(xiǎn)比值不合理���;
(4)化學(xué)藥注冊(cè)分類第3類的上市注冊(cè)申請(qǐng)缺乏境內(nèi)安全性臨床數(shù)據(jù)。
3.有效性
(1)立題依據(jù)不足
①藥物研發(fā)的臨床定位不清���,適應(yīng)癥����、劑型或給藥途徑選擇不合理���;
②已有的研究數(shù)據(jù)不支持已上市品種的改良開(kāi)發(fā)����,即改良型新藥開(kāi)發(fā)立項(xiàng)無(wú)法體現(xiàn)臨床價(jià)值優(yōu)勢(shì)����;
③聯(lián)合用藥或復(fù)方制劑違背臨床診療和用藥原則�,或缺乏有效性和安全性研究數(shù)據(jù)支持���;
④參比制劑選擇不當(dāng)���。
A. 參比制劑因安全有效性問(wèn)題已撤市�;
B. 參比制劑適應(yīng)癥、用法用量�、規(guī)格等不符合國(guó)內(nèi)臨床用藥實(shí)際。
(2)有效性方面存在問(wèn)題
①已有的臨床研究數(shù)據(jù)尚無(wú)法證明品種的有效性����;
A.已有研究數(shù)據(jù)提示藥效作用不明顯,作用靶點(diǎn)和機(jī)制不清晰���,成藥性風(fēng)險(xiǎn)高����;
例如:創(chuàng)新藥臨床前藥效學(xué)和藥理機(jī)制研究結(jié)果未能提示有效性價(jià)值�,或不足以支持進(jìn)入臨床試驗(yàn)。
B.已開(kāi)展的臨床研究存在試驗(yàn)方案或者研究質(zhì)量控制問(wèn)題���,無(wú)法評(píng)價(jià)受試品種的有效性;
C.人體生物等效性試驗(yàn)結(jié)果表明不等效�;
D.已有研究數(shù)據(jù)不符合生物等效性接受標(biāo)準(zhǔn),或者因?yàn)樯锏刃栽囼?yàn)方法問(wèn)題�,無(wú)法證明其和參比制劑的療效一致性;
E.化學(xué)藥注冊(cè)分類第3類的上市注冊(cè)申請(qǐng)缺乏境內(nèi)有效性臨床數(shù)據(jù)�。
②臨床開(kāi)發(fā)定位違背臨床診療、用藥的基本原則����。
(3)申報(bào)資料不足以支持開(kāi)展藥物臨床試驗(yàn)或者不能保障臨床受試者安全
①已有的藥學(xué)、臨床前研究不符合臨床試驗(yàn)要求���;
②臨床試驗(yàn)方案整體設(shè)計(jì)嚴(yán)重缺陷���,風(fēng)險(xiǎn)控制措施不足;
例如:關(guān)鍵臨床研究設(shè)計(jì)存在重大缺陷�,無(wú)法得出客觀、有力的有效性���、安全性證據(jù)�。
③聯(lián)合用藥的非臨床研究數(shù)據(jù)不充分�。
4.質(zhì)量可控性
(1)仿制藥的參比制劑已撤市,且已有更新?lián)Q代安全性更好的產(chǎn)品滿足臨床需求
(2)制劑處方工藝等藥學(xué)研究?jī)?nèi)容存在嚴(yán)重缺陷���,無(wú)法證明仿制藥與參比制劑一致性�;
例如外用化學(xué)藥品仿制制劑處方(Q1和/或Q2)、關(guān)鍵質(zhì)量屬性(Q3)等與參比制劑不一致問(wèn)題等���;
(3)研究質(zhì)量控制和管理存在缺陷����,導(dǎo)致已有的研究結(jié)果不能證明藥品安全性���、有效性和質(zhì)量可控性;
(4)樣品穩(wěn)定性研究結(jié)果不符合仿制藥上市技術(shù)要求�;
(5)各開(kāi)發(fā)階段的研究受試樣品不一致;
(6)申報(bào)資料無(wú)法證明仿制藥與參比制的質(zhì)量一致性�;
(7)未按補(bǔ)充資料通知要求開(kāi)展補(bǔ)充研究或完善研究資料;
(8)原料藥起始物料選擇�、合成步驟、質(zhì)量控制標(biāo)準(zhǔn)等不符合仿制藥上市技術(shù)要求�;
(9)仿制藥未按規(guī)定使用具有合法來(lái)源的原料藥;
(10)化學(xué)仿制藥選用的原料藥存在問(wèn)題未能獲準(zhǔn)備案上市����;
(11)研究結(jié)果不能保證變更后產(chǎn)品的安全性、有效性和質(zhì)量可控性
①申請(qǐng)資料未能充分說(shuō)明變更的科學(xué)性和合理性���,不足以支持變更事項(xiàng)����,或者補(bǔ)充申請(qǐng)變更事項(xiàng)不符合相關(guān)法律法規(guī)規(guī)章和技術(shù)要求;
②變更引起藥用物質(zhì)基礎(chǔ)發(fā)生重大改變�;
③藥品說(shuō)明書(shū)修改申請(qǐng)不符合說(shuō)明書(shū)撰寫(xiě)的技術(shù)要求;
④用于支持變更的文獻(xiàn)資料存在偏倚����,或者臨床安全性和有效性數(shù)據(jù)不充分。
03�、啟示和建議
1.充分重視藥物開(kāi)發(fā)立題依據(jù)
藥物開(kāi)發(fā)應(yīng)立足于臨床需求,尤其應(yīng)重視解決未被滿足的臨床需求問(wèn)題�,充分重視同類創(chuàng)新藥開(kāi)發(fā)的優(yōu)勢(shì)問(wèn)題,避免群體化���、低水平����、重復(fù)性創(chuàng)新����;應(yīng)充分評(píng)估改良型新藥的臨床價(jià)值和優(yōu)勢(shì),不應(yīng)純粹為了“改”而改;變更補(bǔ)充申請(qǐng)應(yīng)遵循變更的科學(xué)性����、必要性與合理性原則等。
2.建立并堅(jiān)持創(chuàng)新藥研發(fā)的科學(xué)邏輯
某些新機(jī)制���、新技術(shù)���、新靶點(diǎn)、新分子宜做充分的成藥性評(píng)估����,開(kāi)展盡可能多的概念驗(yàn)證研究,以降低后續(xù)開(kāi)發(fā)風(fēng)險(xiǎn)�,以免造成研究資源浪費(fèi);創(chuàng)新藥商業(yè)開(kāi)發(fā)策略應(yīng)建立在科學(xué)性基礎(chǔ)上�,遵循藥物開(kāi)發(fā)的科學(xué)邏輯���,重視成藥性證據(jù)鏈的完整���,盡量減少非科學(xué)因素對(duì)開(kāi)發(fā)進(jìn)程的干擾。
3.深入挖掘和擴(kuò)展溝通交流機(jī)制優(yōu)勢(shì)
在已有的溝通交流機(jī)制下���,申請(qǐng)人除了在藥物開(kāi)發(fā)過(guò)程的各關(guān)鍵節(jié)點(diǎn)提出溝通交流申請(qǐng)����,還可以加強(qiáng)在研發(fā)其他環(huán)節(jié)和審評(píng)審批過(guò)程中的溝通交流(例如發(fā)補(bǔ)前問(wèn)詢及發(fā)補(bǔ)后問(wèn)詢);對(duì)于溝通交流達(dá)成的共識(shí)�,申請(qǐng)人應(yīng)予以充分遵循。
4.加強(qiáng)對(duì)法律法規(guī)規(guī)章和技術(shù)指導(dǎo)原則的研讀
通過(guò)研讀����、掌握法律法規(guī)規(guī)章及監(jiān)管機(jī)構(gòu)發(fā)布的重要文件,可以進(jìn)一步掌握行業(yè)戰(zhàn)略層面的鼓勵(lì)方向和當(dāng)前藥品注冊(cè)管理的政策紅利���,進(jìn)而為藥品注冊(cè)研發(fā)指明方向���。隨著藥品審評(píng)審批制度改革的深入,相關(guān)法律法規(guī)規(guī)章和技術(shù)標(biāo)準(zhǔn)也在逐步細(xì)化和完善����。此外,申請(qǐng)人可充分學(xué)習(xí)監(jiān)管部門(mén)舉辦研討培訓(xùn)會(huì)議���。
5. 結(jié)合研究數(shù)據(jù)充分評(píng)估藥品注冊(cè)和變更的風(fēng)險(xiǎn)���,充分理解Q1���、Q2、Q3的要求����,嚴(yán)格貫徹自研制劑質(zhì)量不低于參比制劑,變更后的產(chǎn)品質(zhì)量與變更前相當(dāng)���,尤其是不得出現(xiàn)超鑒定限的未知雜質(zhì)等���。
【參考文獻(xiàn)】
1.2020年度藥品審評(píng)報(bào)告
2.2021年度藥品審評(píng)報(bào)告
3.2022年度藥品審評(píng)報(bào)告
4.2023年度藥品審評(píng)報(bào)告
5.2024年度藥品審評(píng)報(bào)告
6.藥品注冊(cè)管理辦法