【摘要】目的 分析國內(nèi)外藥品上市后變更管理現(xiàn)狀,為我國藥品上市后變更研究及管理提供參考����。方法 對比分析美國����、歐洲����、中國的藥品上市后變更制度及國際人用藥品注冊技術(shù)協(xié)調(diào)會(ICH)《Q12:藥品生命周期管理的技術(shù)和監(jiān)管考慮》相關(guān)內(nèi)容,并結(jié)合國內(nèi)監(jiān)管要求和行業(yè)實(shí)際進(jìn)行思考����。結(jié)果 我國藥品變更管理框架基本完善,但由于變更情形的復(fù)雜性����,上市后變更監(jiān)管存在多個(gè)主體����、各省行業(yè)水平存在差異等問題,我國上市后變更研究及管理工作可進(jìn)一步完善����。結(jié)論 建議各級藥監(jiān)部門和產(chǎn)業(yè)界通力協(xié)作����,通過加強(qiáng)藥品的全生命周期管理����、統(tǒng)一各級藥監(jiān)部門的變更管理標(biāo)準(zhǔn)����、加強(qiáng)藥品上市許可持有人的變更管理能力等措施,共同促進(jìn)我國藥品上市后變更管理工作水平的提升����。
【關(guān)鍵詞】藥品上市后變更����;ICH Q12;風(fēng)險(xiǎn)監(jiān)管理念����;藥品全生命周期����;藥品上市許可持有人
從藥物研發(fā)����、上市申請����、商業(yè)化生產(chǎn)到產(chǎn)品退市,藥品全生命周期的各個(gè)階段都伴隨著變更����。藥品獲批上市后,隨著藥品上市許可持有人(以下簡稱“持有人”)對產(chǎn)品的認(rèn)識逐步加深����、制藥技術(shù)進(jìn)步,及商業(yè)化策略調(diào)整����、監(jiān)管政策變化等眾多因素的影響����,藥品的原輔料供應(yīng)����、處方工藝和質(zhì)量控制等方面不可避免產(chǎn)生不同程度的變更����。藥品上市后變更是各國藥監(jiān)機(jī)構(gòu)的監(jiān)管重點(diǎn),鼓勵(lì)持有人運(yùn)用新生產(chǎn)技術(shù)����、新方法����、新設(shè)備����、新科技成果,不斷改進(jìn)和優(yōu)化生產(chǎn)工藝����,持續(xù)提高藥品質(zhì)量����,提升藥品安全性、有效性和質(zhì)量可控性[1]����。
多年來,國外監(jiān)管機(jī)構(gòu)[如美國食品藥品監(jiān)督管理局(FDA)����、歐洲藥品管理局(EMA)等]上市后變更管理均采取基于風(fēng)險(xiǎn)的管理理念����,依據(jù)變更風(fēng)險(xiǎn)高低采取不同監(jiān)管模式,重點(diǎn)監(jiān)管高風(fēng)險(xiǎn)變更����,對于低風(fēng)險(xiǎn)變更相應(yīng)減少監(jiān)管資源����。早在 2003 年,國際人用藥品注冊技術(shù)協(xié)調(diào)會(ICH)提出要建立貫穿于產(chǎn)品全生命周期統(tǒng)一的質(zhì)量體系����,并強(qiáng)調(diào)采用質(zhì)量風(fēng)險(xiǎn)管理理念和科學(xué)的綜合方法[2]����,前期頒布的《Q8(R2):藥品研發(fā)》《Q11:原料藥開發(fā)和生產(chǎn)》(化學(xué)實(shí)體和生物技術(shù)/生物實(shí)體藥物)指南主要關(guān)注產(chǎn)品的研發(fā)階段,2019 年 11 月 20 日����,《Q12:藥品生命周期管理的技術(shù)和監(jiān)管考慮》指南及其附件正式發(fā)布實(shí)施[3]����,該指南聚焦于產(chǎn)品生命周期的商業(yè)化階段,指出協(xié)調(diào)統(tǒng)一生命周期管理技術(shù)和法規(guī)考慮將促進(jìn)制藥行業(yè)的創(chuàng)新及持續(xù)改進(jìn)����、加強(qiáng)質(zhì)量保證和改善藥品供應(yīng)����,從而使患者����、行業(yè)和監(jiān)管機(jī)構(gòu)從中受益����,并推薦基于風(fēng)險(xiǎn)對上市后變更進(jìn)行分類管理。
01國際藥品上市后變更管理現(xiàn)狀
1.1 FDA 上市后變更管理
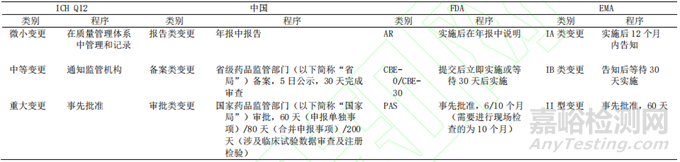
美國《聯(lián)邦食品����、藥品和化妝品法》(Federal Food, Drug, And Cosmetic Act����,F(xiàn)D&CA)第 506a 章節(jié)中(356a)規(guī)定,以風(fēng)險(xiǎn)為依據(jù)劃分生產(chǎn)變更事項(xiàng)風(fēng)險(xiǎn)級別����,并提交不同的變更申請[4]����。聯(lián)邦法規(guī)第 21卷(21CFR)第 314.70 章節(jié)中����,按照變更對藥品特性����、劑量、質(zhì)量����、純度或效價(jià)的影響����,將上市后變更的級別劃分為重大變更(Major Changes)、中等變更(Moderate Changes)和微小變更(Minor Changes)[5]����。
重大變更,需事先審批后才能實(shí)施����,持有人提交批準(zhǔn)后變更的補(bǔ)充申請(Prior Approval Supplement����,PAS)����,一般審評時(shí)限為 6 個(gè)月����,涉及批準(zhǔn)前檢查的情況時(shí)限可能需要 10 個(gè)月����,符合相關(guān)要求的可能會加速審評。中等變更分為 2 種情況����,包括 30 天后生效的補(bǔ)充申請(Changes Being Effected in 30 Days, CBE-30)和立即生效的變更申請(Changes Being Effected, CBE-0)。CBE-30 中 FDA 會在 30 天內(nèi)進(jìn)行審查����,以確定該申請是否需要升級為重大變更或是否需要補(bǔ)充資料����,若提交后 30 天內(nèi) FDA 無異議則可實(shí)施變更;CBE-0 中提交后可立即實(shí)施����,如果 FDA 后續(xù)不批準(zhǔn)該變更����,持有人應(yīng)立即停止該產(chǎn)品的上市����。微小變更可直接實(shí)施后在年報(bào)(Annual Report����,AR)中說明[5]。
FDA 針對上市后變更發(fā)布多項(xiàng)指南及問答文件����,包括已獲批新藥申請(New Drug Application, NDA)或簡略新藥申請(Abbreviated New Drug Application, ANDA)、原料藥批準(zhǔn)后變更草案(Post approval Changes to Drug Substances����,Draft Guidance)����、年報(bào)文件中報(bào)告的批準(zhǔn)后生產(chǎn)變更(CMC Postapproval Manufacturing Changes To Be Documented in Annual Reports),及針對不同劑型的擴(kuò)大規(guī)模和上市后變更(Scale-Up and Post-Approval Changes,SUPAC)指南及其問答文件等����,各指南中針對不同變更類型列出相應(yīng)的研究工作����。
1.2 EMA 上市后變更管理
EMA 法規(guī)(EC)No 1234/2008[6]根據(jù)風(fēng)險(xiǎn)將藥品上市后變更分為一般變更(Minor Variations����,Type I)和重大變更(Major Variations����,Type II)。I 類變更包括 IA 和 IB 類����,對于 IA 類變更����,一般情況下需變更實(shí)施后的 12 個(gè)月內(nèi)告知監(jiān)管機(jī)構(gòu)����,監(jiān)管機(jī)構(gòu)收到通知 30 天內(nèi)應(yīng)通知持有人和其他有關(guān)部門該變更是否被接受或拒絕,但某些需持續(xù)監(jiān)管的藥品的 IA 類變更需實(shí)施后立即告知監(jiān)管機(jī)構(gòu)����;IB 類變更����,需實(shí)施前告知監(jiān)管機(jī)構(gòu)����,若 EMA 在 30 天內(nèi)不發(fā)表異議即可實(shí)行;II 類變更����,需事先經(jīng) EMA 批準(zhǔn)才可實(shí)施,一般審評時(shí)限為 60 天����。除 I 類和 II 類變更外,歐盟還明確擴(kuò)展(Extensions)和緊急安全性限制(Urgent Safety Restrictions)等變更情形[6]����,擴(kuò)展情形包括活性物質(zhì)的變更(如采用相應(yīng)的鹽/酯復(fù)合物/衍生物替代原化學(xué)活性物質(zhì)����、用不同異構(gòu)體或異構(gòu)體不同混合物代替混合物中的分離異構(gòu)體等)、規(guī)格變更����、劑型變更或給藥途徑變更等����;緊急安全性限制情形是指持有人或監(jiān)管機(jī)構(gòu)對威脅公眾健康事件采取的立即變更程序����。
對于變更分類及審查程序、應(yīng)提交的支持性研究資料及遞交程序等內(nèi)容在配套變更技術(shù)指南(Guidelines on the Details of the Various Categories of Variations)[7]中進(jìn)行明確����,2024 年 6月 13 日����,EMA 發(fā)布該變更技術(shù)指南的修訂稿[8](2024 年8月23日結(jié)束征求意見,目前尚未轉(zhuǎn)為正式稿)����,本次修訂將變更指南的范圍限定于人用藥物(上一版本同時(shí)包括人用藥物和獸用藥)����,變更分類保持不變����,部分內(nèi)容移動到其他相關(guān)指南中進(jìn)一步明確����,增加監(jiān)管工具的程序細(xì)節(jié),同時(shí)根據(jù)所獲得的經(jīng)驗(yàn)或知識����,增加部分條款并對部分技術(shù)細(xì)節(jié)進(jìn)行修訂。
1.3 ICH Q12 相關(guān)情況
1.3.1 Q12 內(nèi)容簡介
ICH Q12[3]建立在 ICH Q8~Q11 良好實(shí)施的基礎(chǔ)上����,主要關(guān)注藥品全生命周期的商業(yè)化階段����,該指南適用于已上市的原料藥和制劑����,及符合藥品或生物制品定義的藥械組合產(chǎn)品。ICH 期望持有人建立良好的質(zhì)量管理體系����、并對產(chǎn)品有深入了解����,可通過 Q12 提出的管理工具����,包括批準(zhǔn)后 CMC(Chemistry, Manufacturing and Controls)變更的分類、既定條件(ECs)����、批準(zhǔn)后變更管理方案(PACMP)����、藥品生命周期管理(PLCM)文件等����,為持有人和監(jiān)管機(jī)構(gòu)提供一個(gè)協(xié)調(diào)統(tǒng)一的風(fēng)險(xiǎn)控制框架,從而以更具預(yù)測性和更有效的方式加強(qiáng)批準(zhǔn)后 CMC 變更的管理����。
1.3.2 FDA����、EMA 及我國實(shí)施 ICH Q12 情況簡介
FDA 鼓勵(lì)企業(yè)使用 ICH Q12 指導(dǎo)變更����,其現(xiàn)行變更法規(guī)與Q12 理念較為一致。FDA 于 2021 年發(fā)布《ICH Q12: Implementation Considerations for FDA-Regulated Products(Draft Guidance for Industry)》[9]����,明確如何在美國監(jiān)管體系下使用 Q12 管理工具,為實(shí)施Q12 提供可操作性的指導(dǎo)����;隨后 2022 年發(fā)布《NDA����、ANDA 或 BLA 批準(zhǔn)后 CMC 變更的可比性方案:Comparability Protocols for Postapproval Changes to the Chemistry, Manufacturing, and Controls Information in an NDA, ANDA, or BLA(Guidance for Industry)》[10]����,該指南為 ICH Q12 的管理工具之一(即 PACMP)在美國的落地實(shí)施文件,明確實(shí)施可比性方案(Comparability Protocols)的操作細(xì)節(jié)����。
歐盟(EU)作為 ICH 重要成員國之一����,Q12 中的某些原則與 EMA 法規(guī)基本一致����,EU 在采納 Q12 時(shí)發(fā)布《Note on EU Implementation of ICH Q12》[11],對 Q12 和 EMA 現(xiàn)有法規(guī)的協(xié)同情況進(jìn)行說明����,說明中提及 Q12 中的部分管理工具����,如藥品質(zhì)量體系(Pharmaceutical Quality System, PQS)及 PACMP 已在 EU 內(nèi)施行����,但 Q12 與 EU 法規(guī)也有概念差異的部分����,如 ECs 和 PLCM 文件,這些差異會影響 Q12 在 EU 的全面實(shí)施和監(jiān)管靈活性����,但歐盟委員會(EC)連同 EMA 及各成員國監(jiān)管機(jī)構(gòu),會持續(xù)致力于在現(xiàn)有的 EU 法規(guī)體系下實(shí)施 Q12����。
我國國家藥品監(jiān)督管理局(NMPA)于 2023 年 8 月 25 日發(fā)布公告實(shí)施 ICH Q12(2023 年第 108 號)[12]����,明確申請人可按照目前國內(nèi)變更管理體系或采用 Q12 提供的新方法進(jìn)行變更管理,實(shí)施 Q12 前申請人應(yīng)充4 / 8分評估是否具備適用該指導(dǎo)原則的研發(fā)基礎(chǔ)和實(shí)施條件����,Q12 指南的實(shí)施設(shè)置 24 個(gè)月過渡期����,過渡期內(nèi)采用 Q12 進(jìn)行變更管理的申請����,應(yīng)提前與藥審中心進(jìn)行溝通交流。2025 年 10 月 28 日����,國家藥監(jiān)局藥審中心發(fā)布《化學(xué)藥品批準(zhǔn)后藥學(xué)變更管理方案技術(shù)指導(dǎo)原則(實(shí)施)》[13]����,該指導(dǎo)原則為 ICH Q12 監(jiān)管工具之一 PACMP 在中國的落地實(shí)施文件,本指南適用于化學(xué)藥品上市后的藥學(xué)變更����,規(guī)定僅很有可能實(shí)施且可行性已經(jīng)過研究的擬降低變更管理類別的方可提交 PACMP,指南指出使用 PACMP 并非上市后變更的強(qiáng)制要求����,持有人/登記企業(yè)可根據(jù)藥品質(zhì)量體系建設(shè)情況和對產(chǎn)品全生命周期管理的需求選擇使用 PACMP����,并對不適合提交 PACMP 及 PACMP 不被批準(zhǔn)的情形進(jìn)行了舉例����。
基于對制劑產(chǎn)生不良影響的可能程度����,Q12 將批準(zhǔn)后 CMC 變更分為事先批準(zhǔn)、通知和無需向監(jiān)管報(bào)告變更 3 種級別����,這與各國監(jiān)管機(jī)構(gòu)的變更分類情況及管理程序基本一致(表 1)����,有利于促進(jìn)全球藥品上市后變更管理工作的協(xié)調(diào)和統(tǒng)一����。
▲表1-中美歐及 ICH Q12 變更分類及管理程序
02我國藥品上市后變更管理現(xiàn)狀
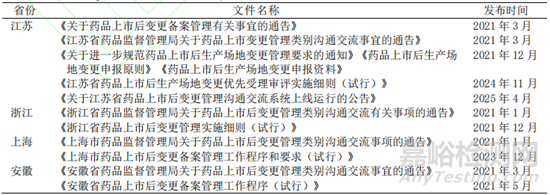
我國藥品上市后變更的管理由《藥品注冊管理辦法》2007 版到 2020 版[14-15],從基于變更事項(xiàng)的管理轉(zhuǎn)變?yōu)榛陲L(fēng)險(xiǎn)的管理模式(表 2)����,風(fēng)險(xiǎn)的評判劃分在 2021 年發(fā)布的《藥品上市后變更管理辦法(試行)》與配套文件及各類藥學(xué)����、臨床變更技術(shù)指導(dǎo)原則中進(jìn)一步明確(表 3)����,各省局也發(fā)布相關(guān)實(shí)施細(xì)則、工作程序等(表 4)����,藥品上市后變更管理的法規(guī)體系日趨完善����。
▲表2- 我國 2007 版和 2020 版《藥品注冊管理辦法》變更事項(xiàng)劃分
▲表3-藥品上市后變更管理法律法規(guī)體系文件
▲ 表4-長三角區(qū)域省局發(fā)布的文件
2007 版《藥品注冊管理辦法》中����,上市后變更按照變更事項(xiàng)進(jìn)行管理����,主要分為 3 類:原國家局審批的補(bǔ)充申請事項(xiàng)、原省局批準(zhǔn)國家局備案或原國家局直接備案的進(jìn)口藥品補(bǔ)充申請事項(xiàng)����、原省局備案的補(bǔ)充申請事項(xiàng)����,以上基于變更事項(xiàng)的分類原則����,優(yōu)勢在于分類清晰,不存在分類判斷的困難����,但未按照風(fēng)險(xiǎn)高低區(qū)分����,不利于根據(jù)風(fēng)險(xiǎn)合理分配監(jiān)管資源����。
伴隨著 2017 年國家藥監(jiān)局加入 ICH����,藥品監(jiān)管與國際不斷接軌����,作為藥品全生命周期管理重要組成部分的上市后變更,其管理程序也在借鑒國際先進(jìn)監(jiān)管經(jīng)驗(yàn)����,采用更科學(xué)的監(jiān)管方式����。2020 版《藥品注冊管理辦法》明確對變更按照風(fēng)險(xiǎn)實(shí)行分類管理的原則����,按照變更對藥品安全性、有效性和質(zhì)量可控性的風(fēng)險(xiǎn)和產(chǎn)生影響的程度����,實(shí)行分級管理,分為審批類變更(重大變更)����、備案類變更(中等變更)和報(bào)告類變更(微小變更)����。
2021 年發(fā)布的《藥品上市后變更管理辦法》[16]明確藥品上市后變更包括注冊管理事項(xiàng)變更和生產(chǎn)監(jiān)管事項(xiàng)變更����,其中注冊變更管理類別根據(jù)風(fēng)險(xiǎn)程度進(jìn)行劃分,無法確定變更管理類別的����,境內(nèi)持有人可以與省局進(jìn)行溝通����,境外持有人可以與藥審中心溝通。國家局負(fù)責(zé)風(fēng)險(xiǎn)相對較高的藥品上市后注冊管理事項(xiàng)變更的審批(重大變更)及境外生產(chǎn)藥品變更的備案����、報(bào)告等管理工作,省局依職責(zé)負(fù)責(zé)風(fēng)險(xiǎn)相對可控的轄區(qū)內(nèi)持有人藥品上市后生產(chǎn)監(jiān)管事項(xiàng)變更的許可����、登記和注冊管理事項(xiàng)變更的備案(中等變更)����、報(bào)告(微小變更)等管理工作����,國家局和省局依法組織實(shí)施對藥品上市后變更的監(jiān)督管理,通過施行不同的監(jiān)管模式和技術(shù)審評審查要求����,實(shí)現(xiàn)依據(jù)風(fēng)險(xiǎn)的分級管理。
與 FDA 和 EMA 不同����,我國藥品上市后變更的監(jiān)管體系分為國家局����、省局多層面,藥品上市后變更的管理按照風(fēng)險(xiǎn)等級由不同監(jiān)管部門完成����,各省局也發(fā)布相關(guān)實(shí)施細(xì)則及工作文件,以長三角區(qū)域三省一市為例����,上海����、江蘇、浙江和安徽省局均圍繞省內(nèi)企業(yè)藥品變更工作程序����、溝通交流����、生產(chǎn)場地變更等發(fā)布相關(guān)文件(表 4)����。
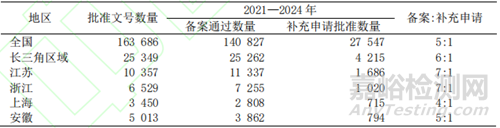
2021 年《藥品上市后變更管理辦法》發(fā)布實(shí)施����,對我國 2021 年—2024 年藥品上市后變更數(shù)據(jù)進(jìn)行統(tǒng)計(jì)(表 5)����,以長三角地區(qū)各省份數(shù)據(jù)為例,可見批準(zhǔn)文號數(shù)量與上市后變更總量存在地區(qū)之間的差異����,且變更類型比例也不盡相同����,長三角地區(qū)的備案量高于全國平均值,但區(qū)域內(nèi)上海市的備案量顯著低于全國平均值����,各省份之間差異明顯的原因主要考慮為各地區(qū)產(chǎn)業(yè)特點(diǎn)不同及監(jiān)管資源不均����,變更管理的工作標(biāo)準(zhǔn)與審查尺度也未進(jìn)行統(tǒng)一����。
▲表5- 2021 年—2024 年藥品上市后變更數(shù)據(jù)比較
03思考
藥品上市后變更管理配套的法規(guī)指南雖然已相對完善����,但由于變更的復(fù)雜多樣性,法規(guī)和指導(dǎo)原則難以窮盡所有可能的變更情形����,我國上市后變更管理的主體包括國家局和省局兩級����,各省份之間醫(yī)藥產(chǎn)業(yè)發(fā)展水平也存在差異,不同監(jiān)管機(jī)構(gòu)所面臨的監(jiān)管對象和產(chǎn)品均有所不同����,因此實(shí)際執(zhí)行層面的處理尺度可進(jìn)一步統(tǒng)一完善。本文予以討論����。
3.1 加強(qiáng)藥品全生命周期管理
針對藥品全生命周期中不同階段或不同變更等級由國家局和省局分別開展審評或監(jiān)管的情況����,藥品全生命周期管理可進(jìn)一步加強(qiáng)銜接:①建議在各類變更的申報(bào)資料格式上借鑒國際通行做法,在應(yīng)用 CTD 文檔的基礎(chǔ)上����,統(tǒng)一變更申報(bào)資料格式要求����,同時(shí)加大推廣實(shí)施 eCTD����,使省局和國家局的監(jiān)管能夠有效銜接;②建議借鑒國際先進(jìn)經(jīng)驗(yàn)����,加快 ICH Q12 落地實(shí)施����,提升上市后變更管理工作效率����,將藥品研發(fā)、上市����、變更管理貫穿全生命周期����。
3.2 統(tǒng)一各級藥品監(jiān)管部門管理標(biāo)準(zhǔn)
針對各省局的審評資源及監(jiān)管業(yè)態(tài)存在差異,可能存在風(fēng)險(xiǎn)等級判定����、技術(shù)審查和備案類變更啟動檢查檢驗(yàn)等工作標(biāo)準(zhǔn)不一致等問題����,建議通過建立國家局、省局聯(lián)動的工作機(jī)制����,統(tǒng)一各省局藥品上市后變更管理工作標(biāo)準(zhǔn)����;對于指導(dǎo)原則中未覆蓋或變更管理工作中易引起爭議的情形����,進(jìn)一步細(xì)化現(xiàn)行指導(dǎo)原則明確處理標(biāo)準(zhǔn);建議對年報(bào)類變更的管理模式進(jìn)一步完善����;建議建立統(tǒng)一的信息化平臺進(jìn)行管理標(biāo)準(zhǔn)的共享和更新。
3.3 加強(qiáng)持有人變更管理能力
針對持有人對法規(guī)理解和執(zhí)行存在差異����,在藥品上市后變更的研究及申報(bào)方面存在的變更等級判定不恰當(dāng)(如由重大變更降為中等或微小����、利用多次中等變更替代重大變更等)����、忽視關(guān)聯(lián)變更、變更技術(shù)研究不充分等問題����,持有人應(yīng)建立完善的質(zhì)量管理體系����,具有良好的質(zhì)量風(fēng)險(xiǎn)管理能力����,對產(chǎn)品及生產(chǎn)工藝有充分的理解,能夠評估和控制擬定變更相關(guān)的風(fēng)險(xiǎn)����,確保變更不應(yīng)給產(chǎn)品的安全性、有效性和質(zhì)量可控性帶來任何額外的風(fēng)險(xiǎn)����;各級藥監(jiān)機(jī)構(gòu)應(yīng)提供多層次溝通交流渠道,加強(qiáng)變更相關(guān)的政策宣貫和技術(shù)指南解讀及共性問題發(fā)布����,持續(xù)提升持有人的變更管理能力����。
04小結(jié)
藥品上市后變更管理是藥品全生命周期管理的重要環(huán)節(jié)����,加強(qiáng)藥品上市后變更管理是統(tǒng)籌高質(zhì)量發(fā)展和高水平安全、守護(hù)藥品審評審批改革成果和保障人民用藥安全的重要舉措����。各級監(jiān)管機(jī)構(gòu)和產(chǎn)業(yè)界需要充分理解和認(rèn)識藥品上市后變更管理對藥品高質(zhì)量發(fā)展和保障公眾健康安全的重要意義����,加強(qiáng)國際國內(nèi)相關(guān)法規(guī)和指導(dǎo)原則的學(xué)習(xí)、理解和應(yīng)用����,進(jìn)一步促進(jìn) ICH 相關(guān)指導(dǎo)原則在我國的良好實(shí)踐,不斷完善藥品上市后變更管理體系����,共同促進(jìn)我國藥品上市后變更管理工作水平的提升����。
參考文獻(xiàn)
[1] 國家知識產(chǎn)權(quán)局.中華人民共和國專利法(2020修正)[EB/OL].(2020-11-23)[2025-02-28].https://www.cnipa.gov.cn/art/2020/11/23/art_97_155167.html.
[2] 王 磊 , 沈 驍 , 王一鐸 , 等.中國藥品專利鏈接制度 ( 一 )制度介紹與案件數(shù)據(jù) [EB/OL]. http://www.haiwen-law.com/35/1198.
[3] 國家藥監(jiān)局 , 國家知識產(chǎn)權(quán)局.國家藥監(jiān)局 國家知識產(chǎn)權(quán)局關(guān)于發(fā)布《藥品專利糾紛早期解決機(jī)制實(shí)施辦法 ( 試行 )》的公告 2021 年第 89 號 [EB/OL].https://www.gov.cn/zhengce/zhengceku/2021-07/04/content_5622330.htm.
[4] 張 帆, 溫寶書.美國和加拿大藥品專利鏈接制度介紹[J].中國臨床藥理學(xué)雜志 , 2023, 39(24): 3693-3696.
[5] 廖關(guān)根.我國藥品專利鏈接制度分析 [J].社會科學(xué)前沿 , 2024, 13(5): 89-94.
[6] 崔羽純.新時(shí)代中國藥品專利鏈接制度的變革 [J].法學(xué) , 2023, 11(6): 4751-4758.
[7] 范 冀.從藥品專利鏈接制度角度對藥品知識產(chǎn)權(quán)保護(hù)的思考 [J].中藥與臨床 , 2023, 14(4): 73-76.
[8] 徐新明.阿斯利康公司與四川國為公司確認(rèn)是否落入藥品專利權(quán)利要求保護(hù)范圍糾紛案評析 [EB/OL].https://www.ciplawyer.cn/articles/153216.html.
[9] 馬忠法, 李仲?���。僮h中國藥品專利鏈接制度及其完善——兼評中國藥品專利鏈接制度首案 [J].2023, 36(5): 77-89.
[10] 聶琳峰 , 劉少軍.藥品專利鏈接制度的解構(gòu)與重構(gòu)——兼論《藥品專利糾紛早期解決機(jī)制實(shí)施辦法 ( 試行 )》[J].情報(bào)雜志 , 2022, 41(9): 199-207.
[11] 邰 紅 , 韋 嵥.中國藥品專利鏈接制度初探 [EB/OL].(2020-12-15)[2025-02-28]. https://mp.weixin.qq.com/s/uMRe7xh_Ud3Sgwwts9btHQ.
[12] 陳 燁 , 劉心玥 , 丁錦希.全生命周期下藥品專利鏈接制度的實(shí)施問題與優(yōu)化 [J].中國醫(yī)藥工業(yè)雜志 , 2023, 54(10): 1496-1503.
[13] 美藥專利法觀察.美國上訴判決 :橙皮書不包括非產(chǎn)品專利,判 Teva 撤除五項(xiàng)專利 [EB/OL].https://mp.weixin.qq.com/s/UJKufgW9c3bQE07SYZPtYw.