前言
隨著MDR和IVDR法規(guī)的引入,規(guī)范歐盟醫(yī)療器械流通���,出現(xiàn)了一套要求�,制造商在歐洲分銷醫(yī)療產(chǎn)品時(shí)必須遵守這些要求���,Basic UDI-DI就是其中之一����。
作為一名醫(yī)療器械注冊(cè)人員����,理解 Basic UDI-DI 是掌握歐盟 MDR(醫(yī)療器械法規(guī))合規(guī)的關(guān)鍵,它不僅是 EUDAMED 數(shù)據(jù)庫(kù)的“身份證”���,更是連接技術(shù)文檔與監(jiān)管體系的核心紐帶����。
它是誰(shuí)���?
在歐盟 MDR 下���,Basic UDI-DI 是一個(gè)特殊的標(biāo)識(shí)符�,它與我們常見的貼在標(biāo)簽上的 UDI-DI 不同����。
它是誰(shuí)?
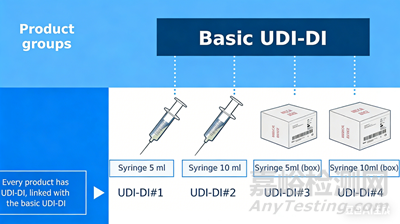
Basic UDI-DI 是設(shè)備型號(hào)的主要標(biāo)識(shí)符(Global Model Number, GMN)����,它是 EUDAMED 數(shù)據(jù)庫(kù)中記錄該器械信息的主索引。
法規(guī)內(nèi)容
Basic UDI-DI是歐盟境內(nèi)醫(yī)療器械的識(shí)別碼���。其存在是歐洲醫(yī)療器械領(lǐng)域法律的強(qiáng)制性要求之一���,該標(biāo)識(shí)符是在歐洲法規(guī)MDR 2017/745和IVDR 2017/746實(shí)施之后出現(xiàn)的。
獲取和使用Basic UDI-DI標(biāo)識(shí)符的必要性由MDR第29條和IVDR第26條規(guī)定���。
根據(jù)這些條款���,每個(gè)醫(yī)療器械或體外診斷設(shè)備的制造商都必須獲得Basic UDI-DI,以便在歐盟合法銷售其產(chǎn)品���。
Basic UDI-DI的更詳細(xì)要求可見MDR和IVDR附錄VI的part C����。
同時(shí)關(guān)于Basic UDI還有相關(guān)的MDCG指南�,更多信息可見MDCG 2018-1指南。
如何獲得�?
Basic UDI的核心是由專業(yè)組織發(fā)放給制造商的公司代碼(前綴),用于編碼產(chǎn)品條形碼����。
有四個(gè)由歐盟認(rèn)證的專業(yè)組織負(fù)責(zé)發(fā)放此類前綴:
GS1
HIBCC
ICCBBA
IFA GmbH
要獲得Basic UDI-DI,必須使用指定組織制定的編碼標(biāo)準(zhǔn)����。
來(lái)源和生成機(jī)制
以GS1為例:
Basic UDI-DI 的生成遵循嚴(yán)格的 GS1 標(biāo)準(zhǔn)規(guī)則����,確保全球唯一性。
1.廠商識(shí)別代碼 (Company Prefix)
這是從 GS1 獲得的前綴碼���,代表制造商的身份。
2.內(nèi)部型號(hào)參考 (Model Reference)
由企業(yè)自行編制����,可以是字母+數(shù)字組合,用來(lái)區(qū)分不同的產(chǎn)品系列或家族���。
3.校驗(yàn)碼 (Check Digit)
根據(jù) GS1 算法自動(dòng)生成,用于驗(yàn)證編碼的準(zhǔn)確性.
它的重要性
Basic UDI-DI 在整個(gè)醫(yī)療器械生命周期中扮演著“幕后指揮官”的角色:
它是進(jìn)入 EUDAMED 數(shù)據(jù)庫(kù)的唯一鑰匙����。所有在歐盟上市的 IIa/IIb/III 類器械必須在此登記 Basic UDI-DI����,以便監(jiān)管機(jī)構(gòu)追蹤產(chǎn)品信息���。
它是 CE 證書、歐盟符合性聲明 (EU Declaration of Conformity) 和技術(shù)文件中的法定引用項(xiàng)����。沒(méi)有它,無(wú)法獲得官方認(rèn)證���。
它是不良事件(MDR Article 85)和趨勢(shì)報(bào)告(Trend Reports)中的關(guān)鍵檢索碼����,幫助監(jiān)管機(jī)構(gòu)快速鎖定同一批次或同類產(chǎn)品的安全問(wèn)題���。
對(duì)注冊(cè)工作的影響
申請(qǐng)GSI代碼:通過(guò)GSI China或者GSI分支機(jī)構(gòu)獲取廠商識(shí)別碼
確定分組策略�,根據(jù)MDCG 2018-1指南�,基于預(yù)期用途、風(fēng)險(xiǎn)等級(jí)和基本設(shè)計(jì)制造特征來(lái)分配Basic UDI-DI
EUDAMED注冊(cè):在獲得CE證書前或產(chǎn)品上市前����,必須完成EUDAMED的UDI/Device模塊注冊(cè)����。
更新維護(hù)�,當(dāng)產(chǎn)品發(fā)生重大變更(如風(fēng)險(xiǎn)等級(jí)調(diào)整),可能需要重新分配Basic UDI-DI���。
常見誤區(qū)
|
|
|
|
|
僅存在于技術(shù)文檔、證書和數(shù)據(jù)庫(kù)中����。 |
必須印在標(biāo)簽、包裝或設(shè)備上�。 |
|
|
僅標(biāo)識(shí)產(chǎn)品型號(hào)/家族���。 |
包含批次�、序列號(hào)等生產(chǎn)信息����。 |
|
|
作為數(shù)據(jù)庫(kù)的主索引����,不隨產(chǎn)品物理移動(dòng)���。 |
識(shí)別具體的單個(gè)產(chǎn)品單元���。 |