免疫治療已徹底改變癌癥治療格局,成為許多患者的標(biāo)準(zhǔn)治療方案之一����。然而�,傳統(tǒng)的基于免疫檢查點(diǎn)抑制(如靶向PD-1/PD-L1和CTLA-4通路)的免疫療法僅對(duì)部分患者有效����。其局限性主要在于依賴患者體內(nèi)預(yù)先存在的��、能識(shí)別腫瘤特異性非同義突變的腫瘤反應(yīng)性T細(xì)胞����。因此�����,僅有少數(shù)患者能從這類治療中獲得持久療效��。
T細(xì)胞銜接器(T cell engagers, TCEs)是一類前景廣闊的免疫治療藥物,其優(yōu)勢(shì)在于無需依賴T細(xì)胞對(duì)特定肽段抗原的識(shí)別�����,即可激活T細(xì)胞的細(xì)胞毒作用�。TCE通過同時(shí)結(jié)合T細(xì)胞表面的CD3/TCR復(fù)合物和腫瘤細(xì)胞表面的腫瘤相關(guān)抗原(TAAs)�����,在T細(xì)胞與腫瘤細(xì)胞之間形成免疫突觸�,從而觸發(fā)腫瘤細(xì)胞殺傷���。這種“即用型”精準(zhǔn)療法有望擴(kuò)大可從免疫治療中獲益的患者群體��。
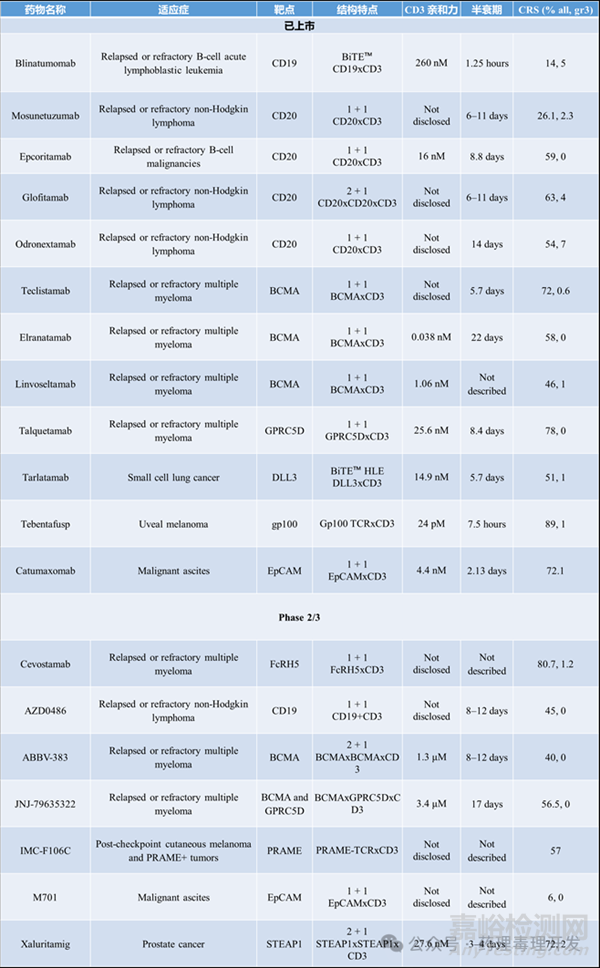
2014年�����,靶向B細(xì)胞表面CD19的雙特異性T細(xì)胞銜接器(BiTE™)——blinatumomab(商品名BLINCYTO®)獲批上市�����,標(biāo)志著TCE領(lǐng)域的重要里程碑。此后�����,針對(duì)多種腫瘤相關(guān)靶點(diǎn)���、適用于血液系統(tǒng)惡性腫瘤和實(shí)體瘤的TCE研發(fā)迅速升溫。
目前有多種靶向不同免疫細(xì)胞類型的多特異性銜接器正在探索中�,本文聚焦于靶向αβ T細(xì)胞的銜接器。當(dāng)前的研究重點(diǎn)在于通過優(yōu)化TCE分子結(jié)構(gòu)���、精選更具腫瘤特異性的靶點(diǎn),以提升其療效與安全性�����。此外�����,研究者還致力于精確調(diào)控T細(xì)胞活化過程����,并利用腫瘤微環(huán)境(TME)的獨(dú)特特征來增強(qiáng)治療特異性�。關(guān)鍵策略包括雙靶點(diǎn)設(shè)計(jì)��、條件性激活機(jī)制以及引入共刺激信號(hào)。這些創(chuàng)新有望進(jìn)一步優(yōu)化TCE性能�����,并推動(dòng)其在實(shí)體瘤治療中的廣泛應(yīng)用�����。
影響TCE抗腫瘤效力與安全性的關(guān)鍵因素
1.TCE結(jié)構(gòu)的優(yōu)化
TCE的分子大小和整體結(jié)構(gòu)對(duì)其療效及藥代動(dòng)力學(xué)(PK)特性具有決定性影響���。通常,TCE被設(shè)計(jì)為小而柔性的結(jié)構(gòu)�����,以促進(jìn)T細(xì)胞與腫瘤細(xì)胞之間的緊密接觸,從而高效形成免疫突觸�。典型的例子是BiTE™���,其由兩個(gè)串聯(lián)的單鏈可變區(qū)片段(scFv)通過短柔性連接肽構(gòu)成���。然而�,由于缺乏抗體Fc段且分子量小���,BiTE™在體內(nèi)清除迅速���,需頻繁給藥。
為改善這一問題���,研究者采用了多種策略延長(zhǎng)TCE半衰期,包括聚乙二醇化(PEGylation)�����、引入白蛋白結(jié)合域�����,或?qū)CE與抗體Fc片段融合���。這些修飾可在不損害其結(jié)合能力和抗腫瘤活性的前提下顯著提升藥物暴露時(shí)間。
除了分子大小���,TCE的空間構(gòu)型對(duì)T細(xì)胞與腫瘤細(xì)胞之間突觸距離的調(diào)控至關(guān)重要——該距離直接影響T細(xì)胞活化效率和腫瘤殺傷能力���。研究表明�����,T細(xì)胞與抗原呈遞細(xì)胞間形成有效免疫突觸的最佳膜間距約為15納米���,這與天然TCR–肽–MHC復(fù)合物的尺寸相當(dāng)�����,也接近IgG1抗體Fab臂的跨度���。近期研究進(jìn)一步證實(shí)���,這一距離同樣適用于TCE介導(dǎo)的細(xì)胞毒性作用。
當(dāng)TCE的抗腫瘤相關(guān)抗原(TAA)臂與抗CD3臂在空間上更靠近時(shí),可增強(qiáng)T細(xì)胞激活并提升腫瘤殺傷效果�;反之�,若兩個(gè)結(jié)合域之間的間隔過長(zhǎng),則TCE活性通常下降���。靶向TAA上靠近細(xì)胞膜的表位有助于縮短突觸距離�,從而改善T細(xì)胞與腫瘤細(xì)胞的相互作用和治療效果�����。
此外��,免疫突觸的信號(hào)強(qiáng)度還取決于能否有效排除T細(xì)胞表面的磷酸酶CD45(一種跨膜蛋白酪氨酸磷酸酶����,對(duì)TCR信號(hào)通路具有調(diào)控作用),并募集共刺激受體����。若TCE構(gòu)型無法有效實(shí)現(xiàn)這兩點(diǎn)�,則其效力降低,且需要更高的TAA表達(dá)密度才能觸發(fā)細(xì)胞毒反應(yīng)���。
值得注意的是��,最優(yōu)突觸距離的實(shí)現(xiàn)往往需通過經(jīng)驗(yàn)性調(diào)整�,因?yàn)檫B接肽長(zhǎng)度、表位位置及TCE柔性等因素各自獨(dú)立地影響細(xì)胞毒性的發(fā)揮,使得設(shè)計(jì)變得復(fù)雜�����。
2.親和力與價(jià)態(tài)的精細(xì)調(diào)控
除結(jié)構(gòu)外,TCE對(duì)靶點(diǎn)的親和力(affinity)和價(jià)態(tài)(valency)也是優(yōu)化的關(guān)鍵維度。
提高TAA結(jié)合價(jià)態(tài):通過引入多個(gè)TAA結(jié)合域(如雙價(jià)或更高)����,可顯著增強(qiáng)TCE的整體結(jié)合力(avidity)�����,不僅提升腫瘤殺傷效力���,還能在TAA表達(dá)水平低或異質(zhì)性強(qiáng)的腫瘤中保持活性�。
降低單個(gè)結(jié)合域親和力:在雙價(jià)TAA結(jié)合設(shè)計(jì)中�,即使單個(gè)TAA結(jié)合域的親和力較低,整體活性仍可維持���,從而避免與可溶性抗原結(jié)合導(dǎo)致的“抗原沉降效應(yīng)”(sink effect),提高藥物系統(tǒng)暴露�。
臨床上已有多個(gè)“2+1”格式TCE(即兩個(gè)抗TAA Fab+一個(gè)抗CD3 Fab)展現(xiàn)出良好前景���,例如:靶向CD20的glofitamab(商品名COLUMVI™����,羅氏)�����;靶向STEAP1的xaluritamig(安進(jìn)公司)��;靶向DLL3的ZG006(澤璟制藥)。
此外����,基于IgM的雙特異性銜接器因其五聚體或六聚體結(jié)構(gòu)可提供多價(jià)結(jié)合,理論上具備高avidity�,但實(shí)際抗腫瘤效力仍顯不足。盡管增加價(jià)態(tài)可增強(qiáng)結(jié)合強(qiáng)度,但分子體積增大和結(jié)構(gòu)復(fù)雜化可能限制其在實(shí)體瘤中的組織滲透性和分布����。
因此�����,在價(jià)態(tài)優(yōu)化過程中���,必須在結(jié)合強(qiáng)度�����、腫瘤穿透能力與細(xì)胞毒性效力之間取得精細(xì)平衡,以實(shí)現(xiàn)最佳治療窗口�。
3.CD3結(jié)合特性與細(xì)胞因子釋放綜合征(CRS)
越來越多的證據(jù)表明�,TCE所結(jié)合的CD3復(fù)合物具體結(jié)構(gòu)域?qū)ζ銽細(xì)胞激活強(qiáng)度、信號(hào)傳導(dǎo)模式及整體治療特征具有顯著影響。CD3是由CD3ε�、CD3δ、CD3γ和CD3ζ四個(gè)亞基組成的多聚體復(fù)合物�,與TCR緊密關(guān)聯(lián)��。各亞基在信號(hào)轉(zhuǎn)導(dǎo)中扮演不同角色,其空間可及性與取向也存在差異���。
研究發(fā)現(xiàn)�����,不同抗CD3抗體(如OKT3�、UCHT1�、L2K�����、SP34)識(shí)別CD3ε鏈上的不同表位,由此引發(fā)的TCR信號(hào)強(qiáng)度和模式各異����,進(jìn)而對(duì)細(xì)胞毒性和細(xì)胞因子釋放產(chǎn)生差異化影響���。將這些具有不同特性的CD3結(jié)合域整合進(jìn)TCE設(shè)計(jì)中�,可能優(yōu)化其治療窗口���。
1)CD3親和力與CRS風(fēng)險(xiǎn)
TCE對(duì)CD3/TCR復(fù)合物的親和力是平衡療效與安全性(尤其是控制CRS)的關(guān)鍵因素��。CRS是TCE治療中最常見的嚴(yán)重不良反應(yīng),由T細(xì)胞過度活化引發(fā)���,表現(xiàn)為大量促炎細(xì)胞因子(如IL-6��、TNF-α�����、IFN-γ���、GM-CSF)釋放����,導(dǎo)致全身性炎癥反應(yīng)����。
CRS的嚴(yán)重程度受多種因素影響,包括:腫瘤相關(guān)抗原(TAA)表達(dá)水平����;腫瘤負(fù)荷��;TCE給藥劑量與方案���;PK和組織分布;患者基礎(chǔ)狀況及合并癥�����。
臨床上已采用多種策略緩解CRS��,例如:預(yù)處理減瘤(如使用單抗清除腫瘤負(fù)荷)����;逐步遞增給藥(step-up dosing)���;使用糖皮質(zhì)激素;阻斷關(guān)鍵細(xì)胞因子(如IL-6受體拮抗劑托珠單抗)���。
2)親和力調(diào)控:解耦細(xì)胞毒性與CRS
Faroudi等人的研究揭示了細(xì)胞毒性與細(xì)胞因子釋放存在兩個(gè)不同的激活閾值:細(xì)胞毒作用(如溶酶體胞吐、靶細(xì)胞殺傷)所需的T細(xì)胞激活閾值較低�����;細(xì)胞因子分泌則需要更強(qiáng)的刺激�。
早期TCE多采用高親和力CD3結(jié)合域(KD<10nM)��,雖在臨床前模型中展現(xiàn)強(qiáng)效殺傷,但常伴隨嚴(yán)重CRS�����,治療窗狹窄��。近年來��,通過降低CD3結(jié)合臂親和力(affinity-attenuated CD3 binder)的設(shè)計(jì)策略���,成功實(shí)現(xiàn)了保留強(qiáng)效�����、抗原特異性的腫瘤細(xì)胞殺傷�;顯著減少細(xì)胞因子釋放���;改善安全性和耐受性���。
臨床證據(jù)支持這一策略:
Surovatamig(AZD0486):一種靶向CD19、攜帶新型低親和力CD3結(jié)合域的TCE����,在復(fù)發(fā)/難治性濾泡性淋巴瘤患者中(n=27�����,劑量≥2.4mg)達(dá)到96%客觀緩解率(ORR)和85%完全緩解率(CR),且療效持久���。采用雙階段遞增給藥后,最高劑量達(dá)15mg,無≥2級(jí)CRS或ICANS事件����,僅45%患者出現(xiàn)1級(jí)CRS�����。
ABBV-383(TNB-383B):靶向BCMA的TCE��,在多發(fā)性骨髓瘤模型中有效殺傷原代瘤細(xì)胞���,同時(shí)顯著減少T細(xì)胞因子分泌��。I期臨床試驗(yàn)(n=124)顯示:CRS發(fā)生率為57%(多為1–2級(jí))���,在≥40mg劑量下ORR為68%,部分緩解率達(dá)54%��。
此外,降低CD3親和力還可改善TCE的藥代動(dòng)力學(xué)和組織分布。例如����,一項(xiàng)HER2靶向TCE研究顯示:KD=50nM(低親和力)的CD3結(jié)合變體在腫瘤中富集更高;而KD=0.5nM(高親和力)版本則更多滯留于T細(xì)胞富集組織(如脾臟�����、淋巴結(jié)),腫瘤蓄積減少��。
3)CRS并非僅由CD3親和力決定
值得注意的是�����,即使TCE具有相同分子結(jié)構(gòu)和CD3親和力,CRS發(fā)生率仍可能顯著不同�。例如Acapatamab(靶向PSMA�����,用于mCRPC)的CRS發(fā)生率高達(dá)98%;Tarlatamab(靶向DLL3����,用于小細(xì)胞肺癌)的CRS發(fā)生率僅為51%。
這提示其他因素同樣關(guān)鍵����,如:TAA表達(dá)密度���;腫瘤負(fù)荷與轉(zhuǎn)移狀態(tài)(高負(fù)荷常與更重CRS相關(guān))���;患者免疫基線狀態(tài)與T細(xì)胞功能�。
因此,臨床上常采用預(yù)處理減瘤策略以降低CRS風(fēng)險(xiǎn)���,例如在使用CD20靶向TCE前,先給予B細(xì)胞清除劑Obinutuzumab。
4)替代策略:靶向TCR而非CD3
除CD3外����,直接靶向αβ TCR的TCE也正在探索中���。例如:Sanofi開發(fā)的CD33/CD123納米抗體TCE��,通過抗TCR αβ的VHH結(jié)構(gòu)域���,在小鼠模型中有效清除急性髓系白血?。ˋML)細(xì)胞���,并在非人靈長(zhǎng)類動(dòng)物中未引發(fā)系統(tǒng)性細(xì)胞因子升高或CRS相關(guān)毒性���。該結(jié)果表明��,繞過CD3�、直接結(jié)合TCR可能是一種更安全的T細(xì)胞激活新路徑。
TCE在癌癥治療中的最新創(chuàng)新:靶向特定T細(xì)胞亞群
為提升TCE的治療指數(shù)��、降低CRS等毒性����,研究者正探索選擇性激活特定T細(xì)胞亞群的策略���。該方法旨在減少被激活的T細(xì)胞總數(shù),從而減輕過度免疫激活帶來的不良反應(yīng)����。
1.優(yōu)先靶向CD8?細(xì)胞毒性T細(xì)胞
CD8?T細(xì)胞是介導(dǎo)抗腫瘤細(xì)胞毒作用的核心效應(yīng)細(xì)胞,能有效識(shí)別并殺傷表達(dá)突變或病毒來源肽段的腫瘤細(xì)胞。
體外研究表明����,傳統(tǒng)雙特異性TCE可有效引導(dǎo)CD8?T細(xì)胞殺傷腫瘤����。相比之下,CD4?輔助T細(xì)胞雖在某些情況下也具備細(xì)胞毒能力,并可支持CD8?T細(xì)胞功能�����,但其活化常伴隨大量細(xì)胞因子分泌�����,加劇CRS風(fēng)險(xiǎn)�����。此外�����,CD4?T細(xì)胞中包含調(diào)節(jié)性T細(xì)胞(Tregs),后者可抑制CD8?T細(xì)胞的增殖與殺傷活性��。臨床研究顯示�,外周血中Treg比例較高與blinatumomab(BiTE™)療效降低顯著相關(guān)。
因此,提高TCE對(duì)CD8?T細(xì)胞的選擇性,有望減少CRS發(fā)生�,避免Treg介導(dǎo)的免疫抑制�����,增強(qiáng)抗腫瘤效應(yīng)�����。
早期嘗試用抗CD8抗體替代抗CD3結(jié)構(gòu)域以實(shí)現(xiàn)CD8?選擇性靶向效果不佳�����。Michalk等人的研究發(fā)現(xiàn),抗CD8抗體僅在預(yù)激活的CD8?T細(xì)胞中有效介導(dǎo)殺傷�,而新鮮分離的靜息態(tài)CD8?T細(xì)胞仍需通過CD3/TCR提供“信號(hào)1”才能被有效激活����。為此�,新一代策略采用同時(shí)靶向CD3/TCR和CD8的多特異性抗體��,兼顧激活效率與亞群選擇性。例如�����,阿斯利康開發(fā)的TITAN平臺(tái)(Target-Induced T cell Activating Nanobodies)將CD8導(dǎo)向模塊整合進(jìn)含TCR結(jié)合域的TCE中,顯著減少CD4?T細(xì)胞活化�����,在維持強(qiáng)效細(xì)胞毒作用的同時(shí)明顯降低細(xì)胞因子釋放�����。
2.基于TCRVβ鏈的精準(zhǔn)T細(xì)胞亞群激活
深入理解T細(xì)胞分化狀態(tài)及腫瘤微環(huán)境中T細(xì)胞組成����,有助于識(shí)別更具治療潛力的特定亞群���。Marengo Therapeutics開發(fā)的tri-STAR平臺(tái)(三特異性選擇性T細(xì)胞激活庫)包含一個(gè)腫瘤靶向結(jié)構(gòu)域�,并通過識(shí)別特定TCRVβ鏈,選擇性激活在實(shí)體瘤中富集的T細(xì)胞亞群����。該策略僅激活一小部分T細(xì)胞,即可實(shí)現(xiàn)腫瘤定向殺傷,大幅降低CRS風(fēng)險(xiǎn)�。
3.靶向γδT細(xì)胞:利用先天樣T細(xì)胞降低毒性
盡管傳統(tǒng)CD3靶向TCE也能招募γδT細(xì)胞���,但選擇性激活γδT細(xì)胞亞群(尤其是Vγ9Vδ2亞型)可能進(jìn)一步優(yōu)化安全性����。γδT細(xì)胞在體內(nèi)比例較低,且具有天然抗腫瘤活性,其活化通常不依賴MHC�,且較少誘導(dǎo)Treg擴(kuò)增或大量促炎因子釋放。目前已有多個(gè)靶向γδT細(xì)胞的TCE進(jìn)入臨床���。LAVA-1207靶向PSMA,用于前列腺癌�;LAVA-1223靶向EGFR��,可特異性激活Vγ9Vδ2T細(xì)胞�����,介導(dǎo)腫瘤裂解并控制體內(nèi)腫瘤生長(zhǎng)�,同時(shí)激活下游T細(xì)胞和NK細(xì)胞����,避免Treg共激活。在非人靈長(zhǎng)類動(dòng)物模型中,LAVA-1223表現(xiàn)出良好的安全性與低細(xì)胞因子釋放水平�����,提示此類基于先天樣T細(xì)胞的療法有望在保持療效的同時(shí)顯著降低CRS風(fēng)險(xiǎn)����。
4.肽-MHC復(fù)合物作為TCE的新型靶點(diǎn)
2022年1月,美國(guó)FDA批準(zhǔn)了ImmTAC雙特異性分子tebentafusp(商品名KIMMTRAK®�����,由Immunocore公司開發(fā))用于治療葡萄膜黑色素瘤,這標(biāo)志著TCE在實(shí)體瘤治療領(lǐng)域取得重大突破�����。
1)ImmTAC技術(shù):利用增強(qiáng)親和力的TCR靶向pMHC
Tebentafusp是一種TCR/抗CD3雙功能分子��,屬于ImmTAC平臺(tái)���。其結(jié)構(gòu)包含:一個(gè)親和力增強(qiáng)的可溶性TCRαβ可變區(qū)片段���,特異性識(shí)別腫瘤細(xì)胞表面呈遞的gp100肽–MHC I類復(fù)合物(pMHC)��;一個(gè)抗CD3 scFv���,用于招募并激活多克隆T細(xì)胞。
該設(shè)計(jì)可引導(dǎo)T細(xì)胞殺傷表達(dá)gp100-pMHC的黑色素瘤細(xì)胞,無需T細(xì)胞本身具有g(shù)p100特異性��,從而繞過對(duì)預(yù)存腫瘤反應(yīng)性T細(xì)胞的依賴�。
這一成功驗(yàn)證了pMHC復(fù)合物作為治療靶點(diǎn)的可行性,即使其在腫瘤細(xì)胞表面表達(dá)水平通常較低�����。
更重要的是�,靶向pMHC使TCE能夠識(shí)別細(xì)胞內(nèi)抗原(如突變蛋白、癌睪抗原等)����,顯著拓展了免疫治療的靶點(diǎn)范圍�,不再局限于傳統(tǒng)的細(xì)胞表面腫瘤相關(guān)抗原(TAAs)���。
2)其他pMHC靶向平臺(tái)
Immatics公司的TCERs(T cell Engaging Receptors)����,由兩部分組成:識(shí)別HLA呈遞腫瘤抗原的TCR結(jié)構(gòu)域+激活T細(xì)胞的效應(yīng)結(jié)構(gòu)域。靶向MAGEA4/A8的IMA401和靶向PRAME的IMA402在臨床前及早期臨床研究中展現(xiàn)出良好的安全性與顯著的腫瘤抑制效果��。
TCR模擬抗體(TCR mimetics, TCRm)可模擬天然TCR對(duì)HLA-呈遞肽段的識(shí)別能力�。在靶向突變型Ras和p53新抗原所形成的pMHC復(fù)合物方面,已顯示出有前景的臨床前結(jié)果�����。
3)挑戰(zhàn)與局限
盡管前景廣闊,pMHC靶向TCE仍面臨關(guān)鍵挑戰(zhàn):
HLA限制性:每種pMHC復(fù)合物僅能被特定HLA等位基因(如HLA-A*02:01)呈遞���,因此患者需具備相應(yīng)HLA類型才能獲益,限制了適用人群�。
耐藥機(jī)制風(fēng)險(xiǎn):腫瘤可能通過HLA-I類基因座雜合性缺失(LOH)����,或抗原加工通路突變(如TAP�、β2M缺陷)���,導(dǎo)致pMHC無法正常呈遞���,從而逃逸TCE識(shí)別��。
工程化難度高:需設(shè)計(jì)既能高親和力結(jié)合pMHC、又不交叉識(shí)別自身正常肽段的分子,以避免“脫靶”毒性損傷健康組織���。
4)新策略:?jiǎn)捂減MHC(scpMHC)融合抗體
為更精準(zhǔn)地激活特定T細(xì)胞并減少系統(tǒng)性毒性��,研究者開發(fā)了一種創(chuàng)新方法:將腫瘤或病毒來源的抗原肽與β2-微球蛋白(β2m)及MHC-I重鏈共價(jià)連接�,構(gòu)建成單鏈pMHC(scpMHC)�;再將scpMHC與腫瘤靶向抗體(如抗IGF1R或抗EGFR)融合。該設(shè)計(jì)的優(yōu)勢(shì)在于僅在TME中激活特異性識(shí)別該肽段的CD8?T細(xì)胞�,避免全身性T細(xì)胞廣泛激活�,從而顯著降低CRS風(fēng)險(xiǎn)�����。同時(shí)繞過因HLA-ILOH導(dǎo)致的抗原呈遞缺失問題(因scpMHC自帶抗原呈遞結(jié)構(gòu))���。但該策略仍受限于患者的HLA類型��,無法完全擺脫HLA限制性。
邏輯門控TCE:提升腫瘤特異性的新策略
為克服傳統(tǒng)TCE在實(shí)體瘤和血液瘤治療中面臨的抗原異質(zhì)性和on-target off-tumor毒性問題��,研究者開發(fā)了雙靶點(diǎn)邏輯門控TCE(dual-targeting TCEs)�����。這類分子通過同時(shí)識(shí)別兩個(gè)腫瘤相關(guān)抗原(TAAs),以“OR”或“AND”邏輯門控方式調(diào)控T細(xì)胞激活,從而在提升療效的同時(shí)增強(qiáng)腫瘤選擇性�。
一���、OR門控TCE:應(yīng)對(duì)抗原異質(zhì)性�����,防止免疫逃逸
作用機(jī)制:只要腫瘤細(xì)胞表達(dá)任一靶抗原(A或B),即可觸發(fā)T細(xì)胞激活���。
優(yōu)勢(shì):有效覆蓋抗原表達(dá)不均的腫瘤群體;防止因單一抗原丟失(如CD19?克?�。?dǎo)致的復(fù)發(fā)�;特別適用于血液系統(tǒng)惡性腫瘤(如B細(xì)胞淋巴瘤�����、白血病、多發(fā)性骨髓瘤)�����,這些疾病中靶抗原常表達(dá)于可再生、非關(guān)鍵組織(如正常B細(xì)胞)�,允許一定程度的“脫靶”毒性�。
代表性設(shè)計(jì):靶向CD19/CD20���、BCMA/CD19或CD33/CD123的雙特異性TCE����。類似CAR-T療法中的雙靶點(diǎn)策略���,可顯著增強(qiáng)抗腫瘤活性�����,延長(zhǎng)緩解時(shí)間����。
局限性:OR門控?zé)o法像聯(lián)合用藥那樣靈活調(diào)整各靶點(diǎn)劑量���;需精心設(shè)計(jì)兩個(gè)TAA結(jié)合臂的親和力與藥效動(dòng)力學(xué)���,確保兩者在體內(nèi)均能達(dá)到有效劑量��。
二、AND門控TCE:提升腫瘤特異性����,降低脫靶毒性
作用機(jī)制:僅當(dāng)腫瘤細(xì)胞同時(shí)高表達(dá)兩個(gè)靶抗原(A且B)時(shí)�,才有效激活T細(xì)胞�����。通常通過調(diào)節(jié)兩個(gè)TAA結(jié)合域的親和力或價(jià)態(tài)�,使單抗原結(jié)合不足以觸發(fā)強(qiáng)信號(hào)����,而雙抗原共結(jié)合則通過協(xié)同親合力(avidity)實(shí)現(xiàn)高效激活�����。
適用場(chǎng)景:尤其適用于實(shí)體瘤��,因其缺乏真正腫瘤特異性表面抗原,多數(shù)TAAs也在健康組織中低水平表達(dá)��。AND門控可顯著減少對(duì)僅表達(dá)單一抗原的正常細(xì)胞的誤傷。
臨床前與臨床實(shí)例:
tNY-aCD3/aEGFR:一種三特異性TCE,同時(shí)靶向?qū)嶓w瘤上的兩個(gè)抗原��,展現(xiàn)出更強(qiáng)的療效與選擇性����;
EpCAM/EGFR雙靶點(diǎn)TCE:對(duì)結(jié)直腸癌中雙陽性細(xì)胞的殺傷效力顯著高于單陽性細(xì)胞�;
AMG305(BiTE™平臺(tái)):靶向CDH3和MSLN(常在多種實(shí)體瘤中共表達(dá))�����,利用親合力依賴機(jī)制選擇性清除雙陽性腫瘤細(xì)胞���,保護(hù)單抗原表達(dá)的正常組織;
ISB2001(Ichnos&Glenmark):一種靶向BCMA和CD38的三特異性TCE�����,用于多發(fā)性骨髓瘤(MM)���。相比單靶點(diǎn)藥物(如teclistamab或ABBV-383),ISB2001可增強(qiáng)對(duì)MM克隆的親合力��;減少可溶性BCMA引起的“抗原沉降效應(yīng)”��;降低因CD38廣泛表達(dá)帶來的毒性�。目前正在進(jìn)行I期臨床試驗(yàn),評(píng)估其在復(fù)發(fā)/難治性MM患者中的安全性和療效����。
影響AND門控效果的關(guān)鍵因素:兩個(gè)抗原的表達(dá)水平與共表達(dá)比例���;腫瘤微環(huán)境中T細(xì)胞浸潤(rùn)程度�;抗原的內(nèi)化速率����;TCE分子的幾何構(gòu)型與結(jié)合動(dòng)力學(xué)。
因此���,AND門控TCE對(duì)雙陽性細(xì)胞的選擇性需通過實(shí)驗(yàn)驗(yàn)證�����,不能僅憑理論預(yù)測(cè)。
基于TME因素的條件性TCE設(shè)計(jì)
為提升TCE在實(shí)體瘤治療中的腫瘤特異性并降低系統(tǒng)性毒性(如CRS�、on-target off-tumor效應(yīng))���,研究者開發(fā)了條件性激活型TCE(conditionally-active TCEs)���。這類分子僅在TME特有的理化條件下被激活,從而實(shí)現(xiàn)“精準(zhǔn)打擊”。部分案例總結(jié)如下:
一����、條件性激活的核心策略
條件性TCE利用TME中區(qū)別于正常組織的獨(dú)特特征進(jìn)行激活���,主要包括:蛋白酶介導(dǎo)的激活(如MMPs��、絲氨酸/半胱氨酸蛋白酶)�����;酸性pH響應(yīng)����;高ATP濃度依賴性結(jié)合模塊�;工程化分子互作開關(guān)。這些設(shè)計(jì)使TCE在血液循環(huán)或健康組織中保持“沉默”��,僅在進(jìn)入腫瘤區(qū)域后才釋放活性�����,顯著提升治療指數(shù)���,甚至可能支持更高劑量給藥以增強(qiáng)療效�����。
挑戰(zhàn):TME特征在不同患者甚至同一腫瘤內(nèi)存在高度異質(zhì)性�,且缺乏可靠的生物標(biāo)志物用于患者分層,限制了該策略的普適性�。
二�、蛋白酶介導(dǎo)的條件性激活(重點(diǎn)方向)
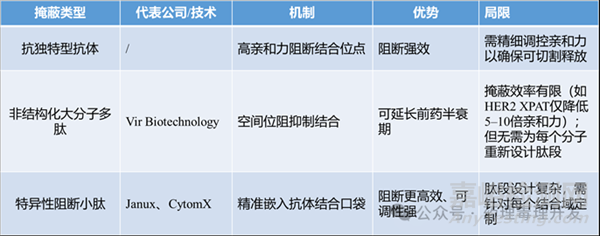
原理:腫瘤相關(guān)蛋白酶(如基質(zhì)金屬蛋白酶MMPs)在TME中濃度顯著高于正常組織;TCE的CD3和/或TAA結(jié)合域被連接上可被蛋白酶切割的“掩蔽肽”(mask)���;掩蔽肽在循環(huán)系統(tǒng)中阻止TCE與靶點(diǎn)結(jié)合���,降低100–1000倍親和力;進(jìn)入腫瘤后�����,蛋白酶切除掩蔽肽���,釋放活性TCE��,觸發(fā)T細(xì)胞殺傷�����。
掩蔽對(duì)象選擇:所有策略均優(yōu)先掩蔽CD3結(jié)合域(防止全身T細(xì)胞激活)��;是否掩蔽TAA結(jié)合域取決于該抗原在健康組織中的表達(dá)水平——若表達(dá)廣泛����,則掩蔽可減少脫靶毒性及靶點(diǎn)介導(dǎo)的藥物處置(TMDD)導(dǎo)致的藥效損失。
三�、主要掩蔽技術(shù)平臺(tái)比較
四、代表性臨床前與臨床進(jìn)展
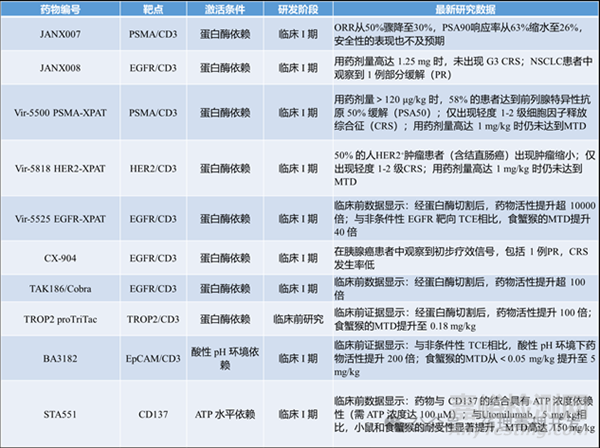
1.JANX008(Janux Therapeutics)
雙掩蔽型抗EGFR TCE(CD3+EGFR均被掩蔽)���。未激活狀態(tài)下�,CD3結(jié)合力↓1000倍���,EGFR結(jié)合力↓300倍�,細(xì)胞毒活性極低���。在非人靈長(zhǎng)類模型中����,最大耐受劑量(MTD)從30mg/kg/天(非掩蔽TCE)提高至>600mg/kg/天�,安全性顯著提升。
目前處于早期臨床試驗(yàn)����,初步數(shù)據(jù)顯示良好安全性和抗腫瘤活性��。
2.JANX007(Janux Therapeutics)
單掩蔽型PSMA靶向TCE��。藥代動(dòng)力學(xué)顯著改善����,前藥形式半衰期約120小時(shí)�,而非掩蔽TCE僅2小時(shí)��。
不過�����,2025年12月最新臨床數(shù)據(jù)顯示���,在去勢(shì)抵抗性前列腺癌(CRPC)患者中���,隨著樣本量從16例擴(kuò)大到104例,ORR從50%驟降至30%�����,PSA90響應(yīng)率從63%縮水至26%��,安全性的表現(xiàn)也不及預(yù)期。
3.其他產(chǎn)品
CX-904(CytomX)����,EGFR靶向條件性TCE,2025年停止開發(fā)�����。
VIR-5818/VIR-5500(Vir Biotechnology):分別靶向HER2和PSMA的條件性TCE�����。
五�����、其它策略
除了蛋白酶介導(dǎo)的激活外�����,研究者還利用TME中其他獨(dú)特的理化特征——如酸性pH�、高ATP濃度以及工程化分子互作機(jī)制——開發(fā)新型條件性TCE,以實(shí)現(xiàn)更高精度的腫瘤靶向和更低的系統(tǒng)毒性����。
1.pH依賴性激活:利用TME的酸性環(huán)境背景
正常組織pH約為7.2–7.4���。腫瘤微環(huán)境因癌細(xì)胞“瓦伯格效應(yīng)”(Warburg effect)產(chǎn)生大量乳酸等代謝產(chǎn)物,pH降至6.5–6.9�����。
技術(shù)原理:通過在抗體互補(bǔ)決定區(qū)(CDR)中引入組氨酸殘基(histidine spiking)�,使抗原結(jié)合域?qū)H敏感。在酸性TME中���,組氨酸質(zhì)子化導(dǎo)致構(gòu)象變化,增強(qiáng)與靶點(diǎn)的親和力���。在正常組織中(中性pH)�,結(jié)合能力顯著降低�����,TCE保持“沉默”�。
代表分子如BF-588-Dual CAB,一款雙特異性抗體�,同時(shí)靶向EpCAM和CD3。在pH6.0時(shí)�,對(duì)EpCAM和CD3的親和力分別比pH 7.4時(shí)提高6倍和4倍�����。結(jié)果顯示強(qiáng)效殺傷腫瘤細(xì)胞��,顯著降低系統(tǒng)毒性���。另外,因減少TMDD��,可改善PK��。在非人靈長(zhǎng)類(NHP)模型中�,MTD從<0.05mg/kg(非pH敏感型)提升至5mg/kg,半衰期從約15小時(shí)延長(zhǎng)至42小時(shí)�����。
挑戰(zhàn):腫瘤內(nèi)pH存在高度異質(zhì)性�����,受血流灌注�、壞死區(qū)域等因素影響;pH波動(dòng)可能影響TCE結(jié)合效率,進(jìn)而限制免疫突觸的充分形成����。
2.利用TME中高ATP濃度進(jìn)行激活
腫瘤組織因高細(xì)胞更替和代謝應(yīng)激,胞外ATP濃度顯著升高��。ATP可作為局部“激活信號(hào)”����。
現(xiàn)有應(yīng)用(雖非TCE,但具啟發(fā)性):STA551��,一種抗CD137(4-1BB)激動(dòng)型抗體����;工程化設(shè)計(jì)使其僅在高ATP環(huán)境下增強(qiáng)與CD137的結(jié)合;確保共刺激信號(hào)局限于腫瘤部位�,避免全身免疫過度激活���。
潛在拓展:尚無已報(bào)道的TCE直接利用ATP作為激活開關(guān)�����;但該策略理論上可用于設(shè)計(jì)ATP響應(yīng)型TCE�����,實(shí)現(xiàn)腫瘤局部T細(xì)胞激活���,降低CRS等系統(tǒng)毒性風(fēng)險(xiǎn)��。
3.創(chuàng)新工程化分子互作策略
1)PACE技術(shù)(Prodrug-Activating Chain Exchange)
原理:兩種互補(bǔ)的無活性前藥分別靶向腫瘤上共表達(dá)的兩個(gè)TAAs�。當(dāng)兩者在腫瘤表面同時(shí)富集時(shí)��,發(fā)生鏈交換反應(yīng)��,重組形成具有完整CD3結(jié)合域的活性TCE�。
優(yōu)勢(shì):僅在雙抗原陽性腫瘤細(xì)胞上激活;可安全靶向在正常組織中單獨(dú)表達(dá)的抗原��;不依賴蛋白酶或低pH等TME因子��,適用性更廣���。
挑戰(zhàn):鏈交換效率可能存在個(gè)體差異�;可能導(dǎo)致治療反應(yīng)異質(zhì)性����,增加臨床轉(zhuǎn)化難度���。
2)半抗體(Hemibodies)
設(shè)計(jì):將傳統(tǒng)TCE“拆分”為兩個(gè)互補(bǔ)片段(hemibodies)。每個(gè)片段包含:一個(gè)抗腫瘤抗原的scFv����;以及抗CD3抗體的VL或VH結(jié)構(gòu)域。比如半抗體A含抗原1的scFv+抗CD3的VL�����,半抗體B含抗原2的scFv+抗CD3的VH�����。每個(gè)半抗體單獨(dú)無法結(jié)合CD3���,因?yàn)镃D3識(shí)別需要完整的VH-VL配對(duì)形成的抗原結(jié)合位點(diǎn)���;只有當(dāng)兩個(gè)半抗體同時(shí)結(jié)合到同一腫瘤細(xì)胞上(該細(xì)胞必須共表達(dá)抗原1和抗原2),它們的VH和VL結(jié)構(gòu)域才能在空間上靠近���,自發(fā)組裝成一個(gè)有功能的抗CD3結(jié)構(gòu)域。
激活機(jī)制:僅當(dāng)兩個(gè)hemibodies同時(shí)結(jié)合同一腫瘤細(xì)胞上的兩個(gè)不同抗原時(shí)��,才能重構(gòu)功能性CD3結(jié)合位點(diǎn),從而選擇性激活T細(xì)胞�,殺傷雙抗原陽性細(xì)胞。
優(yōu)勢(shì):實(shí)現(xiàn)嚴(yán)格的AND門控邏輯�;極大減少對(duì)僅表達(dá)單一抗原的健康細(xì)胞的損傷;提升治療精準(zhǔn)度與安全性���。
通過共刺激信號(hào)增強(qiáng)TCE療效
T細(xì)胞的完全活化不僅依賴于TCR/CD3介導(dǎo)的“第一信號(hào)”���,還需要共刺激信號(hào)(第二信號(hào))來支持其增殖、效應(yīng)功能獲得����、分化及長(zhǎng)期存活。雖然早期嘗試通過激活共刺激通路(如CD28�����、CD137/4-1BB�、CD2等)增強(qiáng)天然抗腫瘤免疫反應(yīng)的臨床效果有限,但將共刺激信號(hào)與TCE結(jié)合已成為提升癌癥免疫治療效果的新策略�����。
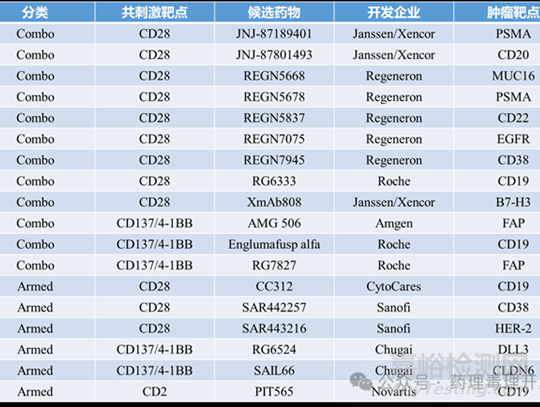
目前主要有兩類方法正在臨床前和臨床研究中探索�,如下表所示���。
一、聯(lián)合療法:TCE+腫瘤導(dǎo)向的共刺激雙特異性抗體
策略:將TCE與另一種雙特異性抗體聯(lián)用���,后者一端靶向同一腫瘤上的另一TAA�,另一端結(jié)合共刺激受體(如CD28����、CD137L等);
目標(biāo):僅在TCE已結(jié)合的腫瘤部位提供共刺激信號(hào)�����,避免全身性T細(xì)胞過度激活���,從而提高安全性�����。
代表性案例:REGN5837(Regeneron)——CD22×CD28雙抗�;RG6333(Roche)——CD19×CD28雙抗���。與CD20靶向TCE聯(lián)用�����,在B細(xì)胞淋巴瘤模型中顯著增強(qiáng)T細(xì)胞活化和腫瘤控制���。
Englumafusp alfa(Roche):CD19導(dǎo)向的CD137L融合蛋白。與CD20 TCE glofitamab(COLUMVI™)聯(lián)用�,在復(fù)發(fā)/難治性侵襲性B細(xì)胞非霍奇金淋巴瘤(r/rB-NHL)患者中顯示出強(qiáng)協(xié)同作用和令人鼓舞的臨床療效。
這類“腫瘤導(dǎo)向共刺激”策略可將共刺激信號(hào)空間限制在腫瘤微環(huán)境內(nèi)��,既增強(qiáng)療效�,又降低系統(tǒng)毒性。
二���、單分子整合策略:三特異性TCE(含共刺激結(jié)構(gòu)域)
設(shè)計(jì):在一個(gè)分子中同時(shí)整合三個(gè)功能域:TAA靶向域+CD3結(jié)合域+共刺激受體結(jié)合域(如CD28�����、CD137��、CD2)���;
例如:靶向CD38或HER2的CD28三特異性抗體(Sanofi開發(fā)),但因安全性或療效問題已終止臨床開發(fā)����。
最新方向已轉(zhuǎn)向其他共刺激通路�。如CD137(4-1BB)����,用于實(shí)體瘤,如Chugai公司開發(fā)的靶向DLL3或CLDN6的三特異性TCE�����。又如CD2����,用于血液系統(tǒng)惡性腫瘤。
挑戰(zhàn):安全性風(fēng)險(xiǎn)高���,“武裝型TCE”(armed engagers)若共刺激過強(qiáng)���,易引發(fā)CRS或肝毒性;信號(hào)比例難以優(yōu)化�����,CD3/TCR信號(hào)與共刺激信號(hào)的最佳配比未必是1:1;若因毒性限制劑量��,可能導(dǎo)致CD3信號(hào)不足���,反而削弱抗腫瘤效果。
因此�,相比單分子設(shè)計(jì),TCE與腫瘤導(dǎo)向共刺激激動(dòng)劑的聯(lián)合用藥可能更具靈活性與可控性�����。
三�、多藥聯(lián)用與給藥順序的重要性
最新臨床前研究表明:CD20 TCE+CD19-CD28雙抗+CD19-CD137L雙抗的三聯(lián)療法中,CD28和CD137L具有非重疊功能(CD28促進(jìn)初始擴(kuò)增�,CD137L支持記憶形成與持久性);給藥順序?qū)Π踩院童熜в酗@著影響——需精細(xì)優(yōu)化以平衡免疫激活強(qiáng)度與毒性�。
TCE聯(lián)合療法在癌癥治療中的挑戰(zhàn)與未來方向
本文系統(tǒng)梳理了TCE在腫瘤免疫治療中的最新進(jìn)展,并指出成功開發(fā)高效TCE的關(guān)鍵要素���,包括:精細(xì)調(diào)控對(duì)CD3/TCR復(fù)合物的結(jié)合親和力���;開發(fā)雙靶點(diǎn)邏輯門控TCE(OR/AND門控);設(shè)計(jì)基于TME的條件性激活策略����;引入共刺激信號(hào)以增強(qiáng)T細(xì)胞功能�。新一代TCE旨在實(shí)現(xiàn)更強(qiáng)效�、更精準(zhǔn)、更安全的腫瘤殺傷����,同時(shí)克服單藥治療常見的耐藥與復(fù)發(fā)問題。然而�����,臨床轉(zhuǎn)化仍面臨多重挑戰(zhàn)���。
一��、當(dāng)前主要臨床挑戰(zhàn)
CRS:目前主要依賴劑量控制策略緩解:如“啟動(dòng)劑量”(priming dose)���、“階梯遞增給藥”(step-up dosing)或皮下制劑;這些策略可降低初始細(xì)胞因子風(fēng)暴�����,提升患者耐受性���,但尚未確立最優(yōu)給藥方案�。
缺乏真正腫瘤特異性抗原(TSAs):多數(shù)TCE靶向TAAs,而這些抗原常在正常組織中低水平表達(dá)�����,導(dǎo)致on-target off-tumor毒性���。
患者篩選困難:除TAA表達(dá)外�,缺乏可靠的療效預(yù)測(cè)生物標(biāo)志物�����;加之TCE本身高活性�,使得I期臨床試驗(yàn)周期長(zhǎng)���、劑量探索復(fù)雜�����。
免疫抑制性TME:腫瘤通過招募MDSCs(髓源抑制細(xì)胞)�、Tregs(及分泌抑制性細(xì)胞因子(如TGF-β��、IL-10),構(gòu)建對(duì)T細(xì)胞“不友好”的微環(huán)境�����,嚴(yán)重限制TCE介導(dǎo)的T細(xì)胞浸潤(rùn)���、活化與持久性����。
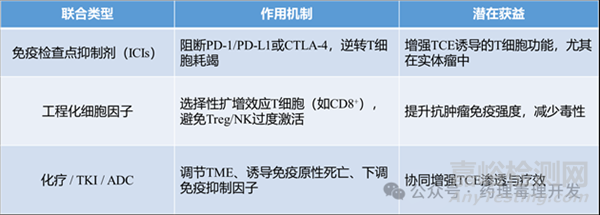
二���、聯(lián)合療法:突破瓶頸的關(guān)鍵路徑
隨著TCE安全性不斷提升(如條件性激活���、雙靶點(diǎn)設(shè)計(jì)等),其治療窗口擴(kuò)大��,為更積極的聯(lián)合策略奠定基礎(chǔ)�����。潛在組合包括:
1.TCE+免疫檢查點(diǎn)抑制劑
臨床證據(jù):Blinatumomab(CD19-TCE)聯(lián)合nivolumab(抗PD-1)±ipilimumab(抗CTLA-4)或pembrolizumab���,在血液瘤中顯示良好安全性和初步療效(NCT02879695, NCT03160079)��。
Tarlatamab(DLL3-TCE�����,商品名IMDELLTRA™)聯(lián)合durvalumab(抗PD-L1)正在開展III期臨床試驗(yàn)(NCT06211036)��,用于復(fù)發(fā)/難治性小細(xì)胞肺癌(SCLC)�。
新型單分子平臺(tái):將抗PD-1、PD-L1或LAG-3結(jié)構(gòu)域直接融合到BiTE樣骨架中���,同時(shí)靶向TAA(如FAP���、CD33���、5T4)�,實(shí)現(xiàn)“一體化”聯(lián)合治療�����。
2.TCE+工程化細(xì)胞因子
代表性藥物:
AB248(AsherBio):一種IL-2突變體與抗CD8β抗體片段的融合蛋白��,特異性激活CD8?T細(xì)胞�,避免刺激Treg和NK細(xì)胞�����。臨床前(含非人靈長(zhǎng)類)顯示高選擇性�����、低毒性��。即將與tarlatamab聯(lián)用進(jìn)入臨床評(píng)估���。
RG6279/IBI363(PD-1-IL2v融合蛋白):將IL-2活性導(dǎo)向PD-1?T細(xì)胞;
STAR0602(Marengo):通過TCRVβ結(jié)構(gòu)域靶向特定T細(xì)胞亞群遞送IL-2���。
這些“智能細(xì)胞因子”可與TCE協(xié)同��,擴(kuò)增并維持腫瘤特異性T細(xì)胞池�����,延長(zhǎng)抗腫瘤應(yīng)答�。
三�、未來展望
TCE有望成為多種腫瘤的標(biāo)準(zhǔn)治療組成部分,尤其在傳統(tǒng)免疫療法無效的實(shí)體瘤中�����。通過多維度工程優(yōu)化(親和力、邏輯門控�����、條件激活����、共刺激整合),TCE正從“強(qiáng)力武器”進(jìn)化為“智能制導(dǎo)導(dǎo)彈”�����。個(gè)體化聯(lián)合策略將成為主流——根據(jù)患者TME特征����、抗原表達(dá)譜���、免疫狀態(tài)定制治療方案�����。最終目標(biāo)是擴(kuò)大免疫治療受益人群���,實(shí)現(xiàn)深度且持久的臨床緩解�����。
這些創(chuàng)新為TCE這一新型免疫治療類別奠定了演進(jìn)基礎(chǔ)�,預(yù)示著一個(gè)兼顧更高療效與更好安全性的新治療時(shí)代即將到來����。