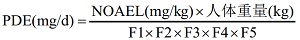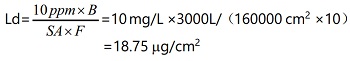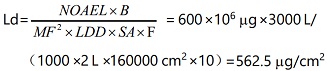藥品共線生產(chǎn)是制藥企業(yè)普遍采用的生產(chǎn)方式���,其在提升資源利用率、降低生產(chǎn)成本的同時(shí)��,也帶來(lái)了污染與交叉污染等質(zhì)量風(fēng)險(xiǎn)�。隨著藥品上市許可持有人制度的推進(jìn)和委托生產(chǎn)的普及,共線生產(chǎn)的質(zhì)量管理日益成為行業(yè)關(guān)注的焦點(diǎn)�。本文結(jié)合《藥品共線生產(chǎn)質(zhì)量風(fēng)險(xiǎn)管理指南》及相關(guān)研究,從基本原則�、風(fēng)險(xiǎn)評(píng)估、清潔驗(yàn)證等方面探討共線生產(chǎn)中的關(guān)鍵控制點(diǎn)�,并提出實(shí)施建議,旨在為企業(yè)規(guī)范共線生產(chǎn)���、保障藥品質(zhì)量提供參考��。
Part.01共線生產(chǎn)的基本原則與法規(guī)依據(jù)
藥品共線生產(chǎn)是指多個(gè)藥品品種共用同一生產(chǎn)線、設(shè)備或廠房進(jìn)行生產(chǎn)的模式���。其核心是在保障藥品質(zhì)量的前提下�����,實(shí)現(xiàn)資源的高效利用�����。我國(guó)《藥品生產(chǎn)質(zhì)量管理規(guī)范》第四十六條明確規(guī)定��,企業(yè)應(yīng)當(dāng)綜合考慮藥品的特性�����、工藝和預(yù)定用途等因素���,評(píng)估多產(chǎn)品共線的可行性���,并形成書(shū)面報(bào)告 [1]。
共線生產(chǎn)的最大風(fēng)險(xiǎn)在于交叉污染����,尤其是口服固體制劑生產(chǎn)過(guò)程中粉塵的產(chǎn)生與擴(kuò)散 [2]。因此���,風(fēng)險(xiǎn)識(shí)別是共線質(zhì)量管理的首要環(huán)節(jié)����,持有人應(yīng)對(duì)共線生產(chǎn)的可行性和風(fēng)險(xiǎn)控制承擔(dān)主體責(zé)任,特別是在委托生產(chǎn)模式下�����,需對(duì)受托方的共線評(píng)估報(bào)告進(jìn)行嚴(yán)格審核 [3]��。
《藥品共線生產(chǎn)質(zhì)量風(fēng)險(xiǎn)管理指南》的發(fā)布�,為企業(yè)提供了系統(tǒng)性的技術(shù)指導(dǎo),明確了“基于風(fēng)險(xiǎn)�、全程管控、科學(xué)驗(yàn)證”的基本原則��,細(xì)化了共線生產(chǎn)的評(píng)估要素與控制要求 [4]�����。
Part.02共線生產(chǎn)風(fēng)險(xiǎn)評(píng)估的關(guān)鍵要素
共線生產(chǎn)的風(fēng)險(xiǎn)評(píng)估應(yīng)涵蓋藥品特性����、工藝特點(diǎn)、廠房設(shè)施����、設(shè)備清潔等多方面因素?!逗鲜∷幤繁O(jiān)督管理局關(guān)于加強(qiáng)藥品共線生產(chǎn)監(jiān)督管理的通知》明確指出,企業(yè)應(yīng)對(duì)所有共線品種(包括研發(fā)樣品���、臨床試驗(yàn)用藥等)進(jìn)行全面排查���,特別是高毒、高活����、中藥與化藥共線等特殊情形 [5]。
2.1 藥品特性的評(píng)估
應(yīng)根據(jù)藥品的毒性��、活性����、致敏性、溶解性等屬性���,識(shí)別其在不同共線場(chǎng)景下的風(fēng)險(xiǎn)等級(jí)��。部分企業(yè)在共線評(píng)估中未對(duì)高毒高活藥品(如抗腫瘤藥)進(jìn)行專門(mén)識(shí)別與控制�,存在較大隱患 [6]。
2.2 工藝與用途的考量
對(duì)于研發(fā)品種與商業(yè)化產(chǎn)品共線�、中藥與化藥共線、最終滅菌與非最終滅菌產(chǎn)品共線等情形��,應(yīng)制定針對(duì)性的控制策略�。如研發(fā)品種應(yīng)在固定生產(chǎn)線或階段性生產(chǎn)后進(jìn)行全面清潔確認(rèn);中藥與化藥共線時(shí)應(yīng)重點(diǎn)評(píng)估化藥對(duì)中藥的污染風(fēng)險(xiǎn)��;若最終滅菌產(chǎn)品與非最終滅菌產(chǎn)品共線生產(chǎn)����,應(yīng)按更高標(biāo)準(zhǔn)執(zhí)行無(wú)菌控制 [4]。
2.3 廠房與設(shè)備的設(shè)計(jì)
合理的空間布局與模塊化設(shè)計(jì)是有效控制交叉污染的重要手段����。例如,口服固體制劑車間可采用“制粒 - 干燥 -壓片 - 包裝”的模塊化分區(qū)方式�,并利用垂直布置減少物料轉(zhuǎn)運(yùn) [2]。此外����,產(chǎn)塵崗位應(yīng)配備負(fù)壓操作間和高效除塵系統(tǒng),以防止粉塵擴(kuò)散����。
Part.03清潔驗(yàn)證與殘留限度控制
清潔驗(yàn)證是共線生產(chǎn)的核心環(huán)節(jié)����,其目的是證明清潔工藝能夠?qū)⒒钚猿煞?���、清潔劑等污染物去除至可接受水平�。清潔?yàn)證中存在的主要問(wèn)題包括殘留限度設(shè)定不合理、檢測(cè)方法不驗(yàn)證����、清潔范圍不全面等 [3]。
3.1 殘留限度計(jì)算方法
傳統(tǒng)的殘留限度計(jì)算方法包括:1/1000 最低日治療劑量法����、10 ppm 法等。近年來(lái)���,基于毒理學(xué)的允許日暴露量(PDE)或基于健康的暴露限度(HBEL)方法被廣泛推薦�����。歐盟 EMA 及 ICHQ3C 均提供了 PDE 的計(jì)算方法��,其公式為:
式中�����,NOAEL 為無(wú)可見(jiàn)有害作用水平�����;F1 ~ F5 為各種修正因子����。
3.2 清潔驗(yàn)證實(shí)例
清潔驗(yàn)證中活性物質(zhì)殘留限度的計(jì)算直接影響清潔效果的判斷,確定活性物質(zhì)殘留限度是清潔驗(yàn)證計(jì)劃中的關(guān)鍵要素�。參照 PDA 技術(shù)文件,限度應(yīng)該務(wù)實(shí)����、可確認(rèn)、可達(dá)到且科學(xué)合理��。在 1/1000 最低日治療劑量�、10 ppm 等傳統(tǒng)方法基礎(chǔ)上,規(guī)范增加了基于毒理學(xué)的暴露限度(如 PDE 值)的可接受標(biāo)準(zhǔn)���,但未列明具體計(jì)算方法��。
清潔驗(yàn)證活性物質(zhì)殘留限度計(jì)算舉例說(shuō)明(僅供參考):Ld 為最大允許殘留�;B 為下一批產(chǎn)品,批量為3000 L ����;LDD 為每日最多使用制劑數(shù),為 2 L �;SA 為與活性成分直接接觸設(shè)備面積,為 160000 cm2 �����;F 為安全因子����,本次驗(yàn)證計(jì)算取 10 �;MF2 為修正因子,本次驗(yàn)證計(jì)算取 1000 ��;NOAEL為無(wú)可見(jiàn)作用水平�����,為 600 g��。默認(rèn)限度 10 ppm 標(biāo)準(zhǔn)計(jì)算:
基于毒性的暴露限度標(biāo)準(zhǔn)計(jì)算:
將兩者計(jì)算結(jié)果綜合進(jìn)行比對(duì),選擇限度較低的 18.75 μg/cm2 作為清潔驗(yàn)證可接受標(biāo)準(zhǔn)��?����;诙纠淼臍埩粝薅扔?jì)算方法可以參考?xì)W盟公布的“在共用設(shè)施中生產(chǎn)不同藥品使用風(fēng)險(xiǎn)辨識(shí)建立健康暴露限度指南”��。
企業(yè)應(yīng)在產(chǎn)品研發(fā)階段就收集毒理學(xué)數(shù)據(jù)����,為后續(xù)清潔驗(yàn)證提供科學(xué)依據(jù) [6]。
Part.04共線生產(chǎn)的持續(xù)改進(jìn)與監(jiān)管建議
共線質(zhì)量管理應(yīng)貫穿藥品全生命周期�。持有人應(yīng)定期開(kāi)展共線生產(chǎn)回顧分析,及時(shí)識(shí)別新風(fēng)險(xiǎn)�,更新控制策略 [5]。此外�����,監(jiān)管部門(mén)應(yīng)在許可檢查���、日常檢查中加強(qiáng)對(duì)共線評(píng)估報(bào)告��、清潔驗(yàn)證記錄��、清場(chǎng)操作等內(nèi)容的審查���。
企業(yè)還應(yīng)加強(qiáng)人員培訓(xùn)����,確保操作人員熟悉共線管理制度與清潔程序�����,避免因人為因素導(dǎo)致污染或混淆�����。
Part.05結(jié)論
藥品共線生產(chǎn)在提升經(jīng)濟(jì)效益的同時(shí)��,也帶來(lái)了復(fù)雜的質(zhì)量風(fēng)險(xiǎn)����。企業(yè)應(yīng)在《藥品共線生產(chǎn)質(zhì)量風(fēng)險(xiǎn)管理指南》的框架下�����,建立科學(xué)的共線評(píng)估體系���,完善清潔驗(yàn)證方法�,落實(shí)持有人主體責(zé)任,并通過(guò)持續(xù)改進(jìn)與監(jiān)管協(xié)同��,確保共線生產(chǎn)的藥品質(zhì)量安全可控����。
參考文獻(xiàn)
[1] 中華人民共和國(guó)衛(wèi)生部. 藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂)[S].衛(wèi)生部令第79號(hào). 2011.
[2] 楊軍. 藥品共線生產(chǎn)的風(fēng)險(xiǎn)及控制[J]. 山東化工,2018�,47(11):116-120.
[3] 樓雙鳳,曹輝�,張闖. 藥品共線生產(chǎn)問(wèn)題分析及建議[J]. 中國(guó)醫(yī)藥工業(yè)雜志,2022���,53(7):1062-1065.
[4] 國(guó)家藥品監(jiān)督管理局食品藥品審核查驗(yàn)中心. 關(guān)于發(fā)布《藥品共線生產(chǎn)質(zhì)量風(fēng)險(xiǎn)管理指南》的通告[EB/OL]. (2023-03-06). https://www.cfdi.org.cn/cfdi/resource/news/15186.html.
[5] 湖南省藥品監(jiān)督管理局關(guān)于加強(qiáng)藥品共線生產(chǎn)監(jiān)督管理的通知[EB/OL]. (2024-02-08). https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20230306174925137.html.