本案例聚焦于單克隆抗體(mAb)的開發(fā)����。在非臨床研究中,單抗藥物的毒理學(xué)試驗種屬以猴為主(通常±大鼠)���。選擇動物模型的核心依據(jù)是藥理相關(guān)性,即候選抗體是否能與該種屬的靶點(diǎn)結(jié)合����,并最好能引發(fā)生物學(xué)效應(yīng)(如藥效終點(diǎn))���,這一標(biāo)準(zhǔn)優(yōu)先于序列同源性。若該抗體僅與人和猴的靶點(diǎn)結(jié)合�,則無需開展嚙齒類毒理研究。但若其也能結(jié)合大鼠/小鼠靶點(diǎn)���,則應(yīng)補(bǔ)充嚙齒類毒理試驗���。給藥途徑通常根據(jù)擬用臨床給藥方式確定,常見為靜脈(IV)���。
由于單抗在體內(nèi)最終被降解為氨基酸���,一般無需開展傳統(tǒng)意義上的藥物代謝研究。
劑量選擇通?��;谀褪苄曰蜃畲罂尚袆┝?。不過�,更常見的是,最高劑量設(shè)定為人體計劃最高暴露量的10倍���,以確保安全邊際����。
需特別注意的是,候選藥物本身是人源分子�,因此在動物體內(nèi)可能誘發(fā)抗藥抗體(ADA)。但動物中出現(xiàn)ADA���,并不意味著人體也會產(chǎn)生���。大多數(shù)針對治療性單抗的ADA靶向其可變區(qū)抗原結(jié)合位點(diǎn),可能干擾靶點(diǎn)結(jié)合���;改變藥物清除率(加快或減慢)����;具有中和活性���;或完全無影響�。當(dāng)ADA滴度(濃度)足夠高且持續(xù)存在時����,會與藥物形成藥物-ADA免疫復(fù)合物����,從而顯著改變藥代動力學(xué)(PK)�,直接降低藥效�。
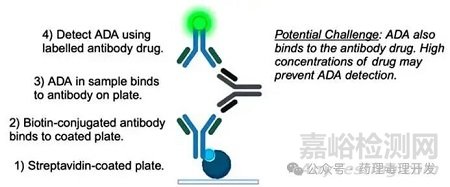
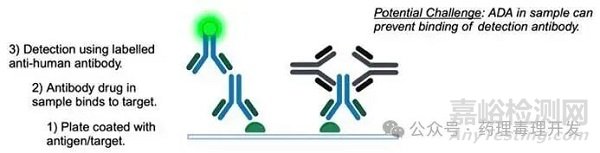
常用ADA檢測方法如下圖所示,但存在明顯局限:
局限性主要體現(xiàn)在藥物耐受性不足����。當(dāng)體內(nèi)藥物濃度很高時,ADA信號可能被掩蓋導(dǎo)致假陰性���。這一問題在動物研究中尤為突出�,因為動物給藥后采樣窗口短(通常僅1-2周)���,藥物暴露量約為人體的10倍���,更易形成免疫復(fù)合物。因此���,即使ADA檢測結(jié)果為陰性����,若觀察到藥物暴露突然消失,仍應(yīng)高度懷疑ADA形成�。此時需綜合評估暴露丟失發(fā)生的時間(ADA通常需約2周才產(chǎn)生);受影響動物數(shù)量����;給藥劑量;其他ADA間接證據(jù)(如PK異常���、組織病理變化等)���。
臨床前的藥物暴露通常通過“抗原包被法”檢測:將靶抗原固定于板上;加入樣本���,若含藥物抗體���,則與其結(jié)合;再用標(biāo)記的抗人抗體檢測結(jié)合的藥物���。ADA可能阻斷藥物與靶抗原的結(jié)合����,導(dǎo)致假性“無暴露”���。
因此�,當(dāng)檢測不到藥物時,必須結(jié)合時間窗�、動物數(shù)量、劑量及其他ADA證據(jù)進(jìn)行綜合判斷�。
免疫復(fù)合物(IC)形成是單抗藥物開發(fā)的另一挑戰(zhàn)���。IC的形成具有以下特點(diǎn):不一定呈劑量依賴性�;通常僅出現(xiàn)在部分動物中����;可在特定解剖部位沉積,引發(fā)免疫復(fù)合物性血管炎�,常見于腎小球、肺�、腦、小動脈分叉處(可能因血流湍流所致)�。
在猴研究中,可通過免疫組化確認(rèn)IC沉積:染色檢測人源IgG(藥物)���、猴補(bǔ)體���、猴IgG/IgM(提示ADA存在)����。雖然IC相關(guān)病變對動物健康確屬不良反應(yīng)�,但若人體未產(chǎn)生ADA,則此類毒性對人類的預(yù)測價值存疑���,其臨床相關(guān)性應(yīng)謹(jǐn)慎評估����。
分享個具體案例
一種靶向新型炎癥通路的IgG類單抗�,在大鼠和猴中開展了為期1個月的重復(fù)給藥毒性研究。
關(guān)鍵非臨床數(shù)據(jù)如下:
大鼠試驗
劑量:0�、10、30���、100mg/kg/周
結(jié)果:未觀察到明顯毒性效應(yīng)����,但給藥2周后體內(nèi)已檢測不到藥物暴露(提示可能產(chǎn)生抗藥抗體ADA)����。
猴試驗
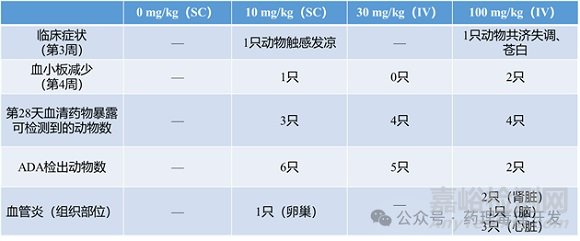
劑量:0、10、30����、100mg/kg/周(每組n=6)
給藥途徑:皮下(SC)和靜脈(IV)
具體結(jié)果見下表。
決策前需思考的問題:是否存在不良反應(yīng)�?若有,是否提示對人類存在潛在危害�?為什么?大鼠和猴的“未觀察到不良反應(yīng)劑量水平”(NOAEL)����?基于這些數(shù)據(jù)���,建議的人體起始劑量和最大劑量是多少����?若推進(jìn)至臨床�,應(yīng)采取哪些風(fēng)險控制措施?
關(guān)于不良反應(yīng):猴在100mg/kg/周劑量下出現(xiàn)不良反應(yīng)(如免疫復(fù)合物沉積����、血管炎等),但這些效應(yīng)很可能由ADA引起����。若人體不產(chǎn)生ADA�,則此類毒性對人類的相關(guān)性存疑����,未必構(gòu)成真實(shí)風(fēng)險。
NOAEL確定:大鼠NOAEL=100mg/kg/周(盡管無暴露����,但未見毒性);
猴NOAEL=30mg/kg/周(100mg/kg劑量出現(xiàn)不良反應(yīng))�。
人體劑量建議:起始劑量通常參考最低NOAEL(即猴的30mg/kg/周),并采用10倍安全系數(shù)���,建議起始劑量為3mg/kg�。
若有其他藥理學(xué)數(shù)據(jù)(如MABEL�,最小預(yù)期生物效應(yīng)水平),也應(yīng)納入考量����。
最大劑量無需預(yù)先設(shè)定上限,可依據(jù)人體安全性���、暴露水平和藥效數(shù)據(jù)逐步遞增���。
臨床風(fēng)險管理措施:考慮到臨床前猴毒理出現(xiàn)的不良反應(yīng)和潛在IC影響����,在臨床試驗中�,需密切監(jiān)測受試者是否出現(xiàn)超敏反應(yīng);定期檢測ADA���,評估其對藥代動力學(xué)�、藥效及安全性的影響����。