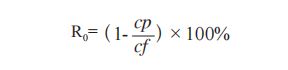去內(nèi)毒素超濾是非蒸餾注射用水終端過(guò)濾的重要工藝����,超濾膜的質(zhì)量對(duì)注射用水中關(guān)鍵質(zhì)量指標(biāo)——內(nèi)毒素的控制至關(guān)重要����,直接影響患者用藥安全����。本文闡述了內(nèi)毒素在水中的狀態(tài)及其分子形態(tài)��,并分析解讀了美國(guó)和日本藥典對(duì)超濾膜截留限的設(shè)定依據(jù)。通過(guò)對(duì)超濾膜的分子量截留��、膜塊完整性����、相容性、膜挑戰(zhàn)性及使用壽命的驗(yàn)證�����,保證超濾膜在制水工藝中的穩(wěn)定性與可靠性��。
反滲透技術(shù)能夠去除絕大多數(shù)導(dǎo)電性離子和足夠的總有機(jī)碳(TOC),同時(shí)還能去除微生物和細(xì)菌內(nèi)毒素 [1]����。超濾則通過(guò)分子量篩分手段�����,進(jìn)一步去除水中內(nèi)毒素��,以確保進(jìn)入存儲(chǔ)分配系統(tǒng)的水質(zhì)內(nèi)毒素得到控制�����。反滲透與超濾的適當(dāng)組合及應(yīng)用��,構(gòu)成了非蒸餾注射用水制備工藝的基礎(chǔ)����。本文旨在簡(jiǎn)要介紹終端超濾非蒸餾注射用水的設(shè)計(jì)原理及其驗(yàn)證要點(diǎn)����。
Part1��、內(nèi)毒素與截留限
內(nèi)毒素單體是脂多糖(LPS)分子����,其分子量較大�����,通常約為 10000 Da,甚至更高�����。由于脂質(zhì)和多糖含量的差異��,單體的大小范圍可能從約 6000 Da 到遠(yuǎn)超 10000 Da 不等(見(jiàn)圖 1)��。然而����,在純水中����,由于該分子具有兩親性�����,既包含親水區(qū)域又包含疏水區(qū)域����,內(nèi)毒素單體較少以單個(gè)實(shí)體的形式存在�����。
圖 1 內(nèi)毒素單體結(jié)構(gòu) [7]
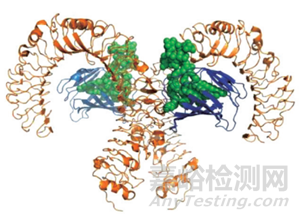
在水中�����,內(nèi)毒素單體往往會(huì)聚集在一起�����,形成由眾多單體構(gòu)成的微小膠質(zhì)分子束����。這些膠束分子中��,親水性的多糖端位于球體外側(cè)����,與水接觸��;而疏水性的脂質(zhì)端則相互聚集在球體內(nèi)側(cè),遠(yuǎn)離水的位置�����。膠束的總分子量可遠(yuǎn)超100 萬(wàn)道爾頓(見(jiàn)圖 2)��。死亡的革蘭氏陰性細(xì)菌的細(xì)胞膜碎片仍可能包含其部分結(jié)構(gòu)����,包括一些內(nèi)毒素成分,所以這種形式的內(nèi)毒素(分子量)甚至可能比膠質(zhì)分子束更大��?����;钪幕騽偹劳龅?xì)胞結(jié)構(gòu)仍完整的革蘭氏陰性菌細(xì)胞,其外層細(xì)胞膜表面也可能含有活性?xún)?nèi)毒素����。從這些在水中存在的內(nèi)毒素物質(zhì)來(lái)看,即使截留分子量為 100000 Da 或更大分子量的超濾器也能從純水中過(guò)濾掉絕大部分內(nèi)毒素�����。然而��,為確保安全��,美國(guó)藥典(USP<1231>USP39 - NF 34 第二增補(bǔ)本)規(guī)定的截留限為10000 ~ 20000 Da ��;而日本藥典更為謹(jǐn)慎����,規(guī)定的截留限為 6000 Da��,這可能已處于超濾模塊截留點(diǎn)的下限 [1]�����。
圖 2 內(nèi)毒素膠質(zhì)分子束 [8]
Part2����、超濾膜與中孔纖維膜塊
最早使用的超濾膜源自天然的動(dòng)物臟器薄膜����。1861 年,Schmidt 首次公開(kāi)了利用牛心胞膜截留可溶性阿拉伯膠的實(shí)驗(yàn)結(jié)果��。1867 年,Traube 在多孔瓷板上通過(guò)膠凝沉淀鐵氰化銅�����,成功制備了第一張人工膜����。1907 年��,Bechhold系統(tǒng)地研究了超濾膜��,并首次引入了“超濾”這一術(shù)語(yǔ)��。然而,在此后的多年里��,超濾膜技術(shù)發(fā)展陷入停滯�����,直到 1963年����,Michaels 創(chuàng)立了 Amicon 公司��,專(zhuān)注于生產(chǎn)和銷(xiāo)售各類(lèi)截留分子量的超濾膜����,隨后短短幾年內(nèi)����,超濾膜技術(shù)取得了顯著進(jìn)步��,各種結(jié)構(gòu)形式的超濾裝置也相繼出現(xiàn)����。1965 年后�����,多家公司推出了多種聚合物超濾膜��。目 前, 超 濾 膜 的 材 質(zhì) 涵 蓋 PS����、PAN、PSA��、PP��、PE、PVDF����、 陶 瓷����、玻璃和金屬等十余種�����,超濾模塊則包括板框式�����、管式��、卷式和中空纖維式四種結(jié)構(gòu)�����。在制藥用水工藝中,中空纖維模塊因其優(yōu)越性能而被廣泛推薦為最常用的超濾模塊�����,其超濾材料多為聚合物����。中空聚合物纖維超濾模塊如圖3所示[1]�����。
圖 3 中空纖維超濾模塊(左圖 [1])
制藥用水終端和中空纖維通常由聚合物材料制成,常見(jiàn)材料為聚砜或聚醚砜�����。中空纖維結(jié)構(gòu)中始終包含一個(gè)支撐層和至少一個(gè)��、最多兩個(gè)活性分離層(見(jiàn)圖 4)��。此外�����,大多數(shù)中空纖維均封裝在塑料或不銹鋼外殼內(nèi)�����。澆鑄化合物確保進(jìn)料側(cè)��、濃縮液側(cè)與濾液側(cè)有效隔離�����,使得中空纖維組件在此處無(wú)需額外密封��,進(jìn)料、濃縮液和濾液通過(guò)各自的連接口進(jìn)行進(jìn)料和排放����。
圖 4 由聚醚砜制成的超濾膜結(jié)構(gòu)中�����,頂部的活性分離層清晰可見(jiàn)�����,其下方為支撐層 [2]
Part3��、超濾模塊的運(yùn)行
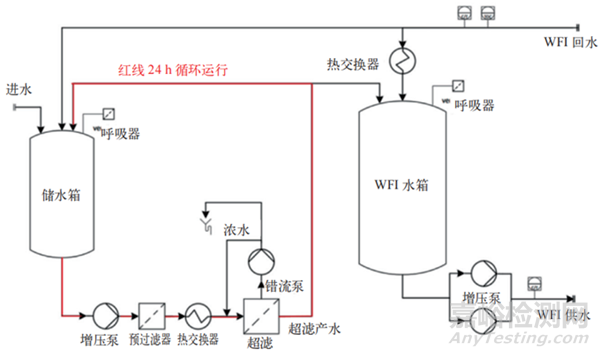
制藥用水終端超濾模塊的運(yùn)行方式分為低流量錯(cuò)流過(guò)濾和死端過(guò)濾兩種。低流量錯(cuò)流過(guò)濾過(guò)程中��,約有 2%的進(jìn)水以濃水形式持續(xù)排放��,再加上定期反沖洗以清除積聚在過(guò)濾面上的內(nèi)毒素�����、有機(jī)物和生物碎片��,其廢液排放量可達(dá)進(jìn)水量的 5% 左右(具體視裝置設(shè)計(jì)而定)。為防止終端過(guò)濾產(chǎn)生生物膜����,終端過(guò)濾設(shè)計(jì)為 24 h 不間斷運(yùn)行(見(jiàn)圖 5),因此其廢液排放量也相當(dāng)可觀(guān)����。由于反沖洗無(wú)法徹底清除粘附在超濾表面的污染物(包括微生物)����,超濾系統(tǒng)須頻繁進(jìn)行消毒處理。對(duì)于小流量錯(cuò)流過(guò)濾����,其使用壽命一般為 1 ~ 2 年 [3]����。
圖 5 終端超濾運(yùn)行流程圖
錯(cuò)流過(guò)濾產(chǎn)生的額外濃水限制了其應(yīng)用范圍。另一種運(yùn)行方式為超濾死端過(guò)濾����,這種模式不排放濃水。在使用超濾的場(chǎng)所(通常位于凈化系統(tǒng)的最后一個(gè)單元操作后或分配系統(tǒng)的回路中)�����,由于水中的內(nèi)毒素負(fù)荷或熱原水平非常低,因此在內(nèi)毒素飽和或其他生物污染導(dǎo)致需要更換超濾膜之前��,其使用壽命可能相當(dāng)長(zhǎng)��。這種運(yùn)行方式通常不進(jìn)行反沖洗��,在沒(méi)有濃水沖洗和反沖洗的情況下,跨膜壓差的增加速度比錯(cuò)流過(guò)濾更快�����。更有可能的是��,其他大分子有機(jī)物(如 TOC)、顆粒和死的或活的細(xì)菌細(xì)胞會(huì)在過(guò)濾內(nèi)毒素之前堵塞可過(guò)濾的表面��,而濾液流量的減少通常是接近飽和的跡象����。一些監(jiān)管機(jī)構(gòu)和從業(yè)人員擔(dān)心��,當(dāng)超濾器面臨跨膜高壓差的過(guò)度挑戰(zhàn)時(shí)��,內(nèi)毒素可能通過(guò)超濾膜上的孔或膜與密封中的微小缺陷滲透 [1]�����。應(yīng)遵循UF 制造商關(guān)于最大壓差的建議����。然而�����,當(dāng)觀(guān)察到通過(guò)這些過(guò)濾器的流速下降時(shí)��,更換過(guò)濾器以恢復(fù)流速可以緩解內(nèi)毒素滲透的擔(dān)憂(yōu)��。對(duì)于死端過(guò)濾的運(yùn)行��,其通常使用壽命為 1 年 [3]��。這兩種運(yùn)行模式都會(huì)在超濾膜的過(guò)濾表面富集微生物和內(nèi)毒素��,死端過(guò)濾的跨膜壓差增加速度更快于小流量錯(cuò)流過(guò)濾�����。超濾膜過(guò)濾表面富集的微生物和內(nèi)毒素增加了生物膜的風(fēng)險(xiǎn)����,因此必須頻繁消毒。根據(jù) EMA“關(guān)于非蒸餾法生產(chǎn)注射用水的問(wèn)題和答案——反滲透和生物膜以及控制策略”����,[4-5] 應(yīng)采用熱消毒和化學(xué)消毒相結(jié)合的消毒策略。
Part4�����、超濾膜的驗(yàn)證
4.1����、超濾膜截留分子量的驗(yàn)證
同液體除菌過(guò)濾需采用生物Brevundimonas diminuta ATCC® 19146TM(缺陷短波單胞菌)進(jìn)行挑戰(zhàn)試驗(yàn)類(lèi)似�����,超濾膜的截留性能測(cè)試也需選擇適當(dāng)?shù)奶魬?zhàn)標(biāo)準(zhǔn)品。常用于測(cè)定膜截留分子量的標(biāo)準(zhǔn)物質(zhì)主要包括:
球形蛋白類(lèi):γ- 球蛋白(M平w=16 萬(wàn))����、牛血清白蛋白(M平w=6.7 萬(wàn))�����、卵清蛋白(M平w=4.4 萬(wàn))��、胃蛋白酶(M平w=3.5 萬(wàn))�����、細(xì)胞色素C(M平w=1.24 萬(wàn))、胰島素(M平w=0.57 萬(wàn) )����、VB12(M平w=0.12 萬(wàn))����;
分枝多糖類(lèi):葡聚糖250(M平w=23.6 萬(wàn))��、葡聚糖110(M平w=10 萬(wàn))、葡聚糖 40(M平w=4 萬(wàn))�����、葡聚糖10(M平w=1 萬(wàn))[6]��。
上述與內(nèi)毒素分子量最相近的是胰島素(M平w=0.57 萬(wàn))和葡聚糖 10(M平w=1 萬(wàn))�����。鑒定超濾的溶質(zhì)通常包括胰島素(球狀分子)和葡聚糖(長(zhǎng)鏈分子)。像胰島素這樣的球狀分子比像葡聚糖這樣的長(zhǎng)鏈分子更有可能被截留��。而內(nèi)毒素的分子結(jié)構(gòu)更接近于長(zhǎng)鏈分子(見(jiàn)圖2)��。因此,葡聚糖 10 在生物技術(shù)行業(yè)常用于確定截留限值��。截留率可以通過(guò)如下公式計(jì)算
式中:R0 為截留率(%)�����;Cp 為透過(guò)葡聚糖濃度(mg/L)��;Cf 為原液葡聚糖濃度(mg/L)�����。若測(cè)得的截留率在 95% 以上��,則可以判定該膜符合所標(biāo)稱(chēng)的截留分子量。
藥品制造商必須了解用于確定截留限的超濾模塊的測(cè)試條件����,這樣才能屏蔽單體內(nèi)毒素進(jìn)入產(chǎn)品水中����。
4.2����、完整性測(cè)試
超濾模塊在使用前必須驗(yàn)證其完整性��,常見(jiàn)的完整性測(cè)試方法包括起泡點(diǎn)測(cè)試、針孔測(cè)試����、保壓試驗(yàn)��。進(jìn)行起泡點(diǎn)測(cè)試時(shí)�����,首先將模塊的進(jìn)水側(cè)排空�����,并通入經(jīng)無(wú)菌過(guò)濾的壓縮空氣(或氮?dú)猓T跐B透?jìng)?cè)連接一根透明軟管��,將進(jìn)水側(cè)的壓力設(shè)定為規(guī)定泡點(diǎn)值的約80%��。然后緩慢增加壓力,直至在滲透?jìng)?cè)觀(guān)察到氣流出現(xiàn)��,此時(shí)記錄系統(tǒng)中的壓力以確定泡點(diǎn)����。然而�����,中空纖維超濾膜的超濾膜絲在超濾外殼內(nèi)懸掛��,沒(méi)有任何物理支撐����,而無(wú)菌過(guò)濾器的過(guò)濾膜則是包裹在內(nèi)支撐架上的��。因此,存在一種風(fēng)險(xiǎn):超濾(UF)膜后部膨脹的壓縮空氣可能對(duì)超濾膜絲造成損傷����?����;诖?����,采用聚合材料膜制成的超濾模塊不建議進(jìn)行這樣的測(cè)試�����。相反,應(yīng)對(duì)這類(lèi)模塊進(jìn)行針孔試驗(yàn)(氣體擴(kuò)散試驗(yàn))����。根據(jù)菲克定律�����,在泡點(diǎn)條件下�����,顆粒也會(huì)通過(guò)超濾膜發(fā)生擴(kuò)散。通過(guò)測(cè)量擴(kuò)散的空氣流量��,并從一定的最小過(guò)濾器表面積開(kāi)始��,可以進(jìn)行可重復(fù)的測(cè)量。氣體通過(guò)模塊的擴(kuò)散速率能夠提供有關(guān)過(guò)濾器完整性的結(jié)論。對(duì)于由聚合材料膜制成的超濾模塊����,此測(cè)試無(wú)疑是首選方法��。
4.3����、相容性測(cè)試
在生產(chǎn)注射劑時(shí)��,必須確保所使用的材料不會(huì)對(duì)藥物或患者健康產(chǎn)生有害影響��。因此����,以下兩條中的任何一個(gè)都必須得到證明并確認(rèn):a :不能從材料中提取出顯著(可能有害)數(shù)量的物質(zhì)����;b :提取出來(lái)的物質(zhì)對(duì)健康無(wú)害。根據(jù)美國(guó)藥典通則 <1663> 和歐洲藥典第 3.2 章��,必須提供與產(chǎn)品接觸的材料(不僅限于內(nèi)包裝材料)所需的適當(dāng)證明(資料)�����。此外,除了根據(jù) 21 CFR 170-189 提供常規(guī)材料證明外�����,對(duì)于腸外注射溶液還必須進(jìn)行可浸出物和可提取物研究��。由于超濾模塊是最終的純化段����,此時(shí)要評(píng)估的是產(chǎn)品水����。超濾膜不僅要在常溫下運(yùn)行,還需頻繁進(jìn)行熱消毒和化學(xué)消毒(EMA “問(wèn)題和答案”雙管齊下的消毒策略)����,因此超濾膜須進(jìn)行可浸出物(常態(tài)運(yùn)行下)和可提取物(高溫和化學(xué)消毒下)的相容性測(cè)試。模塊制造商需提供測(cè)試合格的書(shū)面資料�����。
4.4�����、內(nèi)毒素的挑戰(zhàn)試驗(yàn)
注射用水中的內(nèi)毒素標(biāo)準(zhǔn)限值為< 0.25 EU/ml。內(nèi)毒素是某些革蘭氏陰性菌細(xì)胞壁的成分�����。在滅菌領(lǐng)域��,熱原去除需達(dá)到 3 個(gè)對(duì)數(shù)級(jí)����。模塊制造商應(yīng)能提供其模塊類(lèi)型去除性能書(shū)面證據(jù)。
4.5�����、質(zhì)保期和使用壽命
超濾膜的質(zhì)保期和使用壽命與膜的材料和運(yùn)行方式密切相關(guān)����,特別是消毒頻率和消毒溫度對(duì)超濾膜模塊的使用壽命有重大影響。藥品制造廠(chǎng)需在供應(yīng)商給出的建議下運(yùn)行和消毒����,并通過(guò)驗(yàn)證確定膜的更換周期,以確保在膜質(zhì)量有保證的條件下穩(wěn)定運(yùn)行��。
Part4、總結(jié)
使用膜法技術(shù)能夠安全地生產(chǎn)注射用水�����。其終端超濾單元的多項(xiàng)質(zhì)量指標(biāo)性能直接影響注射用水的關(guān)鍵質(zhì)量屬性�����。為此,對(duì)注射用水系統(tǒng)�����,尤其是最終處理段進(jìn)行全面確認(rèn)被列為重中之重��。本文依據(jù)法規(guī)要求��,從驗(yàn)證角度出發(fā)�����,提出了終端超濾的五個(gè)驗(yàn)證要求,為膜法注射用水系統(tǒng)的設(shè)計(jì)�����、監(jiān)管�����、業(yè)主等多部門(mén)提供了實(shí)用的指導(dǎo)。
參考文獻(xiàn)
[1] ISPE. Good Practice Guide: MembraneBased Water for Injection Systems[M].2022.
[2] ISPE D/A/CH Affiliate.ISPE D/A/CH Affiliate: Production of Water for Injection without Distillation Handbook[M]. 2021.
[3] JAMES A��,PHIL D,ANTHONY G����,et al. Handbook of Validation in Pharmaceutical Processes[M]. 4th ed. CRC Press, 2021.
[4] EUROPEAN MEDICINES AGENCY. Guideline on the quality of water for pharmaceutical use[EB/OL]. (2020-07-20)[2025-11-18]. https://www.ema. europa.eu/en/documents/scientificguideline/guideline-quality-waterpharmaceutical-use_en.pdf.
[5] EUROPEAN MEDICINES AGENCY. Questions and answers on production of water for injections by non-distillation methods–reverseosmosis and biofilms and control strategies[EB/OL]. (2017-08-01)[2025-11-18]. www.ema.europa.eu.
[6] 時(shí)鈞,袁權(quán)��,高從堦. 膜技術(shù)手冊(cè)[M]. 北京:化學(xué)工業(yè)出版社����,2001.
[7] PDA. Technical Report No. 82: Low Endotoxin Recovery (LER)[R].Bethesda: PDA, 2019: Report No.43539. ISBN 9781945584077.
[8] h t t p : / / i n i . s a g e p u b . c o m /content/17/5/427.