生物制劑生產(chǎn)包含多個關(guān)鍵步驟,先通過上游工藝(如細(xì)胞接種與擴增)和下游工藝(如細(xì)胞收獲��、純化����、病毒去除)生產(chǎn)原液(DS),再進行制劑(DP)的配制與灌裝等工作����。在藥物研發(fā)中,為實現(xiàn)生產(chǎn)規(guī)模擴大與工藝優(yōu)化��,生產(chǎn)流程或地點難免發(fā)生變更��,這一過程被稱為“產(chǎn)品開發(fā)”����。
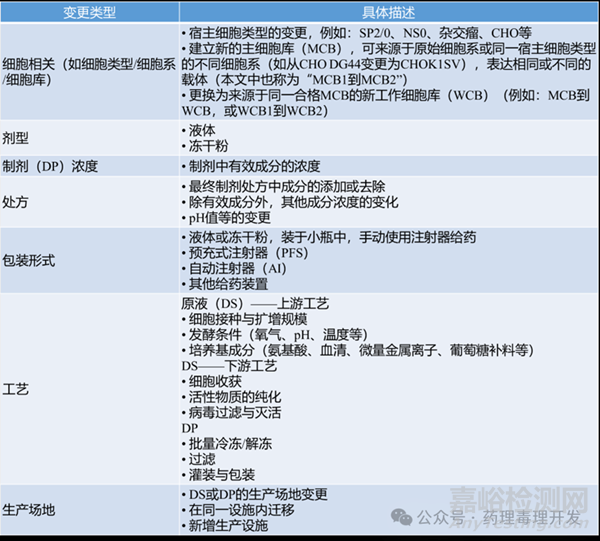
常見變更類型很多,且不同變更之間可能還存在關(guān)聯(lián)�����。比如場地變更與工藝變更常同步發(fā)生�����,因生產(chǎn)工藝通常需針對特定設(shè)施定制。細(xì)胞相關(guān)變更必然伴隨工藝調(diào)整以適配不同細(xì)胞系����,例如為優(yōu)化新細(xì)胞(如從Sp2/0細(xì)胞轉(zhuǎn)為中國倉鼠卵巢細(xì)胞CHO)生長,常需使用新培養(yǎng)基�����。生產(chǎn)規(guī)模擴大與新工作細(xì)胞庫(WCB)啟用����,需更換更大生物反應(yīng)器,并調(diào)整培養(yǎng)基����、通氣、營養(yǎng)補料策略�����、pH控制����、過濾及層析條件等����。產(chǎn)品研發(fā)中����,藥物濃度�����、劑型����、配方等也可能變更,以優(yōu)化劑量或給藥方式����。上述生產(chǎn)變更與臨床研發(fā)過程同步進行。
生產(chǎn)變更可能對生物制劑質(zhì)量與臨床表現(xiàn)產(chǎn)生影響��。比如不同細(xì)胞系的翻譯后修飾機制不同��,不同培養(yǎng)條件下細(xì)胞產(chǎn)生的蛋白質(zhì)糖基化譜也可能存在差異��。又如溶解氧濃度會影響細(xì)胞生長速率與核心巖藻糖基化水平����;高氨濃度會降低聚糖結(jié)構(gòu)的末端唾液酸化��,導(dǎo)致等電點(pI)升高��;pH值會影響半乳糖基化與唾液酸化的微觀異質(zhì)性����;培養(yǎng)溫度�����、金屬離子(如Mg²?��、Mn²?)及生產(chǎn)方式(流加培養(yǎng)vs灌注培養(yǎng))也會影響唾液酸化�����。這些都可能對對關(guān)鍵質(zhì)量屬性(CQA)產(chǎn)生影響����。變更對生物學(xué)功能也會產(chǎn)生影響。比如半乳糖基化和唾液酸化產(chǎn)物能增強與FcRn的結(jié)合��,延長單克隆抗體(mAbs)和Fc融合蛋白的血清循環(huán)半衰期����;唾液酸還可掩蓋半乳糖殘基����,避免其與內(nèi)吞受體ASGPR和甘露糖受體結(jié)合����,進一步延長半衰期�����。去巖藻糖基化會增強與FcγRIIIa的結(jié)合及抗體依賴性細(xì)胞毒性(ADCC)活性����,而唾液酸化會降低該活性。生產(chǎn)變更可能導(dǎo)致治療性蛋白質(zhì)的效價����、溶解度、穩(wěn)定性和生物功能發(fā)生改變��,進而可能影響藥代動力學(xué)(PK)�����、藥效學(xué)(PD)、療效��、免疫原性和安全性等臨床性能��。
為支持生產(chǎn)變更的合理性�����,必須開展可比性評估��,以確認(rèn)變更前后產(chǎn)品的一致性��。由于生物制劑分子與功能的多樣性及生產(chǎn)工藝的復(fù)雜性����,可比性評估需“具體情況具體分析”。當(dāng)前全球生物制劑可比性評估主要遵循ICH Q5E指南����,核心原則包括:1)僅通過藥學(xué)分析研究可能足以證明可比性;2)若分析研究顯示變更前后產(chǎn)品存在差異�����,且特定質(zhì)量屬性與安全性����、有效性的關(guān)聯(lián)未明確�����,可比性評估需結(jié)合非臨床和/或臨床橋接研究�����,以應(yīng)對其對安全有效性可能產(chǎn)生的不利影響的不確定性。
不同變更對產(chǎn)品質(zhì)量��、安全性和有效性的潛在風(fēng)險不同��,評估生產(chǎn)變更時應(yīng)采用風(fēng)險導(dǎo)向方法����。若全身暴露量可預(yù)測臨床療效,開展臨床PK可比性研究有助于解決療效的不確定性����;若PK與療效的關(guān)聯(lián)未明確,或需解決安全性不確定性�����,則需開展其他類型的臨床研究。
FDA對單抗和Fc融合蛋白兩大類生物制劑的藥學(xué)變更和可比性研究進行了分享��。選擇這兩類的原因在于��,它們均含F(xiàn)c片段��,可通過與新生兒Fc受體(FcRn)相互作用獲得理想的PK特性�����,且均常用哺乳動物細(xì)胞表達(dá)系統(tǒng)生產(chǎn)����,生產(chǎn)流程相似。一起來看下FDA分享的經(jīng)驗�����。
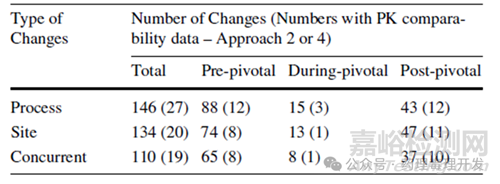
FDA選擇了1996年10月28日至2021年12月25日期間��,通過351(a)生物制品許可申請(BLA)獲批的產(chǎn)品��,最終確定了85種單克隆抗體和10種Fc融合蛋白作為研究對象����。以研究項目中的關(guān)鍵臨床試驗(pivotal clinical studies)為時間參考點��,將已識別的生產(chǎn)變更按發(fā)生時間劃分為三個階段:1)關(guān)鍵試驗前階段(pre-pivotal stage):關(guān)鍵臨床試驗開始前發(fā)生的生產(chǎn)變更��;2)關(guān)鍵試驗期間階段(during-pivotal stage):關(guān)鍵臨床試驗進行過程中發(fā)生的生產(chǎn)變更�����;3)關(guān)鍵試驗后階段(post-pivotal stage):關(guān)鍵臨床試驗結(jié)束后發(fā)生的生產(chǎn)變更�����。具體生產(chǎn)變更類型如下表所示�����。
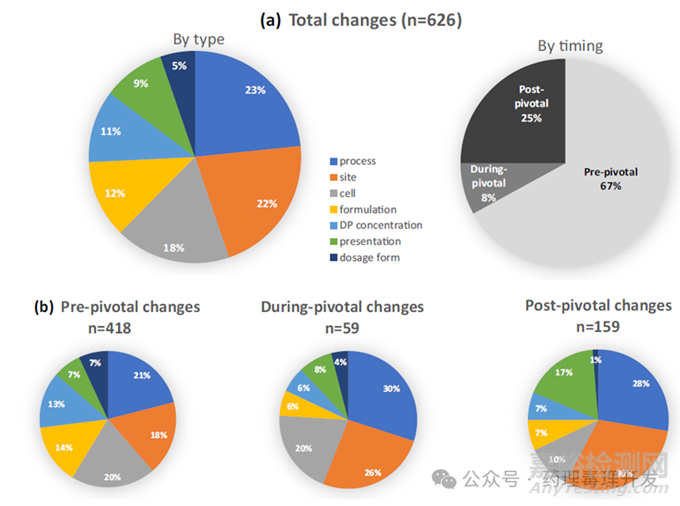
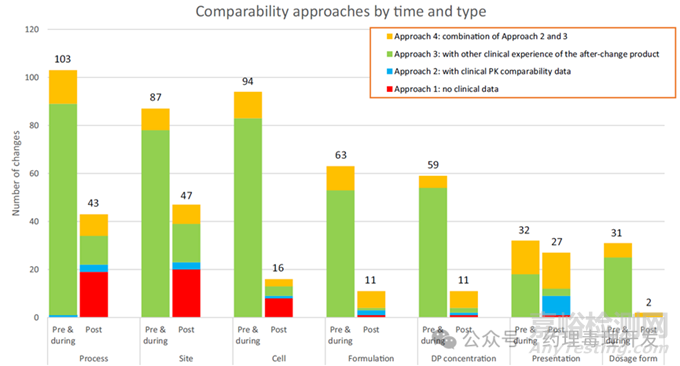
生產(chǎn)變更分布
本次調(diào)查共發(fā)現(xiàn)626項生產(chǎn)變更,涵蓋85種單抗的519項變更����,以及10種Fc融合蛋白的107項變更。
這些變更被歸為7類�����,具體分類及在626項變更中的占比如下:
細(xì)胞變更����、工藝變更����、DS與DP生產(chǎn)場地變更:每類占比約20%����。
制劑配方變更、制劑濃度變更��、產(chǎn)品包裝形式變更:每類占比約10%�����。
劑型變更:占比約5%����。
變更時機分布
626項生產(chǎn)變更分散在三個臨床開發(fā)階段,各階段占比為:
關(guān)鍵研究啟動前(關(guān)鍵研究前階段):占比67%��。
關(guān)鍵研究進行中(關(guān)鍵研究中階段):占比8%�����。
關(guān)鍵研究完成后(關(guān)鍵研究后階段):占比25%。
不同開發(fā)階段的變更類型分布特點
對比7類變更在三個開發(fā)階段的分布�����,發(fā)現(xiàn)以下6項核心結(jié)論:
關(guān)鍵研究前與關(guān)鍵研究中階段�����,工藝變更�����、場地變更��、細(xì)胞變更為最頻繁的三類變更��,各階段合計占比分別約為60%和80%����。
關(guān)鍵研究后階段�����,包裝形式變更與工藝變更��、場地變更共同成為最頻繁的三類變更,三者合計占比75%��。包裝形式變更在關(guān)鍵研究后階段(18%)的發(fā)生頻率����,高于前兩個階段(均為6%-7%)�����。細(xì)胞相關(guān)變更在關(guān)鍵研究后階段(10%)的發(fā)生頻率,低于前兩個階段(均為20%)��。
制劑配方變更與制劑濃度變更在關(guān)鍵研究前階段(各13%-14%)的發(fā)生頻率��,高于關(guān)鍵研究中與關(guān)鍵研究后階段(均為6%-7%)�����。
劑型變更在三個階段均為發(fā)生頻率最低的變更類型。
具體變更情況如下圖所示����。
支持生產(chǎn)變更的可比性數(shù)據(jù)與方法
本次調(diào)查圍繞生產(chǎn)變更后產(chǎn)品的可比性評估�����,明確了核心數(shù)據(jù)類型與對應(yīng)的可比性方法,并結(jié)合變更時機分析了方法的應(yīng)用規(guī)律�����,具體內(nèi)容如下:
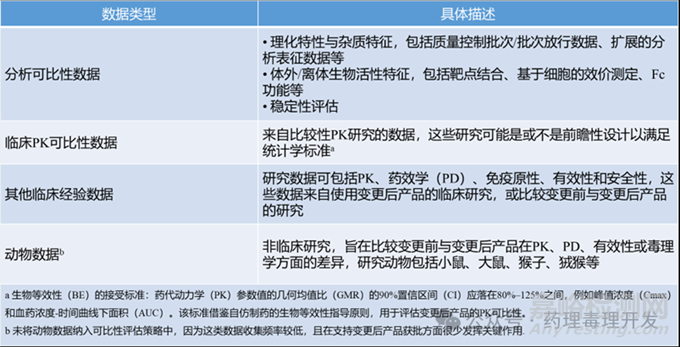
可比性評估的核心數(shù)據(jù)類型
調(diào)查發(fā)現(xiàn)�����,支持變更后產(chǎn)品的可比性評估方案包含4類關(guān)鍵數(shù)據(jù),各類數(shù)據(jù)的定義與范圍如下:
分析可比性數(shù)據(jù):涵蓋各類理化性質(zhì)測試與功能性測試所產(chǎn)生的數(shù)據(jù)��,是可比性評估的基礎(chǔ)組成部分��。
臨床PK可比性數(shù)據(jù):來自對比變更前與變更后產(chǎn)品PK數(shù)據(jù)的研究�����,部分研究為滿足統(tǒng)計評估需求��,會采用傳統(tǒng)生物等效性標(biāo)準(zhǔn)進行前瞻性設(shè)計。
其他臨床經(jīng)驗數(shù)據(jù):包括評估變更后產(chǎn)品PK��、PD、免疫原性��、療效及安全性的研究數(shù)據(jù)��;部分研究雖納入變更前產(chǎn)品,但并非以PK可比性評估為設(shè)計目標(biāo)����。
動物數(shù)據(jù):來源于對比變更前與變更后產(chǎn)品的體內(nèi)動物研究��。需注意的是,僅1份生物制品許可申請(BLA)中僅包含動物數(shù)據(jù)��,未涉及臨床數(shù)據(jù)����。動物數(shù)據(jù)使用頻率較低,在支持變更后產(chǎn)品獲批方面很少發(fā)揮關(guān)鍵作用����。
4類數(shù)據(jù)類型如下表所示:
支持變更后產(chǎn)品的可比性方法分類
基于可比性評估中納入的臨床數(shù)據(jù)類型�����,將支持變更后產(chǎn)品的可比性方法劃分為4類�����,具體定義如下:
方法1:無臨床數(shù)據(jù)�����,僅依賴分析可比性數(shù)據(jù)����。
方法2:包含臨床數(shù)據(jù)��,且數(shù)據(jù)來源于對比變更前與變更后產(chǎn)品的PK可比性研究��。
方法3:包含臨床數(shù)據(jù)�����,且數(shù)據(jù)來源于變更后產(chǎn)品的其他臨床經(jīng)驗��。
方法4:包含臨床數(shù)據(jù)��,且數(shù)據(jù)為方法2與方法3的組合(即同時納入PK可比性研究數(shù)據(jù)與其他臨床經(jīng)驗數(shù)據(jù))����。
不同變更時機下的可比性方法應(yīng)用分析
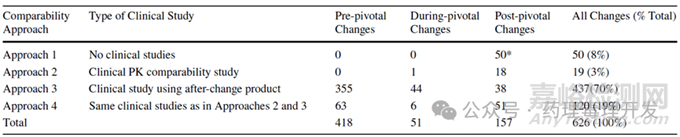
下表總結(jié)了按變更時機(關(guān)鍵研究前階段、關(guān)鍵研究中階段�����、關(guān)鍵研究后階段)劃分的可比性方法應(yīng)用情況��,下圖則按變更類型,將數(shù)據(jù)分為兩組(組1:關(guān)鍵研究前+關(guān)鍵研究中階段;組2:關(guān)鍵研究后階段)進行可視化呈現(xiàn)����。
整體規(guī)律與分階段細(xì)節(jié)如下:
(一)整體應(yīng)用規(guī)律
方法1主要用于支持工藝變更、場地變更與細(xì)胞相關(guān)變更�����。
方法2在所有變更類型中的使用率最低��。
方法3是最常用的方法�����,支持了70%的所有變更�����。
方法4在所有變更類型中的使用率均高于方法2�����。
(二)分階段應(yīng)用細(xì)節(jié)
關(guān)鍵研究前與關(guān)鍵研究中階段的變更
此階段出現(xiàn)的變更����,主要采用方法3,即變更后的產(chǎn)品相關(guān)臨床研究(如上表所示)。換句話說��,大多數(shù)變更(469項中的399項,占比85%)采用方法3��,即依賴變更后產(chǎn)品的其他臨床經(jīng)驗數(shù)據(jù)��。
剩余15%的變更采用方法2或方法4����,這兩類方法均包含臨床PK可比性數(shù)據(jù)����。
這里給出的數(shù)據(jù)就很明顯了,變更要趁早��,最好不要等到關(guān)鍵臨床研究都做完了再行變更��。
關(guān)鍵研究后階段的變更
此階段變更的支持涵蓋全部4類可比性方法����,具體應(yīng)用比例如下:
32%的變更依賴方法1(僅分析可比性數(shù)據(jù))����;
69%的變更依賴包含臨床數(shù)據(jù)的方法��,其中方法2占11%�����、方法3占24%�����、方法4占32%。
方法1支持的變更類型分布:50項采用方法1的關(guān)鍵研究后變更中����,以工藝變更與場地變更為主(各類約20項),其次為細(xì)胞變更��、制劑配方變更��、制劑(DP)濃度變更與產(chǎn)品包裝形式變更�����。
含臨床PK可比性數(shù)據(jù)的方法(方法2+方法4)支持的變更類型比例:不同變更類型中,此類方法的應(yīng)用比例差異顯著,具體為:
劑型變更:2/2����,占比100%�����;
產(chǎn)品包裝形式變更:24/29,占比83%;
制劑配方變更:9/11,占比82%;
制劑(DP)濃度變更:8/11��,占比73%;
工藝變更:12/43�����,占比28%;
細(xì)胞變更:4/15�����,占比27%;
場地變更:11/46�����,占比24%�����。
三種特定變更類型的可比性
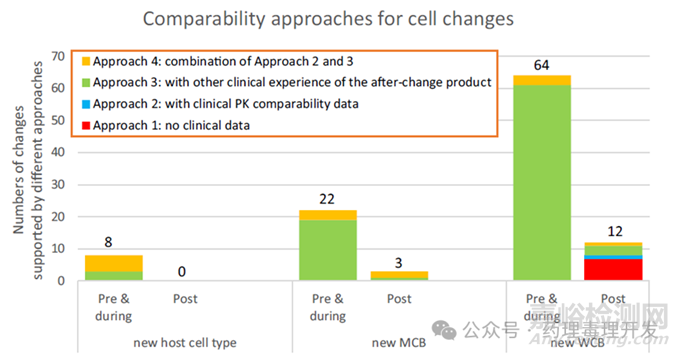
細(xì)胞相關(guān)變更
細(xì)胞相關(guān)變更共109例�����,分為三個子類����,其可比性方法選擇與變更階段強相關(guān)�����。
新宿主細(xì)胞類型變更(8例):僅發(fā)生在關(guān)鍵試驗前階段��,如從SP2/0或雜交瘤細(xì)胞變更為CHO細(xì)胞��。
新主細(xì)胞庫(MCB)變更(25例):88%(22例)發(fā)生在關(guān)鍵試驗前及試驗期間����,關(guān)鍵試驗后極少出現(xiàn)�����。
新工作細(xì)胞庫(WCB)變更(76例):是最頻繁的細(xì)胞相關(guān)變更�����,各階段均有發(fā)生。
可比性方法選擇
新宿主細(xì)胞類型變更:8例均采用變更后產(chǎn)品開展后續(xù)臨床試驗��,其中3例遵循方法3����,5例結(jié)合臨床PK可比性及其他臨床經(jīng)驗(方法4)。
新MCB變更:所有階段的變更均需臨床數(shù)據(jù)支持�����,采用方法3或4�����。
新WCB變更:關(guān)鍵試驗后變更(12例)方法多樣��,7例僅用分析可比性數(shù)據(jù)(方法1)��,5例用臨床數(shù)據(jù)(1例方法2、3例方法3�����、1例方法4)�����;其中3例無其他并發(fā)變更的變更均采用方法1�����,其余9例因存在并發(fā)變更����,方法選擇受到影響。
核心趨勢總結(jié)
86%(101例中的86例)的細(xì)胞相關(guān)變更發(fā)生在關(guān)鍵試驗前階段����。
新宿主細(xì)胞類型變更數(shù)量最少且僅在關(guān)鍵試驗前發(fā)生,但采用PK可比性研究支持的比例最高��。
新MCB變更關(guān)鍵試驗后極少發(fā)生�����,且始終需臨床數(shù)據(jù)支持。
新WCB變更頻繁�����,部分僅需分析可比性數(shù)據(jù)支持��,當(dāng)存在其他生產(chǎn)并發(fā)變更時��,多會評估PK可比性��。
細(xì)胞株變更涉及的可比性研究如下圖所示�����。
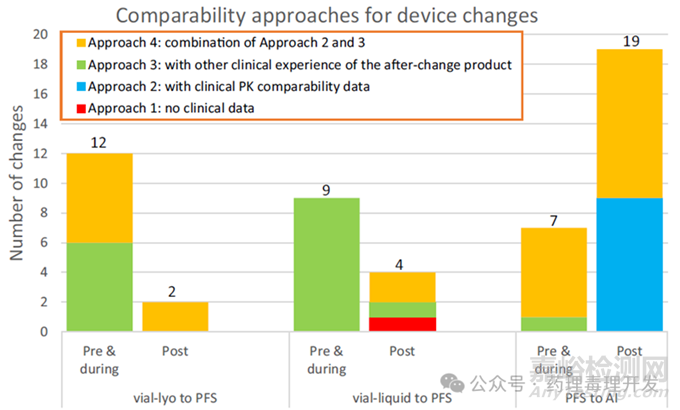
制劑形式變更
調(diào)研中涉及的制劑形式主要為瓶裝�����、預(yù)充式注射器(PFS)和自動注射器(AI)����,其中瓶裝含凍干粉末或液體劑型����,PFS和AI僅含液體劑型�����。
54例制劑形式變更中�����,50%(25例)發(fā)生在關(guān)鍵試驗后�����,其中約75%(25例中的18例)是從PFS變更為AI��。
可比性方法選擇
除1例從瓶裝變更為PFS的變更采用方法1外��,所有制劑形式變更均需臨床數(shù)據(jù)支持(方法2����、3或4)��。
關(guān)鍵試驗后從PFS變更為AI的所有案例�����,均通過臨床PK可比性研究支持(方法2或4)��;關(guān)鍵試驗前該類變更(7例)中,6例采用臨床PK可比性研究�����,僅1例(MAb-t)采用方法3����。
當(dāng)容器與劑型同時變更(如從瓶裝凍干粉末變更為PFS液體)時,無論變更階段��,均需臨床數(shù)據(jù)支持��;14例該類變更中��,6例用方法3�����,8例用含臨床PK可比性研究的方法4�����。
額外注意點:關(guān)鍵試驗后制劑形式變更采用方法4時�����,除PK可比性外��,還需評估變更后產(chǎn)品的安全性特征�����。
其他常見多類型并發(fā)變更
重點分析了三種常見的多類型并發(fā)變更場景��,其可比性方法選擇受變更組合�����、規(guī)模及階段影響��。
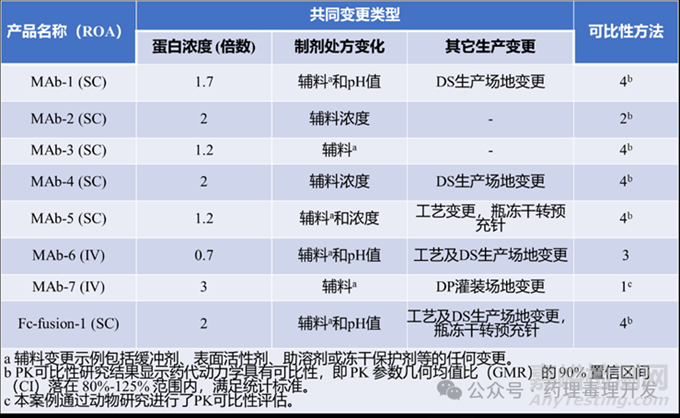
制劑(DP)濃度與制劑配方并發(fā)變更
關(guān)鍵試驗后共8個產(chǎn)品發(fā)生該類變更��,6例采用含臨床PK可比性數(shù)據(jù)的方法(方法2或4)����,2例靜脈注射(IV)產(chǎn)品分別采用方法3(MAb-6)和方法1(MAb-7)。
關(guān)鍵試驗后僅1個單克隆抗體(MAb-5)和1個Fc融合蛋白(Fc-fusion-1)發(fā)生劑型變更����,均通過方法4銜接。
如下表所示。
工藝與生產(chǎn)場地并發(fā)變更
各階段均有大量工藝變更與場地變更并發(fā)(關(guān)鍵試驗前74%����、試驗期間53%、試驗后86%����,如下表),兩者可比性方法分布模式相似�����。
關(guān)鍵試驗后約50%的工藝或場地變更僅用分析可比性數(shù)據(jù)支持(方法1)�����,31%采用方法3��,26%采用含PK對比數(shù)據(jù)的方法(方法2和4合計)��。
需PK數(shù)據(jù)支持的工藝變更案例包括培養(yǎng)基變更��、工藝放大相關(guān)變更����、純化步驟變更等,且多伴隨細(xì)胞庫�����、DS生產(chǎn)場地����、DP濃度、配方或新注射裝置等并發(fā)變更�����。
細(xì)胞培養(yǎng)規(guī)模與其他工藝并發(fā)變更
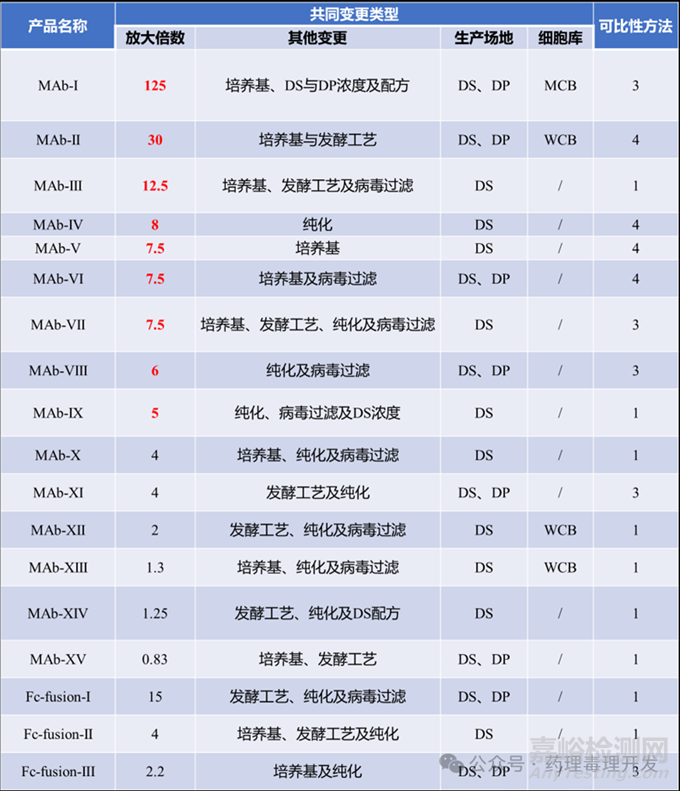
關(guān)鍵試驗后共18例細(xì)胞培養(yǎng)規(guī)模變更(0.83倍至125倍��,中位數(shù)5.5倍)����,且均伴隨其他工藝變更。
規(guī)模擴大≥5倍的變更(10例)中����,7例需臨床數(shù)據(jù)支持(3例方法3、4例方法4)�����;規(guī)模擴大<5倍的變更(8例)中,6例采用方法1�����。
因18例變更均存在多類型并發(fā)變更��,無法將可比性方法選擇單純歸因于生產(chǎn)規(guī)模變更��。
下表展示了關(guān)鍵試驗后變更的示例�����,紅色為工藝規(guī)模放大倍數(shù)超過5倍的例子�����。很明顯����,可比性方法與發(fā)酵工藝放大的規(guī)模相關(guān)。
討論
一��、可比性評估的四種核心方法
研究依據(jù)可比性方案中納入的臨床數(shù)據(jù)類型��,將評估方法分為四類����,具體如下:
方法1:僅通過分析對比確認(rèn)產(chǎn)品可比性,不納入任何臨床數(shù)據(jù)��。
方法2:當(dāng)分析研究無法完全確定產(chǎn)品可比性時��,引入對比性臨床PK數(shù)據(jù)����,評估相對生物利用度。
方法3:在分析對比基礎(chǔ)上����,結(jié)合額外臨床經(jīng)驗(如變更前后產(chǎn)品對比研究、變更后產(chǎn)品單獨研究)����,進一步明確變更后產(chǎn)品在療效、安全性(含免疫原性)等臨床性能方面的表現(xiàn)��。
方法4:可比性方案同時納入對比性臨床PK數(shù)據(jù)與變更后產(chǎn)品的其他臨床經(jīng)驗�����。
此外��,研究指出非臨床體內(nèi)研究在可比性評估中作用有限,但部分情況下非臨床PK研究仍會與臨床研究一同提交����,以支持生產(chǎn)變更。例如�����,某補充生物制品BLA中�����,動物研究的PK和藥效學(xué)可比性數(shù)據(jù)����,成為支持藥物DP濃度、配方及灌裝地點同步變更的主要體內(nèi)數(shù)據(jù)�����,原因是在健康受試者中開展臨床PK可比性研究存在安全與倫理顧慮�����。
二�����、生產(chǎn)變更的時間節(jié)點對評估方法的影響
將生產(chǎn)變更時間分為關(guān)鍵研究前、關(guān)鍵研究期間�����、關(guān)鍵研究后三類��,不同節(jié)點的變更對應(yīng)不同評估邏輯與方法選擇:
關(guān)鍵研究前變更:變更后產(chǎn)品會在關(guān)鍵研究中接受安全性與療效評估�����,以支持獲批��,因此邏輯上選擇方法3進行可比性評估�����。此類變更占比最高��,達(dá)67%�����。
關(guān)鍵研究期間變更:在調(diào)研中占比極低(不足8%)�����,其對產(chǎn)品臨床性能的影響難以解讀����,不符合EMA指南要求,屬于不推薦的變更節(jié)點��。
關(guān)鍵研究后變更:占比25%��,評估方法選擇與變更風(fēng)險相關(guān):1)31%的變更僅通過分析數(shù)據(jù)支持(方法1)�����,此類變更被認(rèn)為對臨床性能影響風(fēng)險低�����,典型案例包括DP組裝地點變更����、WCB變更及微小配方變更;2)69%的變更需結(jié)合臨床數(shù)據(jù)(方法2��、3、4)����,常見變更類型包括MCB變更、劑型變更��、給藥裝置變更(主要為預(yù)充式注射器PFS改為自動注射器AI)及大規(guī)模工藝放大����,部分變更可能同步發(fā)生�����。
三����、不同類型生產(chǎn)變更的特點及評估策略
(一)細(xì)胞相關(guān)變更
細(xì)胞相關(guān)變更的風(fēng)險等級與評估方法高度關(guān)聯(lián),具體如下:
宿主細(xì)胞類型變更:被公認(rèn)為高風(fēng)險變更��,調(diào)研中無此類變更發(fā)生在關(guān)鍵研究后�����。不同宿主細(xì)胞表達(dá)的糖基化酶和轉(zhuǎn)運體不同�����,會導(dǎo)致蛋白質(zhì)糖基化模式、PK��、療效及免疫原性改變����。調(diào)研中4例變更為關(guān)鍵研究前從鼠源細(xì)胞系(如NS0、Sp2/0)轉(zhuǎn)為CHO細(xì)胞�����,目的是避免鼠源細(xì)胞產(chǎn)生的α-半乳糖(α-Gal��,強免疫原性聚糖)引發(fā)過敏反應(yīng)�����。此類高風(fēng)險變更需通過方法3或4評估��,且日本監(jiān)管機構(gòu)要求獲批后宿主細(xì)胞類型變更需按新上市許可申請?zhí)峤弧?/span>
MCB變更:即使源自同一宿主細(xì)胞類型��,仍被WHO和EMA歸為重大變更����,因可能導(dǎo)致產(chǎn)品異質(zhì)性變化,進而影響CQAs,如聚集體/溶解度����、電荷變異體,甚至引發(fā)臨床PK差異(如聚集體增加會降低皮下吸收�����、影響生物功能�����、增加免疫原性��;等電點pI變化會影響皮下給藥單克隆抗體的吸收與分布)����。調(diào)研中MCB變更多源自同一克隆��,需通過方法3或4評估����。
WCB變更:FDA和WHO將同一MCB衍生的新WCB歸為微小變更,F(xiàn)DA指南允許符合可比性方案的新WCB通過BLA年度報告提交��,無需額外審批。調(diào)研中僅5/76的WCB變更需結(jié)合臨床PK研究支持�����,遠(yuǎn)低于宿主細(xì)胞類型變更(5/8)和MCB變更(5/25)����,且評估方法選擇需結(jié)合同步發(fā)生的其他變更綜合判斷。
(二)生產(chǎn)地點與工藝變更
變更特點:生產(chǎn)地點(活性物質(zhì)生產(chǎn))新增或替換是常見重大變更(EMA定義)�����;工藝變更中����,影響CQAs的類型(如生物來源原材料、生產(chǎn)規(guī)模��、細(xì)胞培養(yǎng)條件����、純化工藝、病毒安全檢測與去除/滅活步驟�����、新雜質(zhì)產(chǎn)生等)也屬于重大變更。兩類變更在調(diào)研中發(fā)生頻率最高��,分別占626項總變更的134項和146項��。
評估策略:關(guān)鍵研究前或期間的地點與工藝變更均需通過臨床研究評估�����;關(guān)鍵研究后變更中��,半數(shù)需結(jié)合臨床數(shù)據(jù)��。其中�����,關(guān)鍵研究后大規(guī)模細(xì)胞培養(yǎng)工藝放大�����,或同步伴隨細(xì)胞��、地點����、濃度、配方����、給藥裝置變更時,更常通過方法2或4評估����。
特殊案例:1例Fc融合蛋白關(guān)鍵研究后工藝放大15倍,僅通過方法1(分析對比)評估��。因分析研究顯示唾液酸化水平差異微小��,且體外結(jié)構(gòu)功能研究證實唾液酸酶去除唾液酸不影響藥效��,故無需臨床數(shù)據(jù)支持����。
(三)DP濃度與配方同步變更
變更特點:兩類變更均被EMA歸為影響CQAs的重大變更,且常同步發(fā)生�����。配方優(yōu)化是開發(fā)關(guān)鍵步驟����,常用緩沖劑包括磷酸鈉�����、組氨酸�����、檸檬酸����、檸檬酸鈉�����、乙酸鈉��、琥珀酸鹽����、L-精氨酸等;部分緩沖劑(如檸檬酸鹽)可能引發(fā)皮下注射疼痛����,需通過調(diào)整配方濃度或更換輔料解決(如阿達(dá)木單抗去除檸檬酸鹽�����,改用甘露醇、聚山梨酯80與水的簡化配方)����。
評估策略:皮下給藥產(chǎn)品為提高患者依從性與舒適度,需減少注射體積����,這會導(dǎo)致配方濃度升高,而高濃度易引發(fā)蛋白質(zhì)聚集��,增加免疫原性風(fēng)險�����,因此濃度升高常伴隨配方優(yōu)化(如選擇合適輔料�����、穩(wěn)定劑��、滲透壓)�����。調(diào)研中所有關(guān)鍵研究后皮下給藥產(chǎn)品的濃度與配方同步變更,均需通過PK相似性研究評估����;阿達(dá)木單抗等案例還通過方法4(結(jié)合PK可比性研究與療效、安全性臨床經(jīng)驗)支持變更����。
輔料與劑型關(guān)聯(lián)影響:表面活性劑(如聚山梨酯20/80、泊洛沙姆188)可穩(wěn)定配方中單抗�����、防止聚集�����,但輔料更換可能影響蛋白質(zhì)相互作用及給藥效率(如PFS與AI的硅涂層脫落�����、滑動力變化)�����,此類變更需通過PK相似性研究驗證;劑型變更(如凍干制劑改液體制劑)常伴隨配方調(diào)整(凍干制劑需添加甘露醇��、蔗糖��、海藻糖等保護劑)��,調(diào)研中2例關(guān)鍵研究后劑型變更均通過方法4評估����。
(四)給藥裝置(劑型)變更
變更影響因素:裝置參數(shù)可能影響產(chǎn)品PK����、安全性與療效。例如����,自動注射器(AI)最大注射深度增加,可能降低PK可比性研究中生物等效性(BE)達(dá)標(biāo)概率�����;注射針長度(≥8mm)會提高四肢肌肉注射參數(shù)(vs.4-5mm針頭)�����,而注射部位皮膚厚度(2-3mm)在不同人群中差異小。目前裝置參數(shù)(如注射深度��、部位)對蛋白質(zhì)藥物吸收��、PK����、療效、安全性的影響機制仍需進一步研究����,且具有產(chǎn)品特異性。
評估策略:調(diào)研中除1例外��,所有裝置變更均需結(jié)合臨床PK可比性研究(方法2)或其他臨床證據(jù)(方法3��、4)評估:
關(guān)鍵研究前或期間變更常通過方法3評估����,即變更后裝置(如PFS)的臨床經(jīng)驗直接支持獲批。
關(guān)鍵研究后從瓶裝改為PFS的變更中��,2/6無需臨床PK研究�����,因兩者均通過手動注射器給藥,方式相似�����;若同步伴隨劑型變更(如瓶裝凍干制劑改PFS液體制劑)����,則100%需通過方法4評估�����,50%關(guān)鍵研究前/期間變更需通過方法4評估�����。
關(guān)鍵研究后從PFS改為AI的19例變更�����,均需通過臨床PK可比性研究評估��,因兩者給藥方式差異大(如注射角度90°vs.45°����、注射速度彈簧控制vs.手動控制、皮膚穿透深度不同)。
典型案例:1例單克隆抗體的PFS與AI PK對比研究未達(dá)BE標(biāo)準(zhǔn)�����,企業(yè)通過修改AI彈簧設(shè)計��,在第二次臨床PK研究中實現(xiàn)BE��,體現(xiàn)了PK可比性研究在解決裝置組合產(chǎn)品臨床性能不確定性中的作用�����。此外����,支持生物制劑-裝置組合產(chǎn)品商業(yè)化,除裝置間可比性評估外�����,還需提交人因驗證數(shù)據(jù)����、局部不良事件數(shù)據(jù)、裝置設(shè)計驗證與確認(rèn)數(shù)據(jù)等��。