引言:
2025年3月�����,NMPA發(fā)布《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂)無(wú)菌藥品附錄(征求意見(jiàn)稿)》����,明確提出“消毒方法應(yīng)當(dāng)經(jīng)過(guò)驗(yàn)證,證明消毒劑適用于所消毒的表面材料����,并證實(shí)其消毒的效果。”2025藥典新增《9210藥品微生物實(shí)驗(yàn)室消毒劑效力評(píng)估指導(dǎo)原則》�,指明“當(dāng)使用消毒劑控制微生物時(shí),應(yīng)進(jìn)行效力評(píng)估�,以保證其消毒效果符合預(yù)期。” GMP無(wú)菌附錄和2025藥典的更新奠定了消毒劑效力評(píng)估在合規(guī)性評(píng)價(jià)中的重要地位���。
《9210藥品微生物實(shí)驗(yàn)室消毒劑效力評(píng)估指導(dǎo)原則》為消毒劑效力評(píng)估提供了標(biāo)準(zhǔn)的流程和方法��。本文對(duì)該指導(dǎo)原則進(jìn)行了梳理和解析���,以幫助業(yè)界同仁盡快落實(shí)消毒劑效力評(píng)估。
● 定義:消毒劑通常是指應(yīng)用在物品表面去除或殺滅微生物的物理因子或化學(xué)試劑。2025藥典中的消毒劑指化學(xué)消毒劑����。
● 適用范圍:適用于制藥環(huán)境、設(shè)施、設(shè)備及實(shí)驗(yàn)室用消毒劑的效力評(píng)估�����,不包括制藥用水系統(tǒng)的消毒及相關(guān)生物被膜的去除��。
02���、消毒劑的種類(lèi)
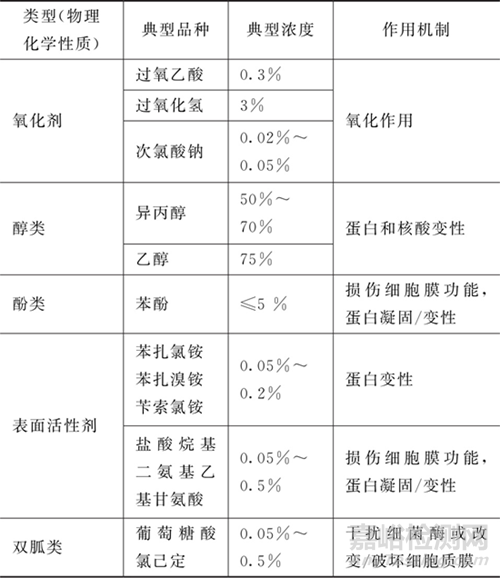
2025藥典按照物理化學(xué)性質(zhì)對(duì)常用的消毒劑進(jìn)行了分類(lèi)�,每個(gè)類(lèi)型下列舉了典型品種����、典型濃度和作用機(jī)制(詳見(jiàn)下表)��。對(duì)于藥典中未列舉的其他消毒劑����,經(jīng)確認(rèn)安全有效也可使用。
按殺菌譜范圍或作用強(qiáng)度����,可將上表中的消毒劑分為殺孢子劑和非殺孢子劑。其中�����,氧化劑(過(guò)氧乙酸、過(guò)氧化氫�、次氯酸鈉)屬于殺孢子劑,醇類(lèi)等屬于非殺孢子劑��。
03��、消毒劑的選擇和使用
消毒劑選擇的第一要素是符合現(xiàn)行法規(guī)要求�����,包括:
此外����,消毒劑的選擇還應(yīng)綜合考慮以下因素:①被消毒物體表面的性質(zhì)(材料對(duì)消毒劑的兼容性);②消毒劑的殺菌譜以及消毒劑輪換的必要性�;③物體表面污染情況(如被污染微生物的數(shù)量和類(lèi)型);④消毒劑對(duì)人體(安全)的影響��;⑤廢棄物處理便易性(中和����、滅活)及廢棄物對(duì)環(huán)境的影響。
消毒劑應(yīng)在效期內(nèi)(未開(kāi)瓶效期/開(kāi)瓶后效期)使用�����,對(duì)于需要稀釋使用的消毒劑,應(yīng)當(dāng)確認(rèn)配制后消毒劑的貯藏方式�、貯藏條件及使用期限。
消毒劑效力評(píng)估的流程包括:準(zhǔn)備工作→效力評(píng)估試驗(yàn)→定期效力再評(píng)估���。
4.1 準(zhǔn)備工作
準(zhǔn)備工作包括培養(yǎng)基的制備及其適用性檢查。
培養(yǎng)基的制備:按照無(wú)菌檢查法(2025藥典通則1101)制備��,包括以下5種:胰酪大豆胨液體培養(yǎng)基���、胰酪大豆胨瓊脂培養(yǎng)基��、沙氏葡萄糖液體培養(yǎng)基、沙氏葡萄糖瓊脂培養(yǎng)基����、馬鈴薯葡萄糖瓊脂培養(yǎng)基。
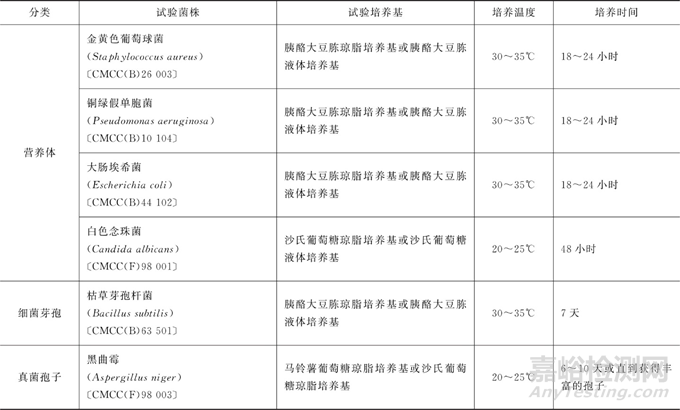
培養(yǎng)基的適用性檢查:不同培養(yǎng)基適用性檢查的對(duì)應(yīng)試驗(yàn)菌株��、培養(yǎng)溫度��、培養(yǎng)時(shí)間見(jiàn)下表。
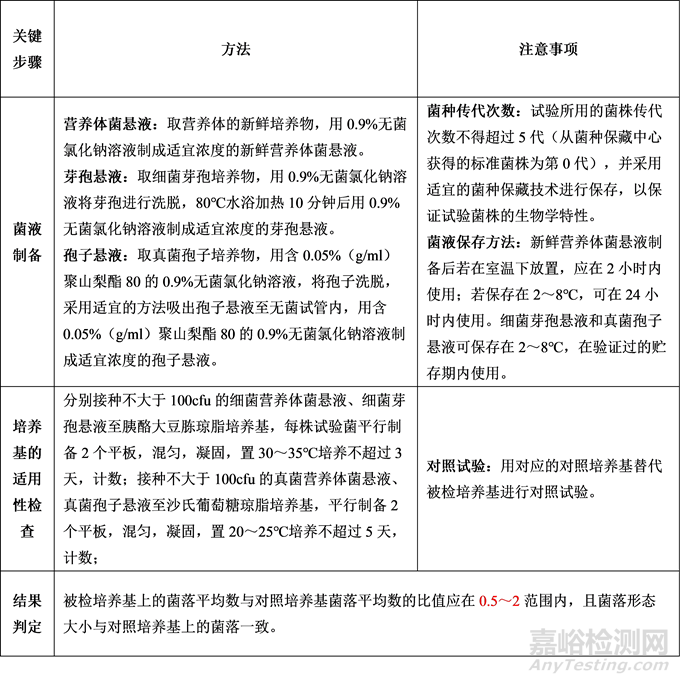
培養(yǎng)基適用性檢查的要點(diǎn)包括菌液的制備��、適用性檢查試驗(yàn)及結(jié)果判定��,詳見(jiàn)下表:
4.2 消毒劑效力評(píng)估試驗(yàn)
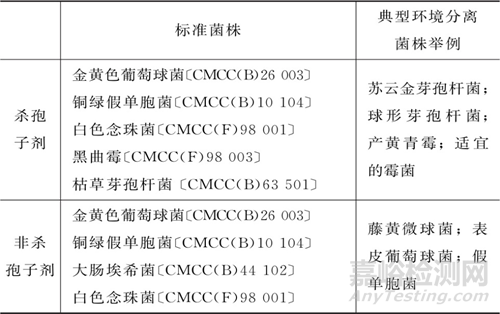
● 效力評(píng)估菌種:應(yīng)選用與消毒劑類(lèi)型(殺孢子劑/非殺孢子劑)相適應(yīng)的菌株進(jìn)行效力評(píng)估���,可參考下表選擇“標(biāo)準(zhǔn)菌株+1~2株典型環(huán)境分離菌”【若環(huán)境微生物菌群信息充分�����,也可依據(jù)具體的微生物控制目標(biāo)選擇類(lèi)似菌株或適當(dāng)增減消毒劑效力評(píng)估試驗(yàn)菌株數(shù)量】
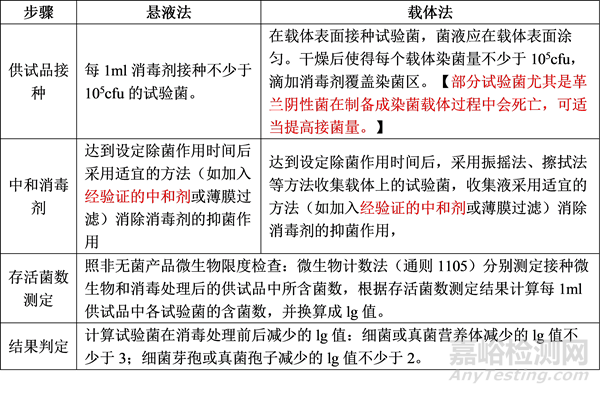
● 效力評(píng)估方法:包括懸液法和載體法���,懸液法可用于對(duì)消毒劑種類(lèi)、濃度等進(jìn)行快速初篩�����;載體法可用于驗(yàn)證消毒劑在實(shí)際物品表面消毒除菌的能力���。兩種方法的測(cè)定步驟對(duì)比如下:
● 注意事項(xiàng):
① 中和劑的中和效果應(yīng)進(jìn)行驗(yàn)證����,以保證中和劑的有效性和無(wú)毒性�����。
- 中和劑的有效性:在中和步驟完成后加入待測(cè)微生物(1ml溶液中接菌量為101~102cfu),照非無(wú)菌產(chǎn)品微生物限度檢查:微生物計(jì)數(shù)法(通則1105)進(jìn)行菌落計(jì)數(shù)����,試驗(yàn)組菌落數(shù)與菌液組菌落數(shù)的比值應(yīng)在0.5~2范圍內(nèi)。
-中和劑的無(wú)毒性:在中和劑中加入待測(cè)微生物(1ml溶液中接菌量為101~102cfu)�����,照非無(wú)菌產(chǎn)品微生物限度檢查:微生物計(jì)數(shù)法(通則1105)進(jìn)行菌落計(jì)數(shù)���,試驗(yàn)組菌落數(shù)與菌液組菌落數(shù)的比值應(yīng)在0.5~2范圍內(nèi)��。
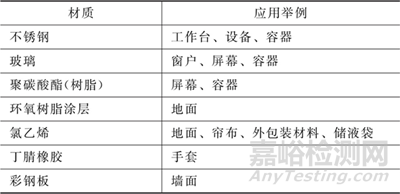
② 載體法應(yīng)覆蓋關(guān)鍵設(shè)備對(duì)應(yīng)的材質(zhì)�����,當(dāng)安裝了新型表面材料時(shí)����,還應(yīng)補(bǔ)充對(duì)應(yīng)材質(zhì)的研究���,不同設(shè)備的代表性材質(zhì)可參考下表:
4.3 定期消毒效力再評(píng)估
不同微生物種類(lèi)之間對(duì)消毒劑的耐受性能力存在差異��,因此�,消毒劑效力評(píng)估確定的除菌效果可能與實(shí)際應(yīng)用效果存在差異����,建議定期回顧環(huán)境監(jiān)測(cè)計(jì)劃中最常分離出的微生物,并對(duì)最常分離出的微生物定期進(jìn)行消毒劑效力測(cè)試����,以持續(xù)保證消毒效果。
參考文獻(xiàn):
【1】《9210藥品微生物實(shí)驗(yàn)室消毒劑效力評(píng)估指導(dǎo)原則》
【2】《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂)無(wú)菌藥品附錄(征求意見(jiàn)稿)》