在藥物的非臨床安全性評價中�����,未預(yù)期的動物死亡時有發(fā)生��,其原因可能與供試品相關(guān)��,也可能無關(guān)(如飼養(yǎng)���、操作因素或背景/群體地方性疾?����。?��。隨著化學(xué)品、藥物��、食品添加劑研究監(jiān)管法規(guī)的出臺��,明確要求若無法通過臨床癥狀和宏觀評估確定死因(COD)�����,需對按計劃完成研究的動物進行組織病理學(xué)評估���,以查明死亡原因;同時��,動物福利法規(guī)也要求嘗試明確導(dǎo)致嚴重反應(yīng)或死亡的原因。
非嚙齒類動物死因(CODN)工作組是美國毒理學(xué)病理學(xué)會(STP)科學(xué)與監(jiān)管政策委員會(SRPC)下屬機構(gòu)��。致力于了解制藥行業(yè)��、學(xué)術(shù)機構(gòu)��、CRO在GLP與非GLP毒性研究中���,針對主要非嚙齒類動物(以非人靈長類動物�����、犬為主��,兼顧兔�����、豬等)開展早期/計劃外尸檢時���,“死因(COD)”或“瀕死狀態(tài)”的判定與報告現(xiàn)狀及預(yù)期要求。負責(zé)制定“考量要點”�����,指導(dǎo)研究中計劃外尸檢相關(guān)數(shù)據(jù)的收集、評估與報告�����,幫助病理學(xué)家�����、毒理學(xué)家及監(jiān)管機構(gòu)明確“受試物相關(guān)死因”與“偶發(fā)死因”的區(qū)別���。
2022年末-2023年初STP開展了一項調(diào)研:向行業(yè)發(fā)放調(diào)查問卷���,收集非嚙齒類動物(主要為NHP、犬�����,也含嚙齒類及兔等其他非嚙齒類)“瀕死動物計劃外安樂死”與“發(fā)現(xiàn)已死亡動物”的死因判定實踐信息(兩類場景統(tǒng)稱“COD”)�����,其中“COD”定義為“研究中計劃終止前死亡或被安樂死動物的臨終死亡原因”�����。評估不同物種在死因判定方法與成功率上的潛在差異。死因判定依據(jù):通常由研究病理學(xué)家綜合所有可用研究數(shù)據(jù)判定���,包括動物病史、獸醫(yī)學(xué)相關(guān)子學(xué)科信息(臨床獸醫(yī)評估��、尸檢觀察�����、臨床與解剖病理樣本評估���、微生物評估)及受試物暴露數(shù)據(jù)���,但不同物種、機構(gòu)�����、研究類型對評估的預(yù)期與范圍存在差異���。
本文闡述2022年末-2023年初行業(yè)調(diào)研結(jié)果���,提出非嚙齒類動物COD判定與報告的“考量要點”���,以助力合理評估其與“人類潛在暴露受試物”的關(guān)聯(lián)性。
監(jiān)管框架發(fā)展史
在1938年美國《聯(lián)邦食品��、藥品和化妝品法案》出臺前�����,監(jiān)管機構(gòu)并未參與動物研究的規(guī)劃或?qū)嵤?����。該法案的出臺���,源于一系列公共衛(wèi)生災(zāi)難�����,如20世紀30年代的磺胺類藥物酏劑災(zāi)難和60年代初的沙利度胺災(zāi)難���。
美國FDA于1949年首次發(fā)布的面向行業(yè)的食品中化學(xué)物質(zhì)毒性評估指南,被稱為“黑皮書”���。此后���,更多毒性評估標準化方案相繼出臺�����,OECD于1981年發(fā)布了相關(guān)方案,這些方案隨后也被納入1982年版《FDA紅皮書》��。
1996年��,ICH發(fā)布了一系列指南���,旨在確保以資源利用效率最高��、質(zhì)量最優(yōu)的方式研發(fā)�����、注冊和維護安全�����、有效且高質(zhì)量的藥品���。
目前���,包括ICH M3(R2)指南在內(nèi)的ICH系列指南,為早期非臨床研究中確定最大耐受劑量(MTD)提供了明確指導(dǎo)���,其目的是為關(guān)鍵非臨床研究的劑量設(shè)定提供依據(jù)���。該指南指出,合理選擇劑量的目的是論證并明確毒性特征�����,同時盡量避免研究過程中動物過早死亡�����。然而�����,對于一般毒性研究中確定死亡原因的具體要求���,相關(guān)指導(dǎo)意見仍較為有限���。
《2000年FDA紅皮書:IV.B.4毒性研究中的統(tǒng)計學(xué)考量》建議��,需記錄每只動物的死亡類型(計劃處死���、瀕死、發(fā)現(xiàn)死亡)���、死亡日期��、研究參與天數(shù),以及動物被移出研究的所有原因��。ICH M4S—安全性部分指出�����,在涉及死亡原因時�����,“應(yīng)評估毒性反應(yīng)的發(fā)生時間�����、嚴重程度、持續(xù)時間�����、劑量相關(guān)性���、可逆性(或不可逆性)程度�����,以及種屬或性別相關(guān)差異��,并對重要特征進行討論”�����?�!禛uideline on strategies to identify and mitigate risks for first-in-human and early clinical trials with investigational medicinal products》(EMEA/CHMP/SWP/28367/07)則規(guī)定:“若觀察到嚴重毒性反應(yīng)或動物死亡���,且在已開展的研究中無法明確死亡原因或毒性作用機制,同時該信息對臨床試驗設(shè)計或安全性監(jiān)測計劃具有重要意義��,則可能需要開展額外研究以確定死亡原因或毒性作用機制”��。這些指南均表明,理解死亡原因(若發(fā)生死亡)具有重要意義��;而就ICH而言�����,需盡可能減少死亡這一結(jié)果的發(fā)生��。
盡管已有上述法規(guī)���,但針對死亡或瀕死狀態(tài)原因調(diào)查應(yīng)包含哪些內(nèi)容��,目前仍缺乏具體指導(dǎo)��。因此,本調(diào)查旨在探究當(dāng)前行業(yè)實踐���,包括在毒性研究中運用多種影響因素及開展額外評估以確定COD的做法��。
當(dāng)前實踐回顧
2022年12月至2023年3月��,研究人員對毒理病理學(xué)會(STP)具有全球代表性的會員開展了一項調(diào)查��。本次調(diào)查聚焦非嚙齒類動物研究���,主要涉及犬類和NHP���。
問題分為4個部分,具體如下:
·A部分:關(guān)于COD判定與記錄的一般性問題
·B部分:全面組織評估研究中采用的方法
·C部分:有限組織評估或無組織評估研究中采用的方法
·D部分:非研究用動物或種群動物的死亡原因
A部分:死亡原因一般性問題
在30名受訪者中���,僅33%表示其所在機構(gòu)要求在組織病理學(xué)數(shù)據(jù)采集系統(tǒng)中明確死亡原因��。在被要求錄入死亡原因的受訪者中���,約半數(shù)僅能記錄一個死亡影響因素。
對于表示無需在數(shù)據(jù)采集系統(tǒng)中明確死亡原因的受訪者�����,均在報告正文中記錄死亡原因��。幾乎所有受訪者都會在報告正文中對死亡原因進行評述��,即便已在組織病理學(xué)數(shù)據(jù)采集系統(tǒng)中錄入相關(guān)信息�����;且具體而言���,死亡原因會納入研究報告的死亡率部分��。
根據(jù)受訪者經(jīng)驗�����,確定直接或主要死亡原因的成功率存在差異�����,70%的受訪者表示“經(jīng)常”或“大部分時間”(>45%的情況)能成功確定���。
B部分與C部分:全面組織研究�����、有限組織評估或無組織評估研究
B部分的問題圍繞全面組織研究(主要是GLP毒性/安全性研究)展開��,詢問死亡原因的判定方法。C部分則探究在非GLP���、無組織評估或有限組織評估研究中�����,死亡原因判定方法與全面組織清單研究的差異��。
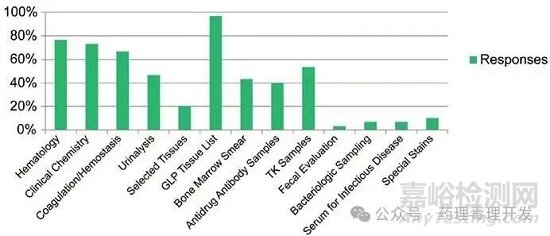
對于所有毒性/安全性研究���,超50%的受訪者表示�����,在所有非嚙齒類動物研究(GLP或非GLP)的試驗方案或標準操作規(guī)程(SOP)中���,通常會納入用于輔助判定非計劃尸檢死亡原因的終點指標,包括全面組織清單�����、血液學(xué)���、臨床化學(xué)���、凝血/止血及毒代動力學(xué)(TK)采樣。納入頻率較低(<50%)的終點指標包括尿液分析���、骨髓涂片��、抗藥物抗體評估��、特殊染色��、傳染病血清檢測��、細菌學(xué)采樣及糞便評估���。
73%的受訪者表示���,為輔助判定死亡原因,曾開展試驗方案或SOP中未常規(guī)規(guī)定的額外評估�����,包括特殊染色���、免疫組織化學(xué)(IHC)�����、聚合酶鏈式反應(yīng)(PCR)��、微生物學(xué)檢測及組織質(zhì)譜分析等多種方法���。
大多數(shù)受訪者遵循試驗方案驅(qū)動,或同時遵循試驗方案與SOP驅(qū)動的死亡原因評估流程�����,并采用預(yù)先設(shè)定的標準�����。在GLP安全性研究中�����,67%的受訪者表示非計劃尸檢與計劃尸檢的樣本采集方式無差異��,但會根據(jù)研究特定情況或因素調(diào)整組織采集或評估方式��。對于采用不同樣本采集方式的受訪者�����,其試驗方案允許采集額外樣本(如血清/血漿或組織)���,以輔助闡明過敏樣反應(yīng)或急性超敏反應(yīng)等癥狀���。
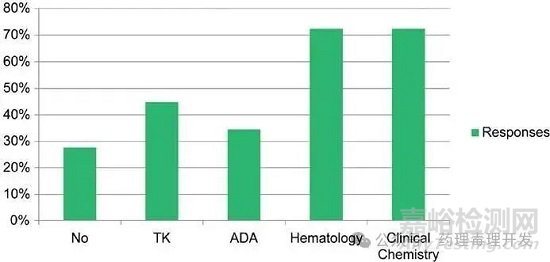
超半數(shù)受訪者(57%)表示�����,對于發(fā)現(xiàn)死亡的動物與選擇性安樂死(非計劃)的動物���,死亡原因判定方法存在差異。主要差異在于���,對于發(fā)現(xiàn)死亡的動物���,無法采集或難以采集血液樣本、器官重量數(shù)據(jù)��、骨髓涂片及冷凍樣本�����。對于在計劃終止前選擇性安樂死的動物���,72%的受訪者表示會同時開展血液學(xué)和臨床化學(xué)評估���,而僅44%會進行TK評估,約33%會評估抗藥物抗體���。部分受訪者解釋,這些評估需取決于樣本可獲得性��、研究數(shù)據(jù)或藥物類別���。
62%的受訪者表示��,會根據(jù)具體情況或申辦方要求(包括臨床癥狀或大體觀察結(jié)果等研究特定情況)調(diào)整組織采集方式�����。但需注意的是��,病理學(xué)家為解讀結(jié)果而要求額外采集組織時���,通常擁有科學(xué)自主權(quán)(例如,當(dāng)處理組動物出現(xiàn)皮膚病變時��,病理學(xué)家可能會要求采集對照組代表性樣本以作比較)��。有評論指出���,對SOP或試驗方案驅(qū)動的樣本采集方式的調(diào)整��,需在試驗方案修訂版中說明。
40%的受訪者表示��,死亡原因評估方式會因受試物或其他因素(包括適應(yīng)癥��、給藥方式或給藥途徑)而不同��。這些受訪者提及的最常見因素為給藥途徑�����、已知風(fēng)險因素及給藥方式���。
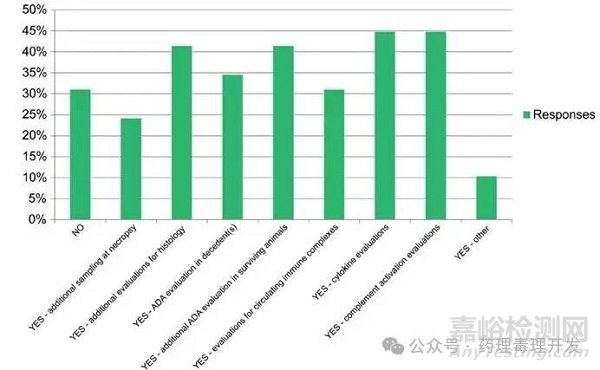
當(dāng)非計劃安樂死可能與免疫反應(yīng)相關(guān)時��,31%的受訪者不會開展額外評估��。對于表示會開展額外評估的受訪者��,各項評估活動的分布較為均勻���,且多數(shù)評估需根據(jù)具體情況確定��。
79%的受訪者表示�����,不同非嚙齒類動物物種的死亡原因判定方法無差異。對于存在差異的受訪者�����,不止一人表示會對非人靈長類動物采集比犬��、豬等其他大型動物更多的樣本��。
在試驗方案未規(guī)定組織采集�����,或明確要求終末尸檢采用有限組織清單的研究中�����,與GLP全面組織研究相比,56%的受訪者對死亡動物采用不同且更有限的組織樣本集��;但仍有44%的受訪者���,即便在有限組織/無組織研究中,也會對死亡動物采集“全面”的組織清單���。
在犬���、非人靈長類動物、豬開展的非GLP探索性研究或機制性研究中���,絕大多數(shù)非計劃死亡動物會通過組織病理學(xué)專門評估死亡原因(至少根據(jù)具體情況評估)���,而兔子的此類評估頻率較低。
D部分:非研究用動物
D部分的問題旨在探究是否可能利用同期或近期共飼養(yǎng)���、共運輸?shù)姆茄芯坑脛游镄畔?�,為研究用動物死亡原因提供參考�����。該部分涉及的動物包括種群動物及備用動物(研究方案初始設(shè)計中納入的額外動物���,以備按方案要求替換動物時使用)��。
受訪者對種群/儲備動物死亡原因的評估方式存在差異:部分受訪者采用與研究用動物相同或更嚴格的評估方式��,部分則采用更寬松的評估方式�����。需注意的是���,40%的受訪者表示“不確定”或“不適用”���,這表明并非所有受訪者都直接參與種群動物的管理���。更寬松的評估方式基于活體觀察、臨床病理學(xué)及大體病理學(xué)評估��,并結(jié)合針對性采樣���,通過整體分析而非全面組織評估來判定死亡原因���。
約70%對種群/儲備動物或非研究用死亡動物開展評估的受訪者表示��,會將相關(guān)數(shù)據(jù)用于解讀研究結(jié)果��,主要用于分析傳染病或種群健康問題���。例如,食蟹猴肝炎感染會影響對肝臟炎癥灶的解讀���;另一個例子是家兔黏液性腸炎暴發(fā)���,這對解釋研究結(jié)果具有重要意義。部分受訪者還表示���,過去曾通過了解種群中的背景感染情況�����,區(qū)分背景發(fā)現(xiàn)與受試物相關(guān)發(fā)現(xiàn)�����。
綜上���,可以看出��,在GLP研究中���,大多數(shù)受訪者對非計劃尸檢與計劃尸檢的常規(guī)樣本采集采用相同方式,且多數(shù)表示會在必要時通過修訂試驗方案開展額外評估��,以輔助判定死亡原因(COD)�����。試驗方案中規(guī)定的死亡原因判定終點指標包括全面組織清單��、血液學(xué)�����、臨床化學(xué)�����、凝血/止血及TK采樣��。即便在試驗方案規(guī)定有限組織采集的研究中��,仍有近半數(shù)(44%)的受訪者將為死亡動物采集“全面”組織清單作為標準操作�����。另外��,盡管約70%的受訪者表示���,在超過45%的情況下能成功確定直接或主要死亡原因(通常通過多個終點指標的證據(jù)權(quán)重判定)���,但仍存在無法明確死亡原因及其與受試物關(guān)聯(lián)的情況。
結(jié)論與考量要點
明確死亡原因?qū)τ跇?gòu)建數(shù)據(jù)體系以支持產(chǎn)品申報至關(guān)重要��。這是因為���,區(qū)分與所研究受試物相關(guān)的發(fā)病和死亡�����,以及與受試物無關(guān)的偶然情況(如與操作相關(guān)或與背景/種群地方性疾病相關(guān)的情況)具有重要意義���。對于非嚙齒類動物研究而言,死亡原因判定尤為關(guān)鍵,因為這類研究中接受評估的動物數(shù)量本就較少���。
監(jiān)管機構(gòu)向申辦方反饋時始終強調(diào)��,在一般毒理研究中應(yīng)盡力明確死亡或瀕死狀態(tài)的原因�����。理想情況下�����,非臨床研究(尤其是非嚙齒類動物研究)的設(shè)計應(yīng)能避免出現(xiàn)嚴重毒性反應(yīng)���、意外動物死亡,或因受試物反應(yīng)而需實施安樂死的情況�����。然而���,目前針對死亡或瀕死狀態(tài)原因調(diào)查應(yīng)包含哪些內(nèi)容,仍缺乏具體指導(dǎo)�����。
調(diào)查數(shù)據(jù)凸顯了在毒性研究中評估死亡原因的重要性。這對于理解受試物毒性影響及潛在致死后果至關(guān)重要��。區(qū)分與受試物相關(guān)的死亡和偶然死亡���,有助于解讀研究結(jié)果�����,尤其是在存在并發(fā)傳染病或種群健康問題的情況下���。此外,評估死亡原因還能通過進一步了解并應(yīng)對新型給藥方式或療法的有害影響��,提升動物福利水平�����。
本文呈現(xiàn)的數(shù)據(jù)為非嚙齒類動物毒性研究中死亡原因的判定與報告提供了當(dāng)前實踐參考及相關(guān)考量��。這些發(fā)現(xiàn)可為病理學(xué)家�����、毒理學(xué)家及監(jiān)管機構(gòu)提供指導(dǎo),助力其準確評估受試物對非嚙齒類動物的潛在危害�����,進而為該受試物在其他毒性研究或臨床研究中的進一步探索提供數(shù)據(jù)支持���。
基于對調(diào)查結(jié)果��、法規(guī)�����、文獻及工作組經(jīng)驗的綜合考量��,以下為非臨床研究中死亡原因評估提出的考量要點��。
考量要點1
對于所有死亡或提前安樂死的非嚙齒類動物���,應(yīng)盡可能通過細致調(diào)查死亡原因,并采用相關(guān)途徑與方法�����,明確主要死亡原因或主要促成死亡原因��。
無論動物所屬組別(即對照組動物與給藥組動物同等重要)�����,均需開展此項判定工作���。研究方案中應(yīng)明確死亡原因判定相關(guān)內(nèi)容��,描述在出現(xiàn)瀕死狀態(tài)或死亡時需采用的操作流程及終點指標�����。
考量要點2
若無法通過標準終點指標或評估明確死亡原因�����,應(yīng)根據(jù)研究特定情況或因素(如既往經(jīng)驗�����、基于化合物作用機制預(yù)期的效應(yīng))�����,開展額外組織采集或其他評估��。
例如�����,抗藥抗體及免疫復(fù)合物疾病是單克隆抗體研究中常見的關(guān)注點���。因此��,可考慮增加終點指標��,如采集腎臟樣本進行電子顯微鏡檢查以確認免疫復(fù)合物沉積�����,或采集提前處死動物及同期對照組動物的血液樣本以評估補體激活情況���。另一個例子是疑似過敏樣反應(yīng),此時可能需要采集樣本以評估超敏反應(yīng)標志物(如免疫球蛋白E�����、組胺和/或類胰蛋白酶)�����。再如傳染病研究中,采集診斷性樣本可能有助于解讀研究數(shù)據(jù)��,同時也有助于了解潛在的種群健康問題�����。
考量要點3
應(yīng)在數(shù)據(jù)采集系統(tǒng)和/或報告正文中明確記錄死亡原因��,且在可能的情況下��,需說明該死亡或發(fā)病是否與受試物相關(guān)���。
若已盡最大努力仍無法判定死亡原因,需在報告正文中明確說明���,包括無法判定的原因及與受試物的潛在關(guān)聯(lián)�����,以便該信息能用于未來研究的風(fēng)險評估��。解剖病理學(xué)家與臨床病理學(xué)家應(yīng)確保死亡原因判定采用綜合方法�����,且該方法需充分符合診斷病理學(xué)原理�����,包括避免將死亡原因歸咎于相對輕微的發(fā)現(xiàn)或病變���,認為此類發(fā)現(xiàn)或病變不太可能真正導(dǎo)致發(fā)病或死亡�����。
考量要點4
對于機構(gòu)內(nèi)所有死亡或非計劃安樂死的非嚙齒類動物���,無論其是否為研究用動物或來自動物房,均應(yīng)嘗試判定其死亡原因�����。獸醫(yī)人員與研究團隊(包括病理學(xué)家)之間應(yīng)保持持續(xù)��、開放的溝通���,以確保高效協(xié)作及實時決策���。當(dāng)利用特定動物開展的研究中出現(xiàn)異常變化時���,評估與這些潛在研究用動物共飼養(yǎng)或共運輸?shù)膭游锓縿游铮赡軙榻庾x變化提供參考�����。
引自:Scientific and Regulatory Policy Committee Points to Consider* for Determining and Reporting Cause of Death/Moribundity in Non-Rodent Species in Toxicity Studies