歐洲藥典在線平臺剛剛發(fā)布了第12.3版《歐洲藥典》,并將于2026年7月1日生效��。
有關(guān)12.3版《歐洲藥典》新增��、修訂和更正文本�����,如下:
一、通則(General Chapters)
1. 制藥用水TOC(2.2.44):新增方法B(適用于注射用滅菌水SWFI)�����,將氧化物測試替換為總有機碳(TOC)測試��;用化學(xué)對照品(CRSs)替代蔗糖R和1,4-苯醌R試劑��,簡化TOC測試流程��。
2. 造血產(chǎn)品中CD34/CD45+細胞計數(shù)(2.7.23):明確適用范圍不限于人類造血干細胞專論(2323)覆蓋的產(chǎn)品��;移除單平臺檢測中校準熒光微球的強制要求���,兼容新型無微球方法;更新參數(shù)選擇���、陰性對照�����、分析事件數(shù)��、樣本制備(新增無洗滌標記法)�����、系統(tǒng)設(shè)置(強調(diào)閾值與微球大小相關(guān)�����,避免高流速)等內(nèi)容�����,同時優(yōu)化文本表述。
3. 親脂性固體制劑溶解試驗(2.9.42):補充兩種裝置配置的描述和示意圖�����,新增非水浴加熱裝置選項��;刪除不必要的過濾步驟�����;調(diào)整文本結(jié)構(gòu)以符合歐洲藥典風(fēng)格��。
4. 表觀溶解試驗(2.9.43):新增裝置配置描述���、示意圖及插入件圖;修正金屬絲網(wǎng)孔徑和絲徑參數(shù)�����;同步優(yōu)化文本結(jié)構(gòu)和表述�����。
5. 環(huán)烯烴共聚物(3.1.17):刪除紅外光譜鑒別中的吸收最大值列表(因不適用于歐洲市場產(chǎn)品)�����,保留與標準樣品的對比要求���。
6. 獸用免疫制品外源因子管理(5.2.5):附件I新增禽源和馬源外源因子至風(fēng)險評估列表;將“1型鴨肝炎病毒”重命名為“鴨甲型肝炎病毒”��;明確列表為非窮盡且可補充�����。
7. 中藥草藥名稱(5.22):更新表格,新增2個草藥專論���。
二�����、通論(General Monographs)
順勢療法原料制備和強化(2371):將“植物”統(tǒng)一改為“草藥”以保持一致性��;方法5.3新增乙醇作為儲存防腐劑,納入歐洲制造商常用的非可溶性固體原料首次稀釋的新制備方法�����。
三�����、人用疫苗(Vaccines for Human Use)
吸附白喉疫苗(0443):刪除每批批量純化類毒素的常規(guī)類毒素不可逆性試驗(依賴經(jīng)驗證的不可逆解毒工藝)��,僅在研發(fā)階段或生產(chǎn)工藝影響不可逆性時進行該試驗;刪除毒素檢測中5℃���、6周的培養(yǎng)要求���,改用新鮮樣品測試;強調(diào)解毒工藝需驗證免疫原性和解毒穩(wěn)定性�����。
四�����、草藥和草藥制劑(Herbal Drugs and Herbal Drug Preparations)
刺五加(1419):鑒別項新增粉末草藥插圖及說明�����,用高效薄層色譜(HPTLC)替代薄層色譜(TLC);新增杠柳摻假檢測�����;含量測定中用阿魏酸CRS替代試劑��,引入系統(tǒng)適用性對照品��。
五�����、專論(Monographs)
涵蓋數(shù)十種藥物原料���、制劑及輔料,核心修改方向包括:
1. 拆分與重組:如阿替普酶相關(guān)專論拆分為“阿替普酶濃縮液(3197)”(含活性物質(zhì)要求)和“注射用阿替普酶粉末(1170)”(僅含制劑要求)���,更新多項分析方法(如毛細管等電聚焦、液相色譜替代傳統(tǒng)方法)��。
2. 檢測方法優(yōu)化:替換舊方法(如蜂蠟用自動化熔點測定法替代手動法��、紅外光譜替代濕化學(xué)鑒別)��;升級色譜技術(shù)(如UHPLC替代HPLC提升雜質(zhì)分離效果)��;刪除不必要測試(如蜂蠟刪除皂化值測試,改用酸值滴定液測酯值)���。
3. 參數(shù)與限度調(diào)整:修正雜質(zhì)限度(如氫化可的松雜質(zhì)G限度從0.4%降至0.3%)�����、溶液儲存條件(如氟氫可的松 acetate溶液需5℃儲存并42小時內(nèi)使用)�����、濃度/體積表述(簡化定性溶液的有效數(shù)字)�����。
4. 對照品與試劑統(tǒng)一:用CRS替代普通試劑�����,統(tǒng)一溶劑等級(符合技術(shù)指南)���,修正固定相描述以匹配驗證用色譜柱���。
5. 適用性與合規(guī)性優(yōu)化:新增系統(tǒng)適用性試驗(如普瑞巴林對映體純度的信噪比驗證)�����;調(diào)整溶解時限(布立西坦片從10分鐘放寬至15分鐘);明確產(chǎn)品來源(如氧氣專論明確生產(chǎn)工藝為低溫蒸餾或單級吸附)�����。
六���、制藥用水相關(guān)(Water for Pharmaceutical Use)
注射用水(0169):SWFI部分用TOC測試替代氧化物質(zhì)測試��;新增TOC方法A參考(引自2.2.44),將TOC限度從0.5 mg/L修正為0.50 mg/L�����;修正電導(dǎo)率校準準確性要求�����。
純化水(0008):同步修訂TOC測試參考和限度��、電導(dǎo)率校準要求�����,與注射用水保持一致���,呼應(yīng)2.2.44章節(jié)修訂���。
歐洲藥典12.1
已于2026年1月1日生效
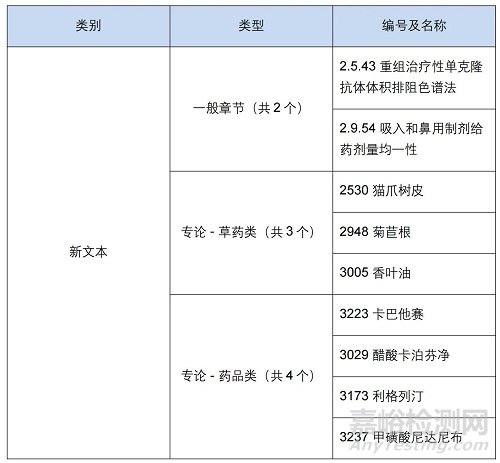
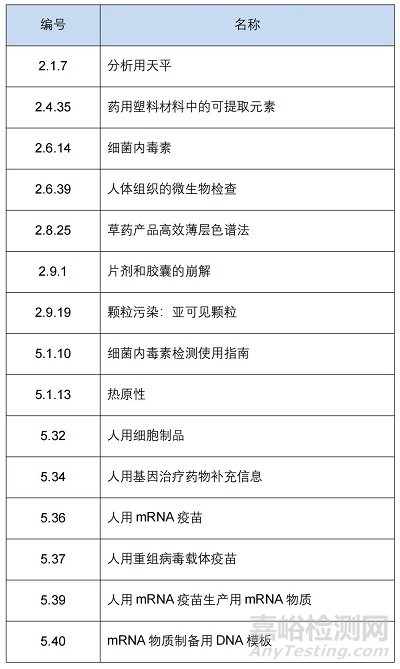
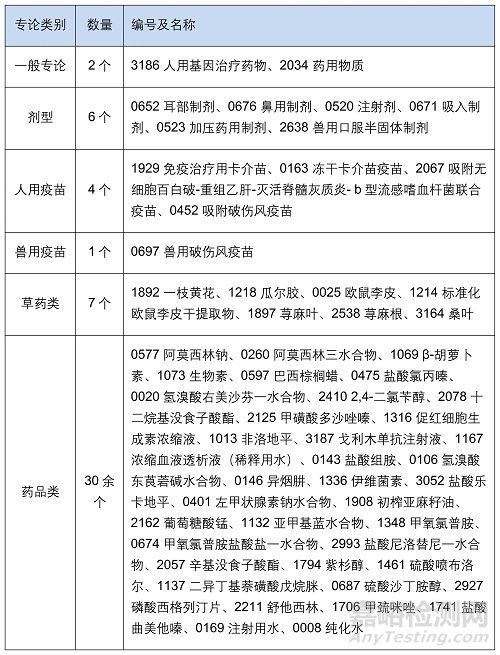
此前��,EDQM還發(fā)布公告新增 2 個通則和 7 個專論���,以及修訂細菌內(nèi)毒素檢測指南��、分析天平���、亞可見顆粒等15個通則和50多個專論?�!军c擊購買最新版歐洲藥典】
(一)新文本詳情
(二)修訂文本詳情
1.通則(共 15 個)
2.專論(多類別�����,共 50 余種)