為驗證生物制藥生產(chǎn)中兩臺 300 L 獨立不銹鋼混合罐的滅菌工藝穩(wěn)定性及無菌保證效果�,采用山東新華 XG1.D 型脈動真空高壓蒸汽滅菌器,設(shè)定脈動抽真空 3 次���、真空限度 -80 kPa�����、121℃滅菌30 min 的工藝參數(shù)����,開展三次獨立驗證試驗����。通過 Ebro 溫度壓力記錄系統(tǒng)(10 個探頭測熱分布、6 個探頭測熱穿透)�,結(jié)合 ATCC7953 嗜熱脂肪芽孢桿菌孢子生物指示劑與化學(xué)指示卡,進行熱性能測試���、微生物挑戰(zhàn)及化學(xué)驗證,利用EbroWinlog.Validation V3.71 軟件計算各點 F0值�。
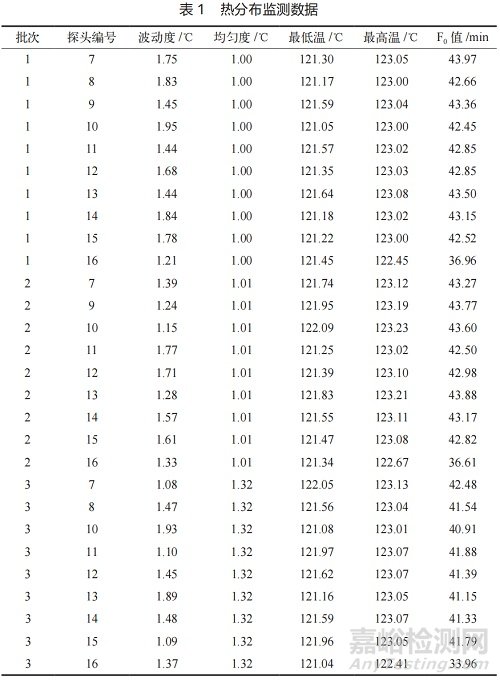
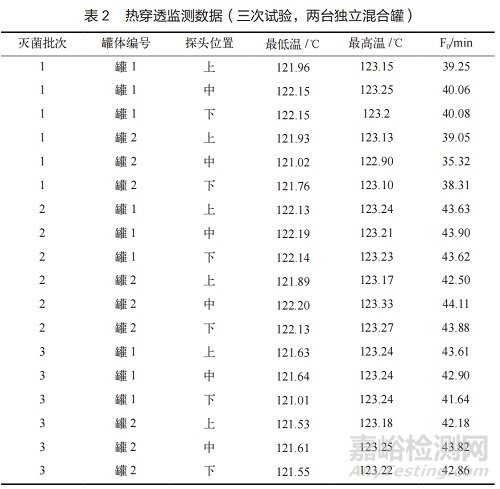
結(jié)果顯示,三次試驗中熱分布溫度波動度≤1.95℃����、均勻度≤1.32℃�,最低溫度≥121.05℃���,F(xiàn)0值均遠超15min�;熱穿透測試中兩臺混合罐上中下各位置最低 F0 值達35.32min���,生物指示劑培養(yǎng)后均無菌生長�����,化學(xué)指示卡均符合標準�。該工藝通過多維度驗證���,可確?;旌瞎薷鞑课粶缇浞智乙恢?��,F(xiàn)0值與生物指示劑殺滅結(jié)果均滿足接受標準�����,工藝穩(wěn)定可靠�,符合藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)要求,適用于實際生產(chǎn)���。
在生物制藥領(lǐng)域����,無菌生產(chǎn)是確保藥品安全性和有效性的核心環(huán)節(jié)���。與產(chǎn)品直接接觸的設(shè)備�����、容器和管路必須經(jīng)過有效的滅菌處理����,以消除所有可能存在的微生物污染風險[1]�。對于大型固定設(shè)備(如混合罐),蒸汽滅菌因其高效��、可靠而成為首選方法��。根據(jù)中國《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010 年修訂)》及其相關(guān)附錄的要求�,關(guān)鍵的滅菌工藝必須經(jīng)過嚴格的驗證���,以證明其重現(xiàn)性和有效性[2]���。滅菌工藝驗證通常包括安裝確認(IQ)�、運行確認(OQ)和性能確認(PQ)�����,其中性能確認的核心內(nèi)容即為熱分布和熱穿透測試����,并結(jié)合微生物挑戰(zhàn)試驗[3]。本研究旨在依據(jù)法規(guī)和行業(yè)標準�,對某生物制品生產(chǎn)企業(yè)用于物料混合的兩臺 300 L 獨立不銹鋼混合罐的滅菌工藝進行全面的性能確認。通過科學(xué)布點及連續(xù)三次試驗���,系統(tǒng)評估滅菌器腔室及罐體內(nèi)部的熱力學(xué)性能和實際滅菌效果�����,為該工藝在生產(chǎn)中的應(yīng)用提供可靠的數(shù)據(jù)支持�。
Part.01材料與方法
1設(shè)備與儀器
驗證試驗采用經(jīng)確認符合規(guī)范要求的滅菌設(shè)備����、待滅菌混合罐系統(tǒng)以及校準合格的數(shù)據(jù)采集裝置���,具體配置與技術(shù)參數(shù)如下:
滅菌設(shè)備:采用 XG1.D 型脈動真空滅菌器(由山東新華醫(yī)療器械股份有限公司生產(chǎn)),產(chǎn)品標準為YZB/魯0237-2008����,注冊號為魯食藥監(jiān)械(準)字 2008 第2570278號。容器設(shè)計溫度為150℃���,容積為 2.5m3���。本次驗證參數(shù)設(shè)定為:脈動抽真空 3 次,真空限度為-80kPa�����,溫度 121℃�,滅菌時間 30min ;
待滅菌設(shè)備:包括兩臺 300L 不銹鋼獨立混合罐(由上海森松制藥設(shè)備工程有限公司制造����,編號分別為罐1、罐 2)����,工作容積為 0.3m3����,執(zhí)行標準為 NB/T47003.1-2009����。每臺罐的進�����、出液口均配置賽多利斯 0.2μm PTFE膜 Midisart 2000 空氣過濾器(型號17805G)���;
數(shù)據(jù)采集系統(tǒng):使用 Ebro 溫度壓力記錄儀(溫度探頭 EBI12T 的量程為 -85℃ ~+150℃ �����;壓力探頭 EBI12-TP 的量程為 -0.09~1 MPa)���,配套讀卡器 EBI-IF-200,數(shù)據(jù)處理軟件為 Ebro Winlog.Validation V3.71(具備 F0 值計算與審計追蹤功能)���。所有探頭均在有效校準期內(nèi)(校準證書編號 ACC-20250218116 由北京艾科瑞斯科技有限公司出具)���。
2生物與化學(xué)指示物
本驗證選用符合藥典標準的生物指示劑與化學(xué)指示卡作為滅菌效果直接監(jiān)測與過程參數(shù)確認工具�����,其具體配置與性能參數(shù)如下:
生物指示劑(BI):選用嗜熱脂肪芽孢桿菌孢子(ATCC7953)�,孢子量為 1.0×106 ~ 5.0×106CFU/ 支���,D121℃值為 1.5 ~ 3.0 min[4]��。每批次試驗使用 16 支����,由 TerragenS.A. 提供�����;
化學(xué)指示卡:采用新華牌 121℃壓力蒸汽滅菌化學(xué)指示卡�����,批號為24M02�,由山東新華醫(yī)療器械股份有限公司提供。
3方法
本研究通過規(guī)范化的探頭布點����、連續(xù)滅菌循環(huán)測試���、F0值計算、生物指示劑判讀以及接受標準設(shè)定五個關(guān)鍵環(huán)節(jié)實施驗證�����,具體方案如下����。
探頭布點方案
探頭布點方案針對熱穿透測試和熱分布測試分別制定如下布置策略�,并配套設(shè)置相應(yīng)監(jiān)測組件:
熱穿透測試:在兩臺混合罐內(nèi)部各布置3個溫度探頭,分別位于罐內(nèi)上部��、中心部和底部���。每個探頭旁同時放置一支生物指示劑和一張化學(xué)指示卡��;
熱分布測試:在滅菌器腔室內(nèi)布置10個溫度探頭�。位置包括:上左前�����、上左后、上右前����、上右后、下左前����、下左后、下右前����、下右后、中心處以及空載驗證確定的冷點位置[5]���。另有一個帶壓力探頭的記錄儀置于冷凝水排放口�。
試驗過程
連續(xù)進行三次獨立的滅菌循環(huán)�����,每次均按照設(shè)定的滅菌程序運行���。數(shù)據(jù)記錄系統(tǒng)自動記錄各監(jiān)測點的溫度 -時間數(shù)據(jù)�����。
F0值計算
參照制藥行業(yè)滅菌驗證技術(shù)規(guī)范����,軟件根據(jù)如下公式自動計算各探頭的累計 F0 值。
參數(shù)設(shè)定:T= 實時溫度�,T0=121.1℃,Z=10℃����。本次實驗起始溫度為100℃,累計的致命目標時間需≥15min[6]��。用于等效換算滅菌時間�,以確保無菌保障���。
生物指示劑培養(yǎng)與判讀
滅菌結(jié)束后�����,取出生物指示劑��,并將它置于 58 ~ 62℃恒溫培養(yǎng)箱中進行培養(yǎng)��。分別于 10 h 和 14 h 觀察結(jié)果���,總培養(yǎng)時間為 24 h ���。判定標準為:所有測試的生物指示劑均不變色(表示無菌生長),同時陽性對照生物指示劑變色(表示有菌生長[7]�����,方為合格����。
接受標準
接受標準的具體要求如下:
熱分布:腔室內(nèi)各點溫度需在121℃及以上維持時間≥ 30 min,且溫度波動度和均勻度需符合設(shè)備性能要求���;
熱穿透與 F0 值:各混合罐內(nèi)部最冷點的 F0 值≥ 15 min �����;
生物指示劑:所有測試的生物指示劑均無菌生長��;
化學(xué)指示卡:顏色變化達到或深于標準色�����。
Part.02結(jié)果與討論
1熱分布測試結(jié)果
三次試驗的熱分布數(shù)據(jù)(見表 1)顯示���,滅菌器腔室內(nèi)所有 10 個監(jiān)測點的最低溫度均高于 121℃�,最高溫度在122.41℃至 123.23℃之間��。溫度波動度(最高與最低溫度之差)最大為 1.95℃����,均勻度(各點平均溫度的最大差值)最大為 1.32℃,表明滅菌器腔室內(nèi)的熱量分布均勻且穩(wěn)定�����,重現(xiàn)性良好 [8]�����。
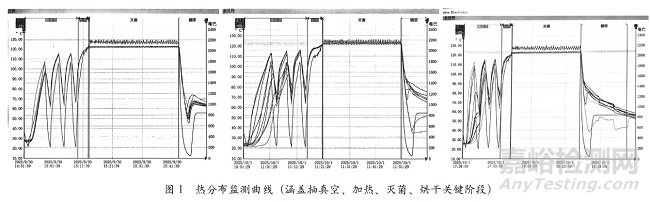
所有探頭的 F0 值均遠高于 15 min 的接受標準���,其中位于冷凝水排放口的16號探頭因溫度略低,F(xiàn)0 值相對較低(最低 33.96 min)�����,但仍遠超標準�����,確認該滅菌程序能為腔室提供充分的過程致死率。如圖1所示的熱分布監(jiān)測曲線(涵蓋抽真空�����、加熱�、滅菌、烘干關(guān)鍵階段)���,可直觀觀察到各階段溫度變化平穩(wěn)�����,無明顯波動�。
2熱穿透與微生物挑戰(zhàn)測試結(jié)果
熱穿透測試數(shù)據(jù)(見表 2)是驗證的核心��,它直接反映了物料(或模擬設(shè)備)內(nèi)部所接收到的實際滅菌效果�����。三次試驗中����,兩臺混合罐內(nèi)6個監(jiān)測點的F0值范圍為35.32min~44.11min���,最低 F0 值出現(xiàn)在第一次試驗中罐 2 的中心位置(35.32 min),但仍遠高于15 min 的接受標準����。這表明混合罐內(nèi)部(包括可能存在氣流死角的區(qū)域)均能接收到足夠的滅菌熱量。與熱穿透探頭共同放置的生物指示劑在經(jīng)過24 h 培養(yǎng)后�,所有 48 支(3 批 ×16 支)均顯示無菌生長,而陽性對照均顯示有菌生長�。此結(jié)果與 F0 值數(shù)據(jù)高度吻合,共同證明了該滅菌工藝能有效殺滅高抗性的嗜熱脂肪芽孢桿菌孢子�����,無菌保證水平(SAL)可達 10-6 或更高[9]�����。所有化學(xué)指示卡的顏色變化均達到或深于標準色�,提供了快速的現(xiàn)場過程確認�。
3討論
本研究成功驗證了在既定參數(shù)下,采用 XG1.D 型脈動真空滅菌器對兩臺300 L 獨立混合罐進行滅菌的工藝穩(wěn)定且有效�����。設(shè)備工況及純蒸汽的干度值、過熱度�、不凝性氣體含量監(jiān)測均符合要求 [10],物理參數(shù)(溫度���、F0 值)與生物參數(shù)(BI 殺滅)均一致滿足預(yù)定的嚴苛接受標準���。
F0 值作為量化滅菌效力的關(guān)鍵參數(shù),其計算基于微生物的 Z 值�����,能夠綜合評估不同溫度下的累積殺菌效果���。本研究中所有位置的 F0 值均顯著高于標準�,為工藝提供了充足的安全邊界�。生物指示劑的成功殺滅,是滅菌工藝有效性的最直接證據(jù)�,符合國內(nèi)外藥典和GMP 對于滅菌驗證的基本要求 [11]。
兩臺混合罐作為獨立系統(tǒng)同時進行滅菌�����,盡管其內(nèi)部各點的 F0 值存在差異,但均達到了規(guī)定標準����,證明了滅菌程序設(shè)計的合理性和滅菌器性能的可靠性。驗證過程中使用了經(jīng)過校準且符合數(shù)據(jù)完整性要求的電子記錄系統(tǒng)����,確保了數(shù)據(jù)的準確性和可追溯性 [12]。
Part.03結(jié)論
通過對熱分布����、熱穿透、F0 值及生物 / 化學(xué)指示劑的綜合評估��,可以得出結(jié)論:在脈動抽真空 3 次���、真空限度為 -80 KPa���、溫度為 121℃、滅菌時間為 30 min 的工藝參數(shù)下��,山東新華 XG1.D 型脈動真空滅菌器能夠穩(wěn)定�����、可靠地使兩臺 300 L 獨立不銹鋼混合罐達到預(yù)定的無菌狀態(tài)���。該滅菌工藝驗證成功��,所有指標均符合藥品 GMP 要求�����,可以正式應(yīng)用于該生物制品的生產(chǎn)過程�����,為保證最終產(chǎn)品的無菌質(zhì)量提供了堅實保障����。
參考文獻
[1] 曹敏靜���,陳富超��,劉暢���,等. 淺析在藥品生產(chǎn)質(zhì)量管理規(guī)范中關(guān)鍵設(shè)備對疫苗生產(chǎn)的影響[J]. 中國設(shè)備工程,2025(19):68-71.
[2] 李瑤.中藥生產(chǎn)監(jiān)督管理專門規(guī)定發(fā)布[N].醫(yī)藥經(jīng)濟報�����,2025-09-15(001). DOI:10.38275/n.cnki.nyyjj.2025.000109.
[3] 令狐霞. 中小型藥企第三方冷鏈物流供應(yīng)商服務(wù)質(zhì)量評價研究[D]. 貴陽:貴州大學(xué),2025. DOI:10.27047/d.cnki.ggudu.2025.001545.
[4] 陳冬梅. 食品微生物檢測實驗室標準菌株的管理措施分析[J]. 食品安全導(dǎo)刊�����,2023(18):27-29+33. DOI:10.16043/j.cnki.cfs.2023.18.015.
[5] 王睿陟���,李世文. 黃芩粉的干熱滅菌工藝研究[J]. 中草藥��,2013���,44(15):2092-2096.
[6] 雒毅,馮煜����,張偉,等. 養(yǎng)正合劑滅菌工藝優(yōu)化與研究[J]. 生物化工���,2025�����,11(04):99-103. DOI:10.20284/j.cnki.swhg.2025.04.018.
[7] 王艦兵��,李鐸���,徐康����,等 . 132℃滅菌法在疫苗生產(chǎn)中的滅菌效果驗證[J]. 中國消毒學(xué)雜志��,2017����,34(05):419-421.
[8] 彭海云�,李安喜,羅路明�����,等. 小型蒸汽滅菌器物理參數(shù)的校準[J]. 大眾標準化�����,2025(06):190-192.
[9] 牟怡平����,張揚����,鄭中陽����,等. 3D生物打印臨床應(yīng)用的倫理困境與法律規(guī)制研究[J]. 醫(yī)學(xué)與哲學(xué),2025�,46(19):37-40+45.
[10] 王世輝,田繼釗�����,郭瑩�����,等. 制藥蒸汽系統(tǒng)設(shè)計研究[J]. 機電信息���,2020(33):86-89. DOI:10.19514/j.cnki.cn32-1628/tm.2020.33.048.
[11] 張林爽�����,李玨�����,鄭小玲���,等. 中國無菌藥品生產(chǎn)過程控制回顧與展[J]. 中國藥品標準����,2023�����,24(06):573-578.DOI:10.19778/j.chp.2023.06.003.
[12] 任群紅.食品安全監(jiān)管中農(nóng)藥殘留檢測難點及優(yōu)化路徑分析[J]. 食品安全導(dǎo)刊�����,2025�����,19(26):18-20. DOI:10.16043/j.cnki.cfs.2025.26.049.