【摘要】目的:總結(jié)分析質(zhì)量源于設(shè)計(jì)(Quality by Design��,QbD)理念在口腔膜劑的處方設(shè)計(jì)與評(píng)價(jià)中的應(yīng)用���,以期為研究者提供參考�����。方法:結(jié)合QbD的主要元素�����、實(shí)施步驟及輔助工具和基于QbD的口腔膜劑研發(fā)實(shí)例�����,對(duì)口腔膜劑的目標(biāo)產(chǎn)品質(zhì)量概況���、關(guān)鍵物料屬性��、關(guān)鍵工藝參數(shù)及關(guān)鍵質(zhì)量參數(shù)等信息進(jìn)行梳理�����。結(jié)果與結(jié)論:QbD是一種具有明確目標(biāo)的�,基于質(zhì)量風(fēng)險(xiǎn)管理及科學(xué)可靠的產(chǎn)品和工藝開(kāi)發(fā)的理念�����,包括確定目標(biāo)產(chǎn)品質(zhì)量概況和關(guān)鍵質(zhì)量屬性�、風(fēng)險(xiǎn)評(píng)估、實(shí)驗(yàn)設(shè)計(jì)���、設(shè)計(jì)空間控制策略和過(guò)程分析���。口腔膜劑具有溶化快速�����、使用方便��、劑量準(zhǔn)確��、便于攜帶等特點(diǎn)�,服用時(shí)無(wú)需用水送服,適用于有特殊需求的人群����,如用于治療精神病、精神分裂癥���、躁狂癥以及吞咽困難患者�����。QbD理念在常規(guī)劑型研發(fā)中應(yīng)用較多�,在口腔膜劑研發(fā)中應(yīng)用的相關(guān)研究較少��。與傳統(tǒng)方法相比�����,QbD更多應(yīng)用風(fēng)險(xiǎn)管理的科學(xué)知識(shí),識(shí)別影響關(guān)鍵質(zhì)量屬性的關(guān)鍵物料屬性和關(guān)鍵工藝參數(shù)的操作空間����,并持續(xù)進(jìn)行全生命周期管理,更有利于生產(chǎn)和監(jiān)管部門(mén)了解產(chǎn)品的生產(chǎn)工藝及相關(guān)變更信息����。
【關(guān)鍵詞】質(zhì)量源于設(shè)計(jì);口腔膜劑�����;目標(biāo)產(chǎn)品質(zhì)量概況��;關(guān)鍵質(zhì)量屬性����;關(guān)鍵物料屬性;關(guān)鍵工藝參數(shù)
質(zhì)量源于設(shè)計(jì)(Quality by Design,QbD)理念在21世紀(jì)初由美國(guó)食品藥品管理局(FDA)引入制藥行業(yè)[1]��,隨后人用藥品注冊(cè)技術(shù)要求國(guó)際協(xié)調(diào)會(huì)(ICH)出臺(tái)了藥物開(kāi)發(fā)(ICHQ8)[2]��、質(zhì)量風(fēng)險(xiǎn)管理(ICH Q9)[3]和藥物質(zhì)量體系(ICH Q10)[4]等相關(guān)指南��,詳細(xì)闡述了QbD理念。作為一種系統(tǒng)的藥物開(kāi)發(fā)方法�,QbD以預(yù)定義的產(chǎn)品目標(biāo)為起點(diǎn),以科學(xué)的質(zhì)量風(fēng)險(xiǎn)管理為基礎(chǔ)�����,強(qiáng)調(diào)對(duì)產(chǎn)品生產(chǎn)的過(guò)程控制[5]�����。
口腔膜劑作為一種新型膜狀口服固體制劑�,近年來(lái)在國(guó)內(nèi)外得到廣泛應(yīng)用�����,與傳統(tǒng)的片劑��、膠囊�����、丸劑等口服固體制劑比較����,口腔膜劑具有無(wú)需用水送服,不必?fù)?dān)心會(huì)噎住或吸入,生產(chǎn)工藝簡(jiǎn)單和成本較低等優(yōu)勢(shì)��;與口服液體制劑比較��,具有分劑量準(zhǔn)確且便于攜帶等優(yōu)勢(shì)[6]�����。尤其適用于老人��、兒童�����、吞咽困難的患者和一些自主行為不受控制的有精神系統(tǒng)障礙的患者�。對(duì)于通過(guò)頰膜、舌下膜吸收的口腔膜劑���,還可避免首過(guò)效應(yīng)����。若采用適宜的成膜材料可以延緩藥物的釋放����,減少給藥頻率和給藥劑量。另外,由于膜劑特殊的單劑量包裝���,可有效隔絕空氣和水分����,具備良好的化學(xué)穩(wěn)定性��,因此�,越來(lái)越多的藥物被開(kāi)發(fā)成此劑型并推向市場(chǎng)�����,口腔膜劑具有良好的市場(chǎng)前景[7]����。
盡管QbD的理念和優(yōu)勢(shì)已被廣泛接受,但其在制藥行業(yè)中的應(yīng)用尚未被完全開(kāi)發(fā)��,Grangeia等[5]的調(diào)查研究顯示�����,QbD方法主要應(yīng)用于常規(guī)制劑�����。目前對(duì)基于QbD的口腔膜劑產(chǎn)品開(kāi)發(fā)尚不充分,本文通過(guò)梳理QbD的主要元素����、實(shí)施步驟、輔助工具及各國(guó)藥典中口腔膜劑的收載情況���,概述了QbD在口腔膜劑研發(fā)中的應(yīng)用�����,并對(duì)國(guó)內(nèi)外已上市的部分口腔膜劑進(jìn)行了總結(jié)���。
01質(zhì)量源于設(shè)計(jì)的執(zhí)行步驟及在口腔膜劑研發(fā)中的相關(guān)應(yīng)用
QbD理念是指藥品質(zhì)量不依賴于產(chǎn)品的最終檢測(cè),而需通過(guò)評(píng)估和細(xì)化生產(chǎn)工藝��,確定關(guān)鍵物料屬性(Critical Material Atributes,CMAs)及關(guān)鍵工藝參數(shù)(Critical Process Parameters,CPPs)與關(guān)鍵質(zhì)量屬性(Critical Quality Attributes,CQAs)的關(guān)系�,創(chuàng)建工藝設(shè)計(jì)空間(Design Space),結(jié)合質(zhì)量風(fēng)險(xiǎn)評(píng)估(Risk Assessment,RA)建立更優(yōu)的控制策略���,為產(chǎn)品生產(chǎn)和質(zhì)量控制提供保證��,使產(chǎn)品生產(chǎn)過(guò)程在批準(zhǔn)的設(shè)計(jì)空間內(nèi)進(jìn)行工藝變更����,無(wú)需額外進(jìn)行監(jiān)管批準(zhǔn),從而實(shí)現(xiàn)靈活的工藝控制���,主要包括定義目標(biāo)產(chǎn)品質(zhì)量概況(QualityTarget Product Profile,QTPP)和CQAs���,通過(guò)RA確定CMAs和CPPs,通過(guò)實(shí)驗(yàn)設(shè)計(jì)(Design ofExpeniment,DoE)界定CMAs�����、CPPs和CQAs之間的函數(shù)關(guān)系�����,確定設(shè)計(jì)空間和控制空間(ControlSpace)以獲得最優(yōu)產(chǎn)品����,同時(shí)應(yīng)用過(guò)程分析技術(shù)(Process Analytical Technology,PAT)通過(guò)對(duì)關(guān)鍵參數(shù)的實(shí)時(shí)監(jiān)測(cè)來(lái)確保生產(chǎn)處于設(shè)計(jì)空間內(nèi)[2-4]���。
1.1 QTPP和CQAs
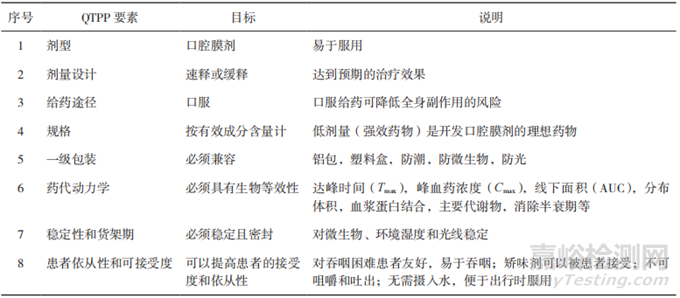
明確QTPP是實(shí)施QbD的第一步�。ICHQ8將QTPP定義為“從理論上達(dá)到對(duì)藥品質(zhì)量特性的前瞻性總結(jié)�����,確保預(yù)期的質(zhì)量,同時(shí)兼顧藥品的安全性和有效性”[2]�����。FDA發(fā)布了簡(jiǎn)略新藥申請(qǐng)(Abbreviated New Drug Application,ANDA)的QbD[8-9]����,介紹了開(kāi)發(fā)早期由原研產(chǎn)品特點(diǎn)、說(shuō)明書(shū)�����、質(zhì)量標(biāo)準(zhǔn)及臨床給藥特點(diǎn)等方面總結(jié) QTPP 的方法����。同樣地,在開(kāi)發(fā)口腔膜劑的過(guò)程中����,QTPP可以從劑型、規(guī)格����、給藥途徑����、藥動(dòng)學(xué)���、穩(wěn)定性等方面入手��。以上這些質(zhì)量要求被稱為質(zhì)量屬性(Quality Attributes��,QA)���,其中受制劑處方或生產(chǎn)工藝等變動(dòng)影響較大的 CQAs 是藥物開(kāi)發(fā)過(guò)程的研究重點(diǎn)。表 1 對(duì)口腔膜劑的 QTPP 要素進(jìn)行了分析和說(shuō)明���。
▲表1-口腔膜劑的 QTPP 要素和說(shuō)明
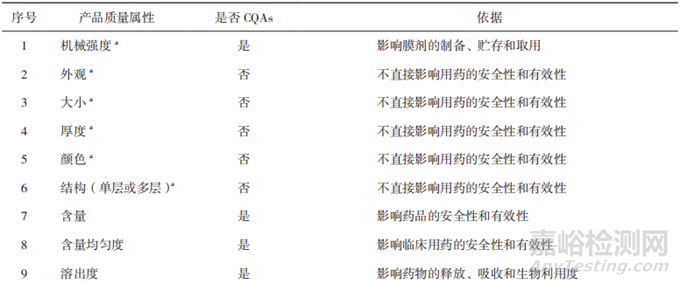
為了保證藥品質(zhì)量的安全��、有效、可控��,口腔膜劑的質(zhì)量研究及控制需要結(jié)合劑型特點(diǎn)進(jìn)行確定�����,除了要包含與普通口服制劑相同的常規(guī)檢查項(xiàng)目����,如鑒別�����、含量���、含量均勻度、有關(guān)物質(zhì)��、微生物限度外���,還要有特殊的控制指標(biāo)��,如性狀�、機(jī)械性能�����、溶化時(shí)限�、溶出度等。其中機(jī)械性能指標(biāo)(如耐折度�����、斷裂強(qiáng)度、抗拉強(qiáng)度等)和生物學(xué)特性指標(biāo)(如崩解時(shí)限/溶化時(shí)限��、溶出度����、刺激性等)需要特別關(guān)注[10]。表2基于產(chǎn)品在不符合某項(xiàng)質(zhì)量屬性時(shí)對(duì)患者可能造成危害的嚴(yán)重程度�����,分析了口腔膜劑的CQAs¹[11-12]���。根據(jù)口腔膜劑的特點(diǎn)及CQAs,建議重點(diǎn)關(guān)注口腔膜劑的口感�����、水分�����、溶化時(shí)限、溶出度以及機(jī)械性能���。
▲表2-口腔膜劑的 CQAs
適口性:口腔膜劑應(yīng)口感良好�,為了滿足依從性要求,建議在臨床研究過(guò)程中關(guān)注給藥方式(口腔中的放置位置�、溶化時(shí)限等)、黏膜黏附性和刺激性���、口腔局部不良反應(yīng)���、口感評(píng)價(jià)等[13]。
水分殘留:口腔膜劑中應(yīng)含有適量的水分�����,以保障口腔膜劑具有適宜的機(jī)械性能��,避免包裝���、運(yùn)輸過(guò)程中發(fā)生磨損或破碎�����。
溶化時(shí)限:《中華人民共和國(guó)藥典》2020年版膜劑通則項(xiàng)下并未規(guī)定溶化時(shí)限檢查的相關(guān)要求��,但溶化時(shí)限是口腔膜劑藥學(xué)質(zhì)量研究及控制中需關(guān)注的重要指標(biāo)之一�����。在注冊(cè)檢驗(yàn)工作中���,發(fā)現(xiàn)部分藥品生產(chǎn)企業(yè)參考口崩片的檢查方法和限度擬定口腔膜劑的相關(guān)方法和限度����,如采用900mL水作為介質(zhì)�,與口腔膜劑在口腔內(nèi)的實(shí)際使用環(huán)境有較大差異。因此建議模擬口腔膜劑使用方法及口腔環(huán)境�����,建立可行的溶化時(shí)限檢查方法(少量溶劑)��,結(jié)合臨床試驗(yàn)中在受試者口腔中的溶化時(shí)限及相關(guān)性考察�����,為方法及限度提供合理依據(jù)�����。
溶出度:在口腔膜劑開(kāi)發(fā)的初期風(fēng)險(xiǎn)評(píng)估中���,溶出度通常是高風(fēng)險(xiǎn)質(zhì)量屬性��,應(yīng)重點(diǎn)關(guān)注��。在開(kāi)展口腔膜劑溶出度方法開(kāi)發(fā)時(shí)����,建議考慮口腔膜劑質(zhì)輕易漂浮等制劑特點(diǎn)���,關(guān)注溶出裝置���、溶出試驗(yàn)參數(shù)、取樣時(shí)間點(diǎn)等選擇的合理性��,建立合適的����、具有一定區(qū)分能力的溶出度檢查方法。在證明溶出方法區(qū)分能力時(shí)�,可制備CMAs、CPPs和關(guān)鍵處方組成發(fā)生變化(例如參數(shù)在設(shè)定值±10%的變化)的樣品����,提供不同樣品溶出曲線對(duì)比數(shù)據(jù)[14]。對(duì)于難溶性藥物制備的口腔膜劑,建議建立的溶出度檢查方法對(duì)不同粒徑的處方具有一定的區(qū)分能力[14]�����。
機(jī)械強(qiáng)度:機(jī)械性能在口腔膜劑的給藥便利性和穩(wěn)定性方面均有重要影響[10]���。建議根據(jù)口腔膜劑的臨床使用場(chǎng)景和特點(diǎn)�����,關(guān)注產(chǎn)品商業(yè)包裝和運(yùn)輸裝載方式��,進(jìn)行模擬裝載�、運(yùn)輸�、隨身攜帶(可能涉及跌落、撞擊�、皺褶等情況)的研究,對(duì)可能產(chǎn)生的膜片碎裂等情況進(jìn)行考察���?���?谇荒C(jī)械性能的評(píng)價(jià)指標(biāo)可參考但不限于以下項(xiàng)目[10,14]:(1)伸長(zhǎng)率(Elongation Percent):當(dāng)施加拉力時(shí)���,薄膜樣品會(huì)拉伸產(chǎn)生形變��。伸長(zhǎng)率為薄膜伸長(zhǎng)量占原來(lái)長(zhǎng)度的百分率���。薄膜伸長(zhǎng)率一般隨增塑劑含量的增加而增加;(2)楊氏模量(Young's Modulus):楊氏模量也稱彈性模量是衡量薄膜剛度的參數(shù)���,表示為彈性變形區(qū)域的應(yīng)力與應(yīng)變之比�;(3)抗拉強(qiáng)度(Tensile Strength):是薄膜樣品在某一點(diǎn)斷裂時(shí)施加的最大應(yīng)力�����,計(jì)算方式為用斷裂時(shí)施加的力除以薄膜的橫截面積�����;(4)抗撕裂性(TearResistance):是撕裂薄膜所需的最大力�����,記錄為抗撕裂值(單位為牛頓或磅)�����;(5)耐折度(FoldingEndurance):耐折度是通過(guò)將薄膜在同一位置反復(fù)折疊直至薄膜破裂來(lái)確定的,薄膜折疊不斷裂的次數(shù)計(jì)為耐折度值�����。耐折度可用于模擬臨床實(shí)際使用�����、運(yùn)輸���、貯藏過(guò)程對(duì)薄膜性能的影響��。建議結(jié)合口腔膜劑生產(chǎn)工藝過(guò)程控制��、穩(wěn)定性過(guò)程中的機(jī)械性能研究結(jié)果����,合理擬定可接受標(biāo)準(zhǔn)���,并考慮是否訂入質(zhì)量標(biāo)準(zhǔn)[15]���。
1.2 風(fēng)險(xiǎn)評(píng)估和確定CMAs和CPPs
在建立了目標(biāo)產(chǎn)品的QTPP和CQAs后,需要對(duì)處方變量和工藝參數(shù)進(jìn)行風(fēng)險(xiǎn)評(píng)估�����,確定CMAs和CPPs。風(fēng)險(xiǎn)評(píng)估是實(shí)施QbD的重要工具����,也是質(zhì)量風(fēng)險(xiǎn)管理的第一步,這一過(guò)程包括識(shí)別�、分析和評(píng)估,用于識(shí)別風(fēng)險(xiǎn)發(fā)生的可能性及其后果和嚴(yán)重程度[3]�。常見(jiàn)的風(fēng)險(xiǎn)評(píng)估工具包括:石川圖/魚(yú)骨圖�����、失效模式及后果分析(Failure Mode andEffects Analysis,FMEA)����、故障樹(shù)形圖分析、危害分析和關(guān)鍵控制點(diǎn)分析等[3]�����。CMAs指處方中每種物料自身需控制的物理���、化學(xué)或生物特征���,口腔膜劑的CMAs包括活性成分(Active PharmaceuticalIngredient,API)的粒度分布����、晶型�、雜質(zhì)譜、溶解度���;成膜材料的黏度等級(jí)�����、粒度分布�����、水分含量���;增塑劑的純度、水分含量�、黏度等屬性。Thabet等[16]根據(jù)ICH的相關(guān)指南����,針對(duì)口腔膜劑從實(shí)驗(yàn)室規(guī)模到連續(xù)生產(chǎn)過(guò)程的開(kāi)發(fā)給出了石川圖���,該研究結(jié)果顯示,將口腔膜劑制備工藝從實(shí)驗(yàn)室規(guī)模轉(zhuǎn)化到連續(xù)工業(yè)化生產(chǎn)規(guī)模時(shí)�����,黏度和干燥溫度屬于CPPs,需要根據(jù)具體產(chǎn)品仔細(xì)選擇這些參數(shù)�。如果選擇不當(dāng),會(huì)導(dǎo)致薄膜的機(jī)械性能不穩(wěn)定�,還會(huì)使薄膜中產(chǎn)生氣泡,在采用較高干燥溫度(大于120℃)時(shí)這種情況較常發(fā)生�。Visser等[17]在對(duì)臨時(shí)制備的口腔膜劑進(jìn)行研究時(shí),首先基于目標(biāo)產(chǎn)品確定并量化CQAs���,即機(jī)械性能和崩解時(shí)間,確定了聚合物百分比�����、增塑劑比例及干燥時(shí)間等為CPPs�,同時(shí)運(yùn)用響應(yīng)面法研究這些CPPs對(duì)CQAs的影響。結(jié)果顯示�����,制備口腔膜劑時(shí)所用的甘油百分比對(duì)抗拉強(qiáng)度和楊氏模量有直接影響,聚合物[羥丙甲纖維素(HPMC)]含量會(huì)影響口腔膜劑的崩解時(shí)間�����,干燥溫度會(huì)影響伸長(zhǎng)率���?�?傮w而言�����,此項(xiàng)研究提供了一個(gè)設(shè)計(jì)空間�����,在這個(gè)空間內(nèi)�����,工藝參數(shù)可以在一定范圍內(nèi)變動(dòng)�,均能制備出高質(zhì)量的口腔膜劑�����。
1.2.1 口腔膜劑的處方組成
口腔膜劑的處方組成主要包括活性成分����、成膜材料和增塑劑�����。此外��,出于加快口腔膜劑的崩解速率��,改善口感和外觀��,以及提高產(chǎn)品穩(wěn)定性等的考慮��,還會(huì)增加崩解劑���、矯味劑����、著色劑、穩(wěn)定劑和表面活性劑等其他組分�����。表3總結(jié)了口腔膜劑的典型處方組成[18]。在口腔膜劑的配方和開(kāi)發(fā)過(guò)程中所使用的所有輔料均被認(rèn)為是安全的(已列入公認(rèn)安全物質(zhì)清單)����,從監(jiān)管角度來(lái)看,應(yīng)允許其用于口服藥物制劑[19]�。
▲表3-口腔膜劑的典型處方組成
API的基本性質(zhì),如溶解性��、晶型����、粒度和生物藥劑學(xué)分類系統(tǒng)(Biopharmaceutical ClassificationSystem,BCS)等都可能對(duì)制劑質(zhì)量產(chǎn)生影響。理想的膜劑API特征包括低劑量��、口感好��、分子量小��、在唾液中溶解度大且穩(wěn)定性好�。水溶性API通常不存在分布均勻性的問(wèn)題。不溶于水的API可通過(guò)研磨�、微粉化或以納米晶體或微膠囊等形式添加以保持分布均勻[20-21]。許多API具有苦味��,對(duì)兒童來(lái)說(shuō)難以接受,如利培酮�����、阿立哌唑味苦���,可以選擇加入矯味劑進(jìn)行掩味以改善口感[22]�����;如原料藥口感極苦�,刺激性較強(qiáng)�����,或劑量較大����,通常不建議開(kāi)發(fā)成口腔膜劑。
成膜材料是口腔膜劑中主要的骨架材料�,多為高分子親水性材料,具有良好的延展性���、物理性能和適宜的黏度,能夠快速溶解或溶脹,通常包括纖維素類衍生物��、合成高分子材料類�����,如HPMC����、羥丙纖維素、聚乙烯醇���、聚氧乙烯��、聚維酮���、明膠、黃原膠等[23]��。成膜劑的種類和用量對(duì)口腔膜劑的載藥量��、外觀���、機(jī)械性能�、溶化時(shí)限��、溶出度等均有影響�����。理想的成膜材料應(yīng)具備以下特征:無(wú)毒,無(wú)刺激性����,口感好��,能保持長(zhǎng)期穩(wěn)定性,不改變處方中API和其他輔料的性質(zhì)��,有良好的潤(rùn)濕性和延展性��,不會(huì)延長(zhǎng)膜的溶化時(shí)間且具有最佳剝離強(qiáng)度和拉伸強(qiáng)度[24]���。
增塑劑也是膜劑處方中的重要組成成分,可降低成膜劑的玻璃化轉(zhuǎn)變溫度��,改善口腔膜劑的柔韌性���,提高藥膜的機(jī)械性能��,對(duì)溶化時(shí)限���、溶出度等均有影響[25],有利于膜劑的裁切��、包裝��,使之便于貯存�����、服用。常用的增塑劑主要包括聚乙二醇����、甘油����、丙二醇�����、聚山梨酯等。增塑劑能改變口腔膜劑的機(jī)械性能���,若其用量不當(dāng)會(huì)導(dǎo)致膜的開(kāi)裂和剝離,甚至一些增塑劑會(huì)影響藥物的吸收速率[26]����。
口腔膜劑輔料成分還可選擇性地添加甜味劑、唾液刺激劑、表面活性劑以及著色劑等輔料��??谇荒?yīng)口感良好,對(duì)口腔黏膜無(wú)刺激性���。在口腔膜劑的處方開(kāi)發(fā)中,需要特別關(guān)注外觀和適口性�����。根據(jù)依從性的需要����,可添加矯味劑或采用合適的掩味技術(shù)改善口感,例如一些原料藥的適口性不佳����,對(duì)兒童患者來(lái)說(shuō)特別難以接受����,可用矯味劑或包合技術(shù)來(lái)調(diào)節(jié)口腔膜劑的口味,掩蓋不良?xì)馕?,提升口感。常用的矯味劑包括三氯蔗糖����、阿司帕坦等���。口腔膜劑的外觀應(yīng)完整��、光潔���、薄厚一致��、色澤均勻�����、無(wú)明顯氣泡�。為了改善一些難溶性原料藥的分散均勻性�,通常需要加入表面活性劑來(lái)避免原料藥的團(tuán)聚。另外����,如果處方中使用穩(wěn)定劑、抗氧劑等輔料����,需提供合理依據(jù)[23]���。
1.2.2 口腔膜劑的制備方法
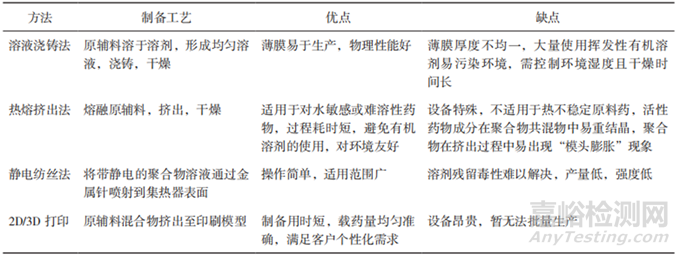
口腔膜劑的制備方法有溶液澆鑄法(SolventCasting,SC,又稱“流延法”“涂布法”)、熱熔擠出法(Hot-Melt Extrusion,HME)���、半固體澆鑄法(Semisdlid Casting, SSC)�、靜電紡絲法(Flectnospinning)�����、2D/3D打印(2D or 3D Printing)等���,其中最常用的方法是溶液澆鑄法和熱熔擠出法。近年來(lái)�����,靜電紡絲法����、2D/3D 打印等新技術(shù)也得到了較好的發(fā)展。Lee等[27]和Musazzi等[28]對(duì)用于口腔膜劑生產(chǎn)的不同技術(shù)進(jìn)行了全面綜述�����。Turkovi等[29]對(duì)2008年11月至2022年4月發(fā)表的112篇口腔膜劑相關(guān)文獻(xiàn)進(jìn)行數(shù)據(jù)采集和分析,發(fā)現(xiàn)在許多研究中�����,采用了2種或多種制造方法�,最常用的方法是溶液澆鑄法,在Turkovi等分析的112篇文章中有123項(xiàng)研究采用了溶液澆鑄法��,其次分別是3D打印(12項(xiàng)研究)���、2D打印(10項(xiàng)研究)���、靜電紡絲法(8項(xiàng)研究)和熱熔擠出法(2項(xiàng)研究)。表4對(duì)口腔膜劑的部分制備方法的優(yōu)缺點(diǎn)進(jìn)行了比較��。
▲表4-口腔膜劑的部分制備方法的優(yōu)缺點(diǎn)
溶液澆鑄法是一種廣泛應(yīng)用于聚合物薄膜制備的方法��,所獲得的薄膜可以包括選定的原料藥����,或者可以制備為無(wú)藥膜,用作2D打印的基材���。雖然可以使用不同的溶劑鑄造方法����,但它們都基于相同的步驟:(1)在所選的液體載體中制備含有成膜劑和其他成分的分散體;(2)鑄造�;(3)薄膜干燥;(4)切割成所需的形狀(如適用)�。這種方法可以相對(duì)簡(jiǎn)單地鑄造單層和多層薄膜[22]。此外����,鑄造分散體可以裝載微顆粒或納米顆粒�,以便均勻地加入更高劑量的不溶性活性成分[30-31]。在薄膜澆鑄過(guò)程中必須考慮干燥方式以及干燥溫度��。盡管在較低溫度下較慢地干燥可以獲得更好的力學(xué)性能�����,但為了滿足大規(guī)模工業(yè)生產(chǎn)的要求���,必須適當(dāng)優(yōu)化干燥時(shí)間。為了提高藥物的穩(wěn)定性[25]或提高藥物的溶出率���,研究者們探索了冷凍干燥作為鑄造分散干燥的替代方法����。據(jù)報(bào)道,凍干后的樣品孔隙率更高���,崩解速度更快��,力學(xué)性能受損對(duì)原料藥穩(wěn)定性和溶出速率的影響并不明顯[32-34]�����。
熱熔擠出法在生產(chǎn)過(guò)程中不需要使用溶劑���,主要通過(guò)單螺桿或雙螺桿擠出機(jī)來(lái)制備膜劑,將藥物與高分子聚合物成膜材料及其他輔料從漏斗加入進(jìn)料區(qū)���,送入熱熔區(qū)后逐漸熔化混勻��,利用高溫和剪切力使原料藥和聚合物熔融共混�����,熔化的混合物持續(xù)通過(guò)配量區(qū)輸出��,澆入選定形狀的模具����,冷卻后即形成膜劑。熱熔擠出法被認(rèn)為是口腔膜劑制造的一種新興技術(shù)�,作為一種無(wú)溶劑的方法,在處理對(duì)水敏感的藥物時(shí)��,可能比溶液澆鑄法具有優(yōu)勢(shì)[35]����。
靜電紡絲法是一種將帶靜電的聚合物溶液通過(guò)金屬針噴射到集熱器表面以制備超細(xì)纖維的方法。溶劑迅速蒸發(fā)導(dǎo)致在收集器上形成無(wú)紡布纖維墊����。科研人員對(duì)聚乙烯醇和聚維酮作為制備靜電紡纖維的基體進(jìn)行了廣泛的研究�����。以這種方式制備的膜的主要優(yōu)點(diǎn)是高度多孔結(jié)構(gòu)和表面積的增加����,與唾液接觸后幾乎立即崩解和藥物快速溶解[36-38]��。
研究人員對(duì)于使用不同的打印技術(shù)作為新型口腔膜劑制造方法的研究興趣日益增加。2D打印����,也稱為噴墨打印,是一種非接觸的方法���,可以將小滴的油墨沉積到合適的承印物上����。雖然可以使用不同的襯底�,但最常用的是溶劑型薄膜[39]。在這種情況下���,薄膜的機(jī)械性能尤其重要���,因?yàn)樗枰惺苡∷⑦^(guò)程中的額外磨損。3D打印是一種增材制造技術(shù)�����,它可以根據(jù)預(yù)先設(shè)計(jì)的數(shù)字模型�,通過(guò)連續(xù)的材料沉積和熔融來(lái)制造三維物理對(duì)象。根據(jù)目前的數(shù)據(jù)集�,只有基于擠出的3D打印被用于口腔膜劑打印�����,包括熔融沉積建模(FDM)和半固體擠壓(SSE)[40-42]����。
1.3 實(shí)驗(yàn)設(shè)計(jì)(DoE)、設(shè)計(jì)空間和控制策略
DoE是QbD常用工具���,用于確定影響研發(fā)過(guò)程的輸入因素(如CMAs����、CPPs)和輸出因素(如CQAs)之間的關(guān)系�����,最終確定最佳工藝條件和設(shè)計(jì)空間[4]�。DoE一般包括篩選和優(yōu)化設(shè)計(jì)。Plackett-Burman設(shè)計(jì)是常用的篩選設(shè)計(jì)��。響應(yīng)面法是一種廣泛使用的優(yōu)化方法,包括中心復(fù)合設(shè)計(jì)��、Box-Behnken設(shè)計(jì)等,運(yùn)用數(shù)學(xué)模型和統(tǒng)計(jì)分析方法�,考察各變量或變量之間交互作用對(duì)CQAs的影響,從而獲得最優(yōu)條件[43]�����。
合理的DoE將有效減少實(shí)驗(yàn)次數(shù),降低研究成本并確保結(jié)果可靠����,設(shè)計(jì)空間內(nèi)的處方、工藝可最大限度地實(shí)現(xiàn)產(chǎn)品所需的CQAs��。Sonal Mazumder等[44]采用QbD方法�����,探索制劑組方和工藝變量對(duì)口腔膜劑質(zhì)量的影響�。以拉莫三嗪作為模型藥物,采用溶液澆鑄法進(jìn)行制備���。制劑組方變量有增塑劑(山梨醇)與成膜劑(預(yù)糊化豌豆淀粉)的比例(0.3~0.6)��。工藝變量有干燥溫度(35~55℃)�����、干燥室內(nèi)的空氣流速(121~265 CFM)���、干燥時(shí)間(20~40 min)及薄膜的濕膜厚度(250~350 μm)。用高效液相色譜(HPLC)法測(cè)定拉莫三嗪含量和含量均勻性,對(duì)拉莫三嗪口腔膜劑進(jìn)行外觀性狀��、厚度����、重量�����、崩解時(shí)限���、水分含量和引濕性���、溶出速率、機(jī)械性能等多方面表征��。采用確定性篩選實(shí)驗(yàn)設(shè)計(jì)來(lái)識(shí)別和歸類影響CQAs的組方和工藝變量��。此項(xiàng)研究共制備并評(píng)估了14種實(shí)驗(yàn)室規(guī)模的DoE組方�,對(duì)機(jī)械性能(斷裂伸長(zhǎng)率、屈服應(yīng)力�、楊氏模量、耐折度)及其他CQAs(干燥后厚度���、崩解時(shí)限�、溶出速率、水分��、吸濕率����、含量和含量均勻度)進(jìn)行了測(cè)定。對(duì)實(shí)驗(yàn)數(shù)據(jù)進(jìn)行多因素分析和方差分析(ANOVA)�,結(jié)果表明,影響機(jī)械性能的主要因素是增塑劑與成膜劑的比例及干燥溫度��;干燥過(guò)程中的空氣流速及增塑劑與成膜劑的比例對(duì)溶出速率影響較大����;濕膜厚度和增塑劑比例直接影響干膜厚度,但增塑劑比例升高反而導(dǎo)致干膜變薄�����,可能與成膜劑的溶脹特性相關(guān)��;崩解時(shí)限和水分含量未受變量的顯著影響���,含量和含量均勻度均符合要求�����。為了給配方和工藝變量創(chuàng)建設(shè)計(jì)空間����,SonalMazumder等人對(duì)設(shè)計(jì)空間進(jìn)行了優(yōu)化與驗(yàn)證,通過(guò)設(shè)定 CQAs目標(biāo)范圍(如斷裂伸長(zhǎng)率10%~20%���、溶出時(shí)間<6min),驗(yàn)證了優(yōu)化參數(shù)范圍:增塑劑比例0.53~0.6、干燥溫度37~45℃�����、濕膜厚度350 μm�。在此范圍內(nèi),口腔膜劑表現(xiàn)出理想的機(jī)械性能和快速溶出特性��。Rahil Dalal等[45]采用QbD的方法開(kāi)發(fā)和優(yōu)化了阿塞那平舌下膜��,以解決其口服生物利用度低的問(wèn)題�,選用聚環(huán)氧乙烷(PEO)和羥丙甲纖維素(HPMC)作為成膜材料。明確舌下膜的劑型���、給藥途徑��、劑量等質(zhì)量目標(biāo)產(chǎn)品概況要素�,確定相關(guān)CQAs,通過(guò)風(fēng)險(xiǎn)評(píng)估識(shí)別對(duì)CQAs有顯著影響的因素。初步試驗(yàn)確定配方組分��,用溶液澆鑄法制備阿塞那平舌下膜���,利用DoE中的單純形格子設(shè)計(jì)優(yōu)化聚合物PEO N10�����、PEO N80和HPMC E15的配比����,評(píng)估舌下膜的厚度�����、重量差異�����、崩解時(shí)限��、折疊耐力�����、拉伸強(qiáng)度等物理和機(jī)械性能,初步篩選出3種聚合物的配比�����,其崩解時(shí)限���、阿塞那平含量和機(jī)械性能均符合要求���,差式掃描量熱(DSC)分析結(jié)果顯示藥物在膜中以無(wú)定形狀態(tài)存在�,與輔料相容性良好。對(duì)所制備的舌下膜進(jìn)行體外釋放�、離體滲透和體內(nèi)吸收研究,并開(kāi)展統(tǒng)計(jì)分析����,建立線性模型描述聚合物對(duì)舌下膜性能的影響,結(jié)果顯示HPMC濃度主要影響崩解時(shí)間�����,PEO 對(duì)折疊耐力和伸長(zhǎng)率有積極影響��;含高濃度PEO的組方體外釋放快,HPMC E15含量增加會(huì)降低體外釋放速率�。體內(nèi)吸收研究結(jié)果顯示,以家兔作為實(shí)驗(yàn)對(duì)象�����,優(yōu)化后的舌下膜劑5min內(nèi)吸收率達(dá)(31.18±5.01)%,與市售舌下片(29.97±4.88)%相當(dāng)����,但膜劑具有更快的崩解和釋放優(yōu)勢(shì)。Dahmash等[46]開(kāi)發(fā)了一種適用于兒童患者的抗癲癇藥物托吡酯口溶膜���,以解決傳統(tǒng)劑型(如片劑或粉末劑)在兒科用藥中存在的吞咽困難��、劑量靈活性不足等問(wèn)題�����。研究使用了溶液澆鑄法來(lái)制備含有托吡酯的口腔膜劑����,通過(guò)改變聚合物類型[HPMC�、瓜爾膠(GG)或聚乙二醇(PEG)]和濃度(0.4%~1.2%,w/v)、增塑劑類型(甘油或山梨醇)和濃度(0.1%~0.3%,w/v)���,共制備了24種配方����。研究的主要評(píng)估指標(biāo)包括崩解時(shí)間、含量均勻度�、薄膜質(zhì)量和厚度均勻度。使用MODDE軟件進(jìn)行D-optimal設(shè)計(jì)��,選擇了24個(gè)實(shí)驗(yàn)���,結(jié)果表明�,口腔膜劑的崩解時(shí)間在10~90s���,薄膜質(zhì)量(共包括5項(xiàng)�,分別為柔韌性�����、延展性��、不黏附性�����、剝離度和外觀光滑度�����,每項(xiàng)占比20%)在10%~100%,含量均勻度在82%~108.1%,厚度均勻度在1.03%~9.45%����。通過(guò)DoE分析,結(jié)果顯示���,不同配方的口腔膜劑在崩解時(shí)間���、薄膜質(zhì)量、含量均勻度和厚度均勻度等方面存在差異�。模型擬合結(jié)果表明,除薄膜質(zhì)量外���,其他響應(yīng)與所選自變量密切相關(guān)����?�;貧w模型方程揭示了各因素對(duì)響應(yīng)的影響,如聚合物濃度顯著影響崩解時(shí)間����,HPMC能降低崩解時(shí)間,提高含量均勻度和厚度均勻度���。通過(guò)響應(yīng)面圖確定了最佳配方參數(shù)����,使用HPMC作為聚合物���,濃度在0.83%~1.1%,使用甘油作為增塑劑�����,濃度在0.11%~0.3%�����。這些參數(shù)能夠產(chǎn)生崩解時(shí)間小于60s�����、含量均勻度RSD在±5%以內(nèi)、厚度均勻度RSD小于2%的口腔膜劑。
綜上���,實(shí)施QbD的目的不僅限于得到某一最佳處方或工藝��,關(guān)鍵在于建立一種可以在一定范圍內(nèi)調(diào)節(jié)偏差以保證產(chǎn)品質(zhì)量的處方和工藝��,即設(shè)計(jì)空間����。在對(duì)產(chǎn)品和工藝的理解基礎(chǔ)上�����,建立控制策略�,確保生產(chǎn)的產(chǎn)品在設(shè)計(jì)空間設(shè)定的質(zhì)量標(biāo)準(zhǔn)之內(nèi),并進(jìn)行持續(xù)監(jiān)控和改進(jìn)�����,保證產(chǎn)品在生命周期內(nèi)質(zhì)量一致���。
1.4 過(guò)程控制(PAT)
PAT也是QbD開(kāi)發(fā)中的一個(gè)重要工具��。常用的PAT有拉曼光譜�、近紅外光譜、傅里葉變換紅外光譜��、熒光光譜和紫外/可見(jiàn)分光光譜等��。PAT通過(guò)對(duì)藥物制造和生物加工過(guò)程進(jìn)行實(shí)時(shí)近線���、在線或線內(nèi)測(cè)量�,快速���、無(wú)損地提供化學(xué)和物理性質(zhì)信息��,必要時(shí)有可能對(duì)參數(shù)立即進(jìn)行調(diào)整�����,糾正錯(cuò)誤���,增強(qiáng)對(duì)過(guò)程的控制[47]。
由于傳統(tǒng)制藥生產(chǎn)中的離線檢測(cè)(如HPLC等)無(wú)法實(shí)時(shí)監(jiān)控產(chǎn)品的CQAs,PAT通過(guò)實(shí)時(shí)監(jiān)測(cè)可優(yōu)化生產(chǎn)控制��,減少浪費(fèi)��。Florian Hamems等48開(kāi)發(fā)了一種基于反射紅外光譜(Reflectance InfraredSpectroscopy)的過(guò)程分析方法���,用于在線監(jiān)測(cè)口腔膜劑在涂布和干燥過(guò)程中活性藥物成分尼古丁的CQAs,使用甲基丙烯酸-丙烯酸乙酯共聚物為成膜基質(zhì)��,乙醇-水體系溶解尼古丁���,涂布于聚對(duì)苯二甲酸乙二醇酯(Polyethylene Terephthalate,PET)基材上。在涂布生產(chǎn)線末端安裝反射紅外傳感器�����,實(shí)時(shí)采集干燥后薄膜的光譜數(shù)據(jù)(光譜范圍1600~4100 nm)�����。采用偏最小二乘法(PLS)建立定量校準(zhǔn)模型���,評(píng)估不同數(shù)據(jù)預(yù)處理方法[如多元散射校正(MSC)���、一階導(dǎo)數(shù)等]對(duì)模型性能的影響。通過(guò)實(shí)驗(yàn)室小試�,確定尼古丁特征吸收波段(2250~2761 nm),指導(dǎo)生產(chǎn)級(jí)數(shù)據(jù)建模。設(shè)置6種涂布間隙���,采集30組光譜與HPLC參考值對(duì)比�,進(jìn)行實(shí)驗(yàn)校準(zhǔn)。在獨(dú)立生產(chǎn)批次中采集24組樣本���,對(duì)比模型預(yù)測(cè)值與HPLC實(shí)測(cè)值��,進(jìn)行外部驗(yàn)證��。結(jié)果顯示��,尼古丁在2289~2722nm波段表現(xiàn)出顯著吸收���,與C-H鍵振動(dòng)相關(guān),驗(yàn)證了其作為定量分析的依據(jù)��。其中MSC預(yù)處理模型表現(xiàn)最佳�,校準(zhǔn)標(biāo)準(zhǔn)誤差(SEC=0.0172 mg/6.51 cm²)與交叉驗(yàn)證誤差(SECV=0.0176mg/6.51 cm²)高度一致(R²=0.984)。外部驗(yàn)證結(jié)果顯示預(yù)測(cè)誤差(SEP=0.0175mg/6.51cm²),與HPLC結(jié)果相關(guān)性高(R²=0.981),配對(duì)1檢驗(yàn)證實(shí)預(yù)測(cè)值與實(shí)測(cè)值無(wú)顯著差異(p>0.05)��。此項(xiàng)研究顯示反射紅外光譜技術(shù)成功實(shí)現(xiàn)了尼古丁口溶膜生產(chǎn)過(guò)程中API含量的實(shí)時(shí)在線監(jiān)測(cè)����,模型預(yù)測(cè)精準(zhǔn)可靠,滿足PAT框架要求���,突破了傳統(tǒng)離線檢測(cè)的局限����,支持動(dòng)態(tài)工藝調(diào)整,減少材料浪費(fèi)與批次損失�����。
02各國(guó)藥典中口腔膜劑的收載情況及分類
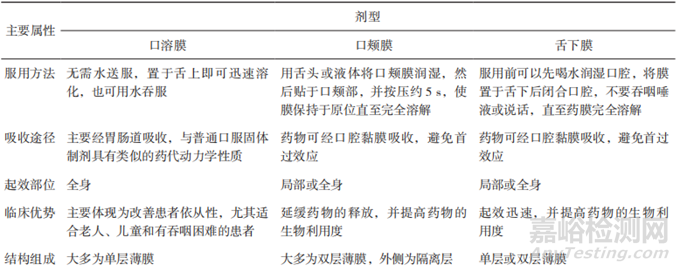
《中華人民共和國(guó)藥典》1985年版即開(kāi)始收載膜劑各論,1990年版增訂了膜劑(Films)通則�,并將其定義為藥物與適宜的成膜材料經(jīng)加工制成的膜狀制劑�����,供口服或黏膜用[49]���。口腔膜劑最早收載在歐洲藥典(EP)口腔黏膜制劑(MucoadhesivePreparations)項(xiàng)下��,按照給藥途徑又分為直接在口中崩解釋藥的口溶膜(Orodispersible Films)和通過(guò)口腔黏膜吸收可避免首過(guò)效應(yīng)的黏附在頰膜和舌下的口頰膜(Buccal Films)[51]�����。2014年����,美國(guó)藥典(USP)也收載了膜劑�,描述為置于口腔內(nèi)的薄片����,可能含有1層或多層��,層中可能含有原料藥,通常是由聚合物構(gòu)成的薄膜材料�,分為快速釋放到口腔的口溶膜(Oral Films)和通過(guò)近端黏膜吸收以避免在胃腸道降解或首過(guò)效應(yīng)而快速起效的頰膜(Buccal Films)和舌下膜(SublingualFilms)[51]�。2021年,日本藥局方(JP)18版增補(bǔ)了口服膜劑(Films for Oral Administration),并在該項(xiàng)下單列了口崩膜(Orally Disintegrating Films)����。表5對(duì)不同種類口腔膜劑的特性進(jìn)行了總結(jié)[52-53]���。目前國(guó)內(nèi)外對(duì)口腔膜劑的稱謂尚無(wú)明確統(tǒng)一的叫法,國(guó)外文獻(xiàn)中出現(xiàn)過(guò)的名稱包括“Fast DissolvingFilm”“Oral Strip”“Oral Film”“OrodispersibleFilms”“Wafers”“Buccal Soluble Film”“BuccalFilm”“Oral Thin Film”“Oral Soluble Film”等[29]����;在我國(guó),對(duì)該類產(chǎn)品的名稱也是多種多樣����,國(guó)內(nèi)文獻(xiàn)和在研產(chǎn)品中出現(xiàn)的名稱有“口溶膜”“口腔貼膜”“口腔速溶膜”“口腔膜”“舌下膜”“口腔貼膜”等����。各國(guó)藥典都對(duì)膜劑的質(zhì)量要求進(jìn)行了規(guī)定��。EP要求膜劑應(yīng)有合適的機(jī)械性能,并能以合適的方法測(cè)定藥物的溶出度���;USP要求膜劑應(yīng)具有合適的溶解速度、合適的強(qiáng)度�����、適宜的口感和口味�;JP要求膜劑的含量均勻度應(yīng)符合規(guī)定��,應(yīng)進(jìn)行溶出度檢查或具有適當(dāng)?shù)谋澜庑阅?����?���!吨腥A人民共和國(guó)藥典》2020年版規(guī)定膜劑應(yīng)取20片進(jìn)行重量差異檢查并按照非無(wú)菌產(chǎn)品進(jìn)行微生物限度檢查���。
▲表5-不同種類口腔膜劑的特性
03口腔膜劑在國(guó)內(nèi)外上市情況
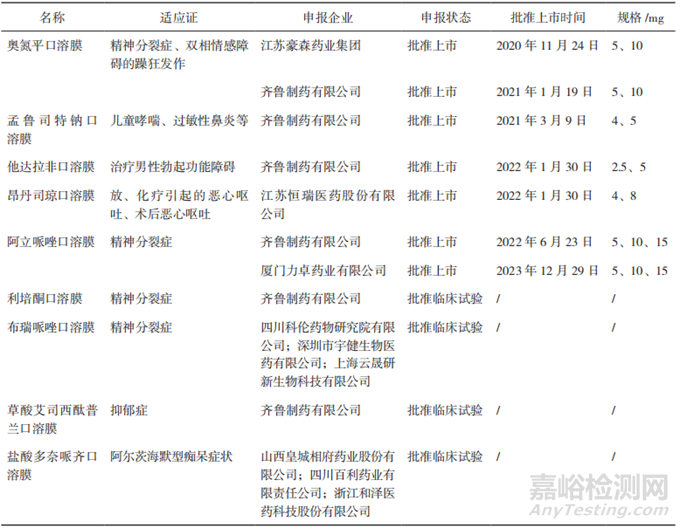
目前國(guó)外上市多款口腔膜劑,適應(yīng)證集中在精神�����、神經(jīng)�����、鎮(zhèn)痛�����、男性勃起功能障礙等���。FDA批準(zhǔn)的口腔膜劑涉及適應(yīng)證較多,例如精神障礙類有鹽酸丁丙諾啡和鹽酸納洛酮的復(fù)方舌下膜(Film/Sublingual)���,鎮(zhèn)痛類有枸櫞酸芬太尼口腔膜(Film/Buccal)、鹽酸丁丙諾啡口腔膜(Film/Buccal)等���;歐盟批準(zhǔn)上市的多為口溶膜���,集中在精神神經(jīng)領(lǐng)域��,活性成分包括利培酮�����、奧氮平�����、鹽酸多奈哌齊等�����,如利培酮口溶膜(Orodispersible Film)、鹽酸多奈哌齊口溶膜(Orodispersible Film)等[22]�����。
我國(guó)企業(yè)在口腔膜劑的布局相對(duì)集中����,活性成分較為多樣����。截至2025年2月�,國(guó)家藥品監(jiān)督管理局官方網(wǎng)站中可以查詢到的已批準(zhǔn)上市的口溶膜劑包括奧氮平口溶膜�����、阿立哌唑口溶膜����、孟魯司特鈉口溶膜��、他達(dá)拉非口溶膜�、昂丹司瓊口溶膜�����、鹽酸美金剛口溶膜��。國(guó)內(nèi)已上市及已提出注冊(cè)申請(qǐng)的精神障礙類治療藥物口溶膜詳見(jiàn)表6��。
▲表6-我國(guó)已上市或已提出注冊(cè)申請(qǐng)的部分口腔膜劑
04結(jié)語(yǔ)與展望
近年來(lái)��,隨著我國(guó)藥物制劑技術(shù)的發(fā)展��,口腔膜劑相關(guān)產(chǎn)品有了較大發(fā)展�,口腔膜劑具有劑量準(zhǔn)確、攜帶方便、快速溶解等優(yōu)勢(shì)�����,F(xiàn)DA評(píng)價(jià)其為傳統(tǒng)劑型中不可取代的新劑型��,已成為多種疾病局部治療和全身性作用治療的有效給藥方式�����。2020年11月��,國(guó)家藥品監(jiān)督管理局批準(zhǔn)了我國(guó)首個(gè)用于精神障礙治療的改良型新藥——奧氮平口溶膜��?����?谇荒╅_(kāi)發(fā)包括傳統(tǒng)方法和基于QbD的優(yōu)化方法�����。傳統(tǒng)方法需先確定工藝參數(shù)的操作范圍及設(shè)定值���,再通過(guò)證明工藝的可重復(fù)性及檢查產(chǎn)品是否符合已確立的標(biāo)準(zhǔn)來(lái)控制口腔膜劑的質(zhì)量�����;而QbD優(yōu)化開(kāi)發(fā)方法則更多應(yīng)用風(fēng)險(xiǎn)管理的科學(xué)知識(shí),識(shí)別影響CQAs的CMAs和CPPs操作空間����,并持續(xù)進(jìn)行全生命周期管理,更有利于生產(chǎn)和監(jiān)管部門(mén)了解產(chǎn)品的生產(chǎn)工藝及相關(guān)變更信息���。
https://www.regulet.com/
參考文獻(xiàn)
[1]Yu LX,Amidon G,Khan MA,et al.UnderstandingPharmaceutical Quality by Design[J].AAPS J,2014,16(4):771-783.
[2]The International Council for Harmonisation of TechnicalRequirements for Pharmaceuticals for Human Use.Pharmaceutical Development Q8(R2)[EB/OL].(2009-08-01)[2025-05-06].https:/database.ich.org/sites/default/files/Q8%28R2%29%20Guideline.pdf.
[3]The International Council for Harmonisation of TechnicalRequirements for Pharmaceuticals for Human Use.QualityRisk Management Q9(R1)[EB/OL].(2020-11-13)[2025-05-06].https://data-base.ich.org/sites/default/files/Q10%20Guideline.pdf.
[4]The International Council for Harmonisation of TechnicalRequirements for Pharmaceuticals for Human Use.PharmaceuticalQuality System Q10 [EB/OL].(2008-06-04)[2025-05-06].https:/database.ich.org/sites/default/files/Q10%20Guideline.pdf.
[5]Grangeia HB,Silva C,Simoes SP,et al.Quality by Designin Pharmaceutical Manufacturing:A Systematic Review ofCurrent Status,Challenges and Future Perspectives[J].EurJPharm Biopharm,2020,147:19-37.
[6]Hoffmann EM,Breitenbach A,Breitkreutz J.Advancesin Omodispersible Films for Drug Delivery[J].Expert Opin Drug Deliv,2011,8(3):299-316.
[7]Borges AF,Silva C,Coelho JFJ,et al.Oral Films:CurrentStatus and Future Perspectives[J].Journal of ControlledRelease,2015,206:1-19.
[8]US Food and Drug Administration.Quality by Designfor ANDAs:An Example for Modified Release DosageForms[EB/OL].(2011-12-11)[2025-05-09].https://www.fda.gov/media/82834/download.
[9]US Food and Drug Administration.Quality by Designfor ANDAs:An Example for Immediate Release DosageForms[EB/OL].(2012-04-26)[2025-05-09].https://www.fda.gov/media/82834/download.
[10]任連杰�����,劉涓����,馬俊威��,等.國(guó)內(nèi)外口腔膜劑申報(bào)上市進(jìn)展及其藥學(xué)評(píng)價(jià)探討[J].藥品評(píng)價(jià)����,2017,14(18):23-27.
[11]Silva BMA,Vicente S,Cunha S,et al.RetrospectiveQuality by Design (rQbD)Applied to the Optimizationof Orodispersible Films[J].International Journal ofPharmaceutics,2017,528(1-2):655.
[12]Gupta MS,Kumar TP,Gowda DV,et al.OrodispersibleFilms:Conception to Quality by Design[J].Advanced DrugDelivery Reviews,2021,178:113983.
[13]國(guó)家藥典委員會(huì).征求《中國(guó)藥典》丸劑和膜劑通則修訂草案意見(jiàn)[EB/OL].(2023-03-14)[2025-02-24].https://www.chp.org.cn/#/business/standard.
[14]王璐�����,胡延臣,王亞敏.口溶膜類新藥的開(kāi)發(fā)與評(píng)價(jià)探討[J].藥學(xué)研究�,2024,43(3):302-307.
[15]Mannhar SK,Gowrav MP,Gowda DV.QbD-BasedDevelopment of Orodispersible Films of AntipasychoticDrugs[J].In J App Pharm,2022,14(5):41-52.
[16]Thabet Y,Breitkreutz J.Orodispersible Films:ProductTransfer from Lab-Scale to Coninuous Manufacturing[J].Int JPharm,2018,535(1-2):285-292.
[17]Visser JC,Dohmen WM,Hinrichs WL,et al.Qualityby Design Approach for Optimizing the Formulationand Physical Properties of Extemporaneously PreparedOrodispersible Films[J].International Journal ofPharmaceutics,2015,485(1-2):70-76.
[18]Swati S,Rajat P,Sunta P.A Review on Mouth DissolvingFilm-A Novel Appmach[J].IJPSM,2024,9(2):36-51.
[19]Salawi A.An Insight Into Preparatory Methods andCharacterization of Orodispersible Film-A Review[J].Pharmaceuticals(Basel),2022,15(7):844-861.
[20]Kalyan S,Bansal M.Recent Trends in the Development ofOral Dissolving Film[J].Int J Pharm Tech Res,2012,4(2):725-733.
[21]Lou H,Liu M,Qu W,et al.Evaluation of Chlorphenira-minemaleate Microparticles in Orally Disintegrating Filmand Orally Disintegrating Tablet for Pediatrics[J].DrugDev lnd Pharm,2014,40(7):910-918.
[22]司曉菲,姜典卓.精神障礙類治療藥物口腔膜劑藥學(xué)研究探索[J].臨床藥物治療雜志���,2023,21(5):1-6.
[23]Lakshita R,Narendra G,Vikas J.A Short Review onAdvancement in Fast Dissolving Oral Thin Films[J].CurenRes in Pharm Sci,2021,11(4):112-117.
[24]江卓芩��,江昌照����,葉金翠�,等.口腔膜劑的研究進(jìn)展及市售藥物概述[J].中國(guó)新藥雜志��,2020,29(6):634-641.
[25]王鵬����,張勇�,王棟海,等.口溶膜制劑及其質(zhì)量研究與控制概述[J].中國(guó)醫(yī)藥工業(yè)雜志�,2024,55(3):319-325.
[26]Keshavarao KP,Mudit D,Anis S,et al.Formulationand Evaluation of Mouth Dissolving Film ContainingRofecoxib[J].International Research Journal of Pharmacy,2011,2(3):273-278.
[27]Lee Y,Kim K,Kim M,et al.Orally Disintegrating FilmsFocusing on Formulation,Manufacturing Process,andCharacterization[J].J of Pharm Inves,2017,47(3):1-19.
[28]Musazzi UM,Khalid GM,Selmin F,et al.Trends in theProduction Methods of Orodispersible Films[J].Elsevier,2020,576:118963.
[29]Turkovi E,VasiljeviI,DrakoviM,et al.Omdispersible Films一Pharmaceutical Development for Improved Performance:A Review[J].Journal of Drug Delivery Science andTechnology,2022,75:1-16.
[30]Steiner D,Finke JH,Kwade A.Model-Based Description ofDisintegration Time and Dissolution Rate of Nanoparticle-Loaded Rrodispersible Films[J]European Journal ofPharmaceutical Sciences:Official Joumal of the EuropeanFederation for PharmaceuticalSciences,2019,132:18-26.
[31]Zhang L,Aloia M,Pielecha B,et al.Impact Of Super-Disintegrants and Film Thickness on Disintegration Timeof Strip Films Loaded with Poorly Water-Soluble DrugMicroparticles[J].J of Pharma Sci,2018,107(8):2107-2118.
[32]Visser JC,Dohmen WMC,Hinrichs WLJ,et al.Qualityby Design Approach for Optimizing the Formulationand Physical Properties of Extemporaneously PreparedOrodispersible Films [J].Int J Pham,2015,485(1-2):70-76.
[33]Liew KB,Odieniyi MA,Peh KK.Application of Freeze-Drying Technology in Manufacturing Orally DisintegratingFilms [J].Pharma Develop And Tech,2016,21(3):346-353.
[34]Tian Y,Visser JC,Klever JS,et al.Orodispersible FilmsBased on Blends of Trehalose and Pullulan for ProteinDelivery[J]Eur JPharm Biopharm,2018,133:104-111.
[35]Visser JC,Woerdenbag HJ,Crediet S,et al.OrodispersibleFilms in Individualized Pharmacotherapy:The Developmentof a Formulation for Pharmacy Preparations[J].Int JPharm,2015,478:155-163.
[36]Abdelahakim HE,Williams GR,Craig DQM,et al.Human Mouthfeel Panel Investigating the Acceptability ofElectrospun and Solvent Cast Omdispersible Films[J].Int Jof Pharma,2020,585:119532.
[37]SongQ,Guo X,Sun Y,et al.Anti-Solvent PrecipitationMethod Coupled Electrospinning Pocess to Produce PoorlyWater-Soluble Drug-Loaded Orodispersible Films[J].AapsPharmacistech,2019,20(7):273.
[38]Birer M,Acart ürk F.Electrospun Orally DisintegratingFilm Formulation of Telmisartan[J].Pharm Dev Technol,2021,26(6):661-672.
[39]Edinger M,Bar-Shalom D,Sandler N,et al.QR EncodedSmart Oral Dosage Forms by Inkjet Printing[J].Int J ofPharma,2018,536(1):138-145.
[40]Gemini G,Peltonen L.3D Printing of Drug Nanocrystalsfor Film Formulations[J].Molecules,2021,26(13):3941.
[41]PanraksaP,UdomsomS,Rachtanapun P,et al.HydroxypropylMethylcellulose E15:A Hydrophilic Polymer for Fabricationof Orodispersible Film Using Syringe Extrusion 3DPrinter[J].Polymers(Basel),2020,12(11):2666.
[42]Yan TT,Lv ZF,Tian P,et al.Semi-Solid Extrusion 3DPrinting Odfs:An Individual Drug Delivery System forSmall Scale Pharmacy[J].Drug Dev Ind Pham,2020,46(4):531-538.
[43]Singh BN.Product Development,Manufacturing andPackaging of Solid Dosage Forms Under QbD and PatParadigm:Doe Case Studies for Industrial Applications[J].AAPS PharmSciTech,2019,20(8):313.
[44]Mazumder S,Pavurala N,Manda P,et al.Qualiy by DesignApproach for Studying the Impact of Formulation andProcess Variables on Product Quality of Oral DisintegratingFilms[J].Int J Pharm,2017,527(1-2):151-160.
[45]Dalal R,Shah J,Gorain B,et al.Development andOptimization of Asenapine Sublingual Film Using QbDApproach[J].AAPS PharmSciTech,2021,22(7):244.
[46]Dahmash EZ,Iyire A,Alyami HS.Development of OrallyDissolving Films for Pediatric-Centric Administration ofAnti-Epileptic Drug Topiramate-A Design of Expenments(DoE)Study [J].Saudi Pham J,2021,29(7):635-647.
[47]Munir N,Nugent M,Whitaker D,et al.Machine Learningfor Prmcess Monitoring and Contmol of Hot-Melt Extrusion:Current State of the Art and Future Directions [J].Pharmaceutics,2021,13(9):1432.
[48]Hammes F,Hille T,Kissel T.Reflectance InfraredSpectroscopy for In-Line Monioring of Nicotine during aCoating Process for an Oral Thin Film [J].Pham BiomedAnal,2014,89:176-182.
[49]中華人民共和國(guó)藥典:四部[S].2020:24.
[50]European Pharmacopoeia 11.8[S].2025.
[51]The United States Pharmacopoeia[S].2025.
[52]趙博源�����,李娜,王萌���,等.預(yù)防和治療惡心嘔吐口腔可溶性膜劑研究進(jìn)展[J].中國(guó)新藥雜志���,2024,33(14):1449-1457.
[53]陳芳,王健���,李銘巖.中國(guó)藥典膜劑通則修訂的考量[J].中國(guó)醫(yī)藥工業(yè)雜志�����,2024,55(3):310-317.