1.注冊(cè)方案
產(chǎn)品描述
螺柱狀或其他形狀固體�����。一般采用金屬材質(zhì)制成��,包括鈦、鈦合金���、鉭等�����,也可為陶瓷等其他材質(zhì)�����。通過外科手術(shù)的方式將其植入人體缺牙部位的上下頜骨內(nèi)��。
臨床用途
植入到牙槽骨內(nèi),用于為義齒等修復(fù)體提供固定或支撐,以恢復(fù)患者的咀嚼功能��。
注冊(cè)類別和分類編碼
Ⅲ類,17口腔器械-08口腔植入及組織重建材料-01牙種植體
注冊(cè)單元?jiǎng)澐?/span>
產(chǎn)品注冊(cè)單元的劃分需符合《醫(yī)療器械注冊(cè)單元?jiǎng)澐种笇?dǎo)原則》的要求�����。不同材質(zhì)的牙科種植體宜劃分為不同的注冊(cè)單元,如陶瓷���、金屬種植體需考慮劃分為不同注冊(cè)單元���;不同結(jié)構(gòu)設(shè)計(jì)或不同工作原理的牙科種植體需考慮劃分為不同的注冊(cè)單元,如骨水平��、軟組織水平牙科種植體宜劃分為不同注冊(cè)單元,穿顴種植體�����、常規(guī)種植體宜劃分為不同注冊(cè)單元;不同表面處理方式的牙科種植體應(yīng)劃分為不同的注冊(cè)單元���,如陽極氧化��、噴砂酸蝕。必須聯(lián)合使用不可分割才能發(fā)揮預(yù)期用途的產(chǎn)品可以作為同一牙科種植體系統(tǒng),如牙科種植體��、覆蓋螺絲、愈合基臺(tái)���、基臺(tái)等���。
臨床推薦路徑
同品種
重點(diǎn)考慮:
1. 適用部位:對(duì)比產(chǎn)品使用的具體部位���,是否用于特定牙位或特殊骨質(zhì)條件的種植��。
2. 臨床應(yīng)用方式:對(duì)比產(chǎn)品的種植類型(如即刻種植���、延期種植;單牙�����、多牙或全口種植等)、修復(fù)類型等���。
3. 使用方法:對(duì)比產(chǎn)品的使用操作步驟�����。
4. 配用產(chǎn)品:單獨(dú)申報(bào)種植體或基臺(tái)時(shí)���,建議明確產(chǎn)品配用的基臺(tái)或種植體、附件���、種植工具等信息�����。
5. 禁忌證�����、警告及預(yù)防措施��。
非臨床資料(檢測向)
產(chǎn)品性能指標(biāo)
1��、各部位幾何尺寸及允差�����,需包括直徑���、長度��、圓錐角���。
2、牙種植體與種植體基臺(tái)的配合性能���,包括牙種植體與種植體基臺(tái)內(nèi)連接配合及偏差���、牙種植體與種植體基臺(tái)配合間隙��、螺紋偏差���。
3��、表面性能��,包括外觀�����、表面缺陷�����、軟組織水平牙種植體頸部粗糙度���。
4�����、清潔���。
5、機(jī)械性能���,包括抗扭性能��、緊固性能�����。
6�����、無菌�����。
7���、細(xì)菌內(nèi)毒素��。
8��、涂層性能(如適用)��,涂層抗拉粘結(jié)強(qiáng)度��、微觀形貌(平均厚度���、表面粗糙度、涂層形貌��、孔隙率)��。
9.1���、配合性能 提交種植體(系統(tǒng))的配合性能驗(yàn)證資料
9.2���、力學(xué)性能 抗扭性能、緊固扭矩�����、旋動(dòng)扭矩��、自攻性能(適用于自攻型牙種植體)�����、軸向拔出力(適用于即刻種植)
9.3��、疲勞極限
9.4��、耐腐蝕性能
9.5�����、表面性能 表面形貌��、微觀結(jié)構(gòu)、表面化學(xué)分析�����、涂層均勻性���、涂層剝脫/磨損���、溶解性、種植體頸部等��,對(duì)于通過表面處理/表面涂層增加牙科種植體表面粗糙度的情形��,還需考慮牙科種植體根部粗糙度��、孔洞結(jié)構(gòu)��、孔隙率等
9.6�����、穩(wěn)定性能
化學(xué)/材料表征
YY 0315《鈦及鈦合金牙種植體》
YY/T 0520《鈦及鈦合金材質(zhì)牙種植體附件》
YY 0304《等離子噴涂羥基磷灰石涂層 鈦基牙種植體》
YY/T 0521《牙科學(xué) 種植體 骨內(nèi)牙種植體動(dòng)態(tài)疲勞試驗(yàn)》
GBT 16886.18《醫(yī)療器械生物學(xué)評(píng)價(jià) 第18部分:風(fēng)險(xiǎn)管理過程中醫(yī)療器械材料的化學(xué)表征》
GB16886.17《醫(yī)療器械生物學(xué)評(píng)價(jià)第17部分:可瀝濾物允許限量的建立 》
生物學(xué)評(píng)價(jià)
生物學(xué)評(píng)價(jià) GB/T 16886.1《醫(yī)療器械生物學(xué)評(píng)價(jià) 第1部分:風(fēng)險(xiǎn)管理過程中的評(píng)價(jià)與試驗(yàn)》
細(xì)胞毒 GB/T16886.5《醫(yī)療器械生物學(xué)評(píng)價(jià) 第5部分:體外細(xì)胞毒性試驗(yàn)》
致敏反應(yīng) GB/T16886.10《醫(yī)療器械生物學(xué)評(píng)價(jià) 第10部分:刺激與皮膚致敏試驗(yàn)》
急性全身毒性���、熱原��、亞急性全身毒性���、亞慢性全身毒性、慢性全身毒性(推薦硬切病理) GB/T16886.11《醫(yī)療器械生物學(xué)評(píng)價(jià) 第11部分:全身毒性試驗(yàn)》
口腔刺激 GB/T16886.23《醫(yī)療器械生物學(xué)評(píng)價(jià) 第23部分:刺激試驗(yàn)》
植入反應(yīng) GB/T 16886.6《醫(yī)療器械生物學(xué)評(píng)價(jià)第6部分:植入后局部反應(yīng)試驗(yàn)》
遺傳毒性���、致癌性 GB/T 16886.3《醫(yī)療器械生物學(xué)評(píng)價(jià) 第3部分:遺傳毒性��、致癌性和生殖毒性試驗(yàn)》
清洗�����、消毒���、滅菌
清洗:明確生產(chǎn)工藝中涉及的各種加工助劑(如切削液、酸蝕劑等)的質(zhì)量控制標(biāo)準(zhǔn)���。明確產(chǎn)品的清洗過程�����,提供經(jīng)清洗過程后加工助劑殘留控制的驗(yàn)證資料��。對(duì)生產(chǎn)加工過程使用的所有加工助劑等添加劑均需說明使用劑量��、對(duì)殘留量的控制措施和接受標(biāo)準(zhǔn)以及安全性評(píng)價(jià)報(bào)告���。
ISO 19227《Implants for surgery. Cleanliness of orthopedic implants. General requirements》
生產(chǎn)滅菌:
明確滅菌工藝(方法和參數(shù))和無菌保證水平(SAL)���。產(chǎn)品的無菌保證水平(SAL)需達(dá)到10-6。明確輻射劑量及相關(guān)的驗(yàn)證報(bào)告���,具體的劑量確定依據(jù)可參照GB 18280系列標(biāo)準(zhǔn)
終端滅菌:
滅菌驗(yàn)證
穩(wěn)定性研究
包裝老化 YY/T 0681.1《無菌醫(yī)療器械包裝試驗(yàn)方法 第 1 部分:加速老化試驗(yàn)指南》
目視檢查 YY/T 0681.11《無菌醫(yī)療器械包裝試驗(yàn)方法 第 11 部分:目力檢測醫(yī)用包裝密封完整性》
微生物屏障 YY/T 0681.14《無菌醫(yī)療器械包裝試驗(yàn)方法 第 14 部分:透氣包裝材料濕性和干性微生物屏障試驗(yàn)》
真空泄漏 ASTM D 3078《Standard Test Method for Determination of Leaks in Flexible Packaging by Bubble Emission》
密封強(qiáng)度 YY/T 0681.2《無菌醫(yī)療器械包裝試驗(yàn)方法 第 2 部分:軟性屏障材料的密封強(qiáng)度》
染料滲透 YY/T 0681.4《無菌醫(yī)療器械包裝試驗(yàn)方法 第 4 部分:染色液穿透法測定透氣包裝的密封泄漏》
運(yùn)輸試驗(yàn) ASTM D4169《Standard Practice for Performance Testing of Shipping Containers and Systems》
MRI磁共振兼容性
YY/T 0987.1-2016《外科植入物 磁共振兼容性 第1部分 安全標(biāo)記》
YY/T 0987.2-2016《外科植入物 磁共振兼容性 第2部分:磁致位移力和試驗(yàn)方法》
YY/T 0987.3-2016《外科植入物 磁共振兼容性 第3部分:圖形偽影評(píng)價(jià)方法》
YY/T 0987.4-2016《外科植入物 磁共振兼容性 第4部分:射頻致熱試驗(yàn)方法》
YY/T 0987.5-2016《外科植入物 磁共振兼容性 第5部分:磁致扭矩試驗(yàn)方法》
動(dòng)物研究
推薦動(dòng)物選擇:犬(缺牙模型)���、豬(缺牙模型)
觀察指標(biāo):生化指標(biāo)���、大體數(shù)據(jù)�����、CT、組織病理學(xué)數(shù)據(jù)��、初期穩(wěn)定性(如植入扭矩��、種植體穩(wěn)定系數(shù))�����、骨結(jié)合性能(如骨結(jié)合率)��、骨吸收水平(水平相��、垂直相)等�����。
觀察周期:不低于3個(gè)月,對(duì)于3個(gè)月數(shù)據(jù)無法支持產(chǎn)品有良好骨結(jié)合性能及趨勢(shì)的��,建議延長觀察周期至6個(gè)月��。
《醫(yī)療器械動(dòng)物試驗(yàn)研究技術(shù)審查指導(dǎo)原則第二部分:實(shí)驗(yàn)設(shè)計(jì)���、實(shí)施質(zhì)量保證》
YY/T 0522《牙科學(xué) 牙種植體系統(tǒng)臨床前評(píng)價(jià) 動(dòng)物試驗(yàn)方法》
2.注冊(cè)報(bào)告
1��、總體趨勢(shì)
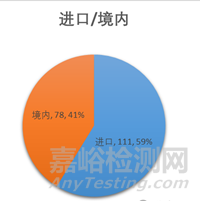
截至2025年12月31日���,牙種植體有效產(chǎn)品注冊(cè)總數(shù)為189件,其中國產(chǎn)產(chǎn)品有78件��,占比41%���;進(jìn)口產(chǎn)品111件�����,占比59%�����。
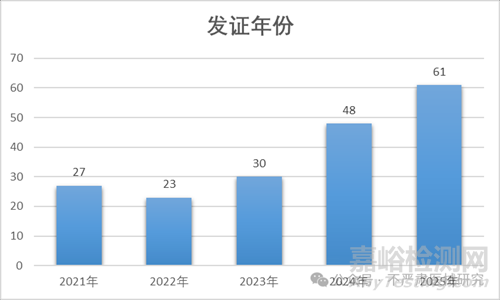
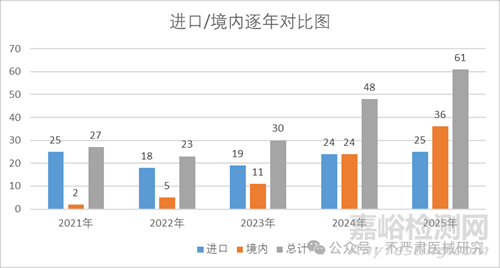
從近幾年批證數(shù)看�����,注冊(cè)證總量和國產(chǎn)化率都逐年上升�����,2025年國產(chǎn)牙種植體批件數(shù)已經(jīng)超過進(jìn)口產(chǎn)品�����。
2�����、國產(chǎn)產(chǎn)品注冊(cè)分布
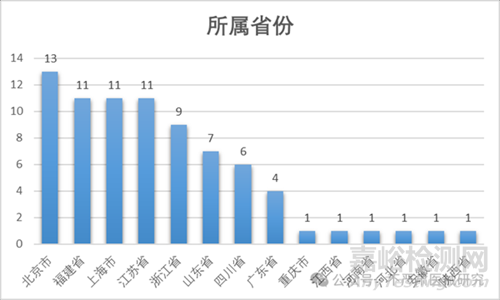
截至2025年12月31日��,牙種植體國產(chǎn)產(chǎn)品注冊(cè)排名第一的省市是北京市���,產(chǎn)品注冊(cè)數(shù)為13件,其次是福建省��、上海市以及江蘇省各11件���。
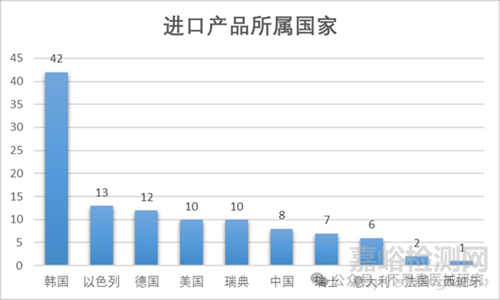
3��、進(jìn)口產(chǎn)品注冊(cè)分布
截至2025年12月31日�����,牙種植體進(jìn)口產(chǎn)品有111件�����,其中以色列的產(chǎn)品數(shù)量遙遙領(lǐng)先�����,為42件�����,其次為以色列��、德國美國和瑞典(中國臺(tái)灣走的進(jìn)口流程)���。
4�����、獲證企業(yè)分布
按企業(yè)獲證總量排名��,前六分別是諾貝爾生物公司 Nobel Biocare AB的10件�����,百齒泰(廈門)醫(yī)療科技有限公司的9件�����,奧齒泰種植體有限責(zé)任公司 Osstem Implant Co.,Ltd.的6件��,北京市春立正達(dá)醫(yī)療器械股份有限公司的6件�����,士卓曼(上海)醫(yī)療器械有限公司的5件以及登士柏種植體制造公司 DENTSPLY Implants Manufacturing GmbH的5件���,其余廠家見下表。