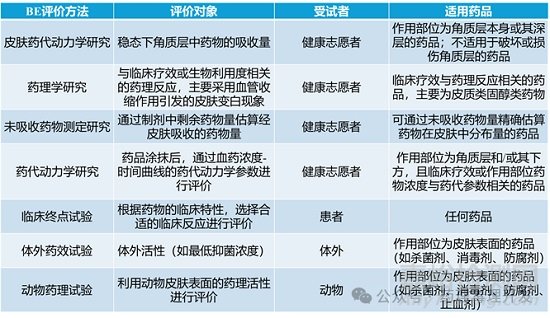
仿制藥指與原研藥具有相同活性藥物成分����、劑型����、給藥途徑和適應(yīng)癥的藥品�。仿制藥上市前通常需要開展生物等效性(BE)研究,BE指的是用于推斷仿制藥的有效性和安全性���,并與原研藥進(jìn)行比較的關(guān)鍵研究����。研究BE又涉及到另外一個概念——生物利用度(BA)����,BA指活性藥物成分或活性代謝產(chǎn)物從給藥劑量中吸收進(jìn)入體循環(huán)的速率和程度,常用于口服固體制劑的BE評價�。對于皮膚外用藥物,還涉及一個額外概念——皮膚藥代動力學(xué)(DPK)研究����,又稱膠帶剝離法(TS),通過測定藥物在角質(zhì)層的濃度來評價BE���,適用于藥物主要作用于角質(zhì)層或經(jīng)角質(zhì)層擴散的外用制劑����。
口服制劑的BA比較法無法用于多數(shù)外用皮膚科制劑的BE評價,因其作用部位位于體循環(huán)上游����。傳統(tǒng)評價方法存在明顯局限,比如血管收縮試驗僅適用于皮質(zhì)類固醇����,無法評估其他活性成分。而傳統(tǒng)臨床終點試驗�,雖適用于所有外用制劑,但需大量患者參與����,成本高����、耗時長,且靈敏度和可重復(fù)性較低�。
為此,各國監(jiān)管機構(gòu)均在探索新的評價方法�,核心思路是結(jié)合定性(Q1)、定量(Q2)����、理化與結(jié)構(gòu)特征(Q3)相似性評價�,以及體外釋放試驗(IVRT)和/或體外滲透試驗(IVPT)����。Q3屬性包括外觀、質(zhì)地���、粒徑與球徑�、剪切速率/應(yīng)力���、粘度等���。
各國監(jiān)管機構(gòu)也發(fā)布了相關(guān)指南。
美國FDA:發(fā)布基于產(chǎn)品特性的專項指導(dǎo)原則(Product-specific guidances for generic drug development, 2025;Physicochemical and structural (Q3) characterization of topical drug products submitted in ANDAs, 022)�,推薦包括Q1/Q2/Q3評價、IVRT����、IVPT在內(nèi)的體外評價方案。
歐洲EMA:出臺指南認(rèn)可體外BE研究(Guideline on quality and equivalence of locally applied, locally acting cutaneous products, 2024;Regulatory requirements for the development of second-entry semisolid topical products in the European union, 2023)�,根據(jù)制劑復(fù)雜性制定要求:簡單制劑(如單相液體、凝膠����、軟膏)若Q1/Q2/Q3相似且IVRT等效�,可獲得生物豁免���;復(fù)雜制劑(如乳劑���、含滲透促進(jìn)劑的制劑)需額外進(jìn)行動力學(xué)研究(IVPT/TS/藥代動力學(xué)BE)。
日本:2003年發(fā)布《外用仿制藥生物等效性研究指南》���,提出包括DPK在內(nèi)的7種BE評價方法�,需根據(jù)藥物藥理作用和作用部位選擇���。日本認(rèn)為���,若藥物在角質(zhì)層濃度相似即可保證治療等效,故允許采用DPK進(jìn)行BE評價���,2003年后眾多仿制藥借此獲批。日本經(jīng)皮吸收藥物生物等效性研究方法匯總?cè)缦拢?/span>
日本藥品和醫(yī)療器械局(PMDA)對日本2000-2023年獲批的外用皮膚科仿制藥的BE評價方法進(jìn)行了回顧性分析�。結(jié)果發(fā)現(xiàn),2000-2023年日本共獲批173種外用皮膚科仿制藥����。2003年指南發(fā)布前����,除皮質(zhì)類固醇和防腐劑外�,BE評價主要采用動物藥理試驗;2004年起���,DPK研究占比逐步上升�,2016-2023年僅采用DPK研究和體外藥效試驗兩種方法����,且體外藥效試驗僅用于防腐劑的最低抑菌濃度(MIC)測定,未開展任何臨床終點臨床試驗�。從藥物種類角度:抗菌藥和抗真菌藥采用DPK研究或動物藥理試驗;多數(shù)非甾體抗炎藥采用DPK研究�;所有皮質(zhì)類固醇采用血管收縮試驗;所有抗病毒藥采用動物藥理試驗�。從不同劑型評價方法:幾乎所有巴布劑及多數(shù)凝膠、貼劑采用DPK研究����。
日美歐監(jiān)管差異對比
皮質(zhì)類固醇與防腐劑評價:日本對皮質(zhì)類固醇采用血管收縮試驗,與多國一致���,且FDA指南也將其列為皮質(zhì)類固醇的評價選項����;日本對防腐劑采用MIC體外藥效試驗,而其他監(jiān)管機構(gòu)較少采用����,F(xiàn)DA對氯己定的指南推薦基于Q1/Q2/Q3評價的生物豁免。
DPK研究的接受度:2015年時僅有少數(shù)監(jiān)管機構(gòu)認(rèn)可DPK研究����,EMA近年已接受TS(即DPK)研究,用于符合條件的復(fù)雜制劑BE評價����;FDA未接受DPK方法,但允許在Q1/Q2/Q3相似的前提下采用IVRT和/或IVPT進(jìn)行體外BE評價���。比如2025年5月新披露的Terbinafine hydrochloride乳劑仿制藥���、Terbinafine凝膠仿制藥生物等效性研究指南,F(xiàn)DA給出了2種選擇���,一種是基于Q1/Q2/Q3相似的前提下采用IVRT證明等效,一種則基于臨床終點等效。日本在2022年9月前�,即使無Q1/Q2/Q3相似性及體外試驗證據(jù),也允許對所有外用制劑采用DPK評價����。
日本2022年原則更新:2022年10月日本發(fā)布《外用半固體仿制藥生物等效性研究基本原則》,首次納入Q1/Q2/Q3相似性及IVRT/IVPT等效性要求���,DPK研究僅在以下兩種情況可使用:1)無需嚴(yán)格評價治療等效性的藥物����,且受試與參比制劑劑型相同�、性質(zhì)一致;2)需嚴(yán)格評價治療等效性的藥物(如類固醇����、鈣調(diào)神經(jīng)磷酸酶抑制劑、JAK抑制劑)���,且滿足Q1/Q2/Q3相似性及IVRT/IVPT等效性。
那么如何判斷Q1/Q2/Q3相似性及IVRT/IVPT等效性����,日本尚未明確�,但FDA和EMA對于Q1/Q2/Q3相似性及IVRT/IVPT等效性的具體標(biāo)準(zhǔn)���,已有明確規(guī)定: