醫(yī)療器械定期風(fēng)險評價報(bào)告是醫(yī)療器械不良事件監(jiān)測的重要內(nèi)容�����,也是落實(shí)注冊人全生命周期管理的重要舉措�。通過系統(tǒng)整合不良事件報(bào)告、用戶反饋等數(shù)據(jù)���,企業(yè)可精準(zhǔn)識別潛在風(fēng)險信號�,推動產(chǎn)品持續(xù)優(yōu)化���。本文跟大家分享一下定期風(fēng)險評價報(bào)告撰寫的一些要點(diǎn)及模版。
法規(guī)背景
2018年8月31日�����,國家藥品監(jiān)督管理局發(fā)布了《醫(yī)療器械不良事件監(jiān)測和再評價管理辦法》�����,該辦法于2019年1月1日起正式實(shí)施���。其中明確提出注冊人應(yīng)對上市醫(yī)療器械的安全性進(jìn)行持續(xù)研究�����,對產(chǎn)品的不良事件報(bào)告�����、監(jiān)測資料和國內(nèi)外風(fēng)險信息進(jìn)行匯總�����、分析���,評價產(chǎn)品的風(fēng)險與受益情況�,記錄采取的風(fēng)險控制措施�,撰寫醫(yī)療器械定期風(fēng)險評價報(bào)告���。
2020年6月30日國家藥品監(jiān)督管理局發(fā)布《醫(yī)療器械定期風(fēng)險評價報(bào)告撰寫規(guī)范》���,進(jìn)一步落實(shí)了上述辦法的有關(guān)要求�。此規(guī)范作為指導(dǎo)醫(yī)療器械注冊人、備案人起草和撰寫定期風(fēng)險評價報(bào)告的技術(shù)文件�,同時也是醫(yī)療器械不良事件監(jiān)測機(jī)構(gòu)評價定期風(fēng)險評價報(bào)告的重要依據(jù)���。
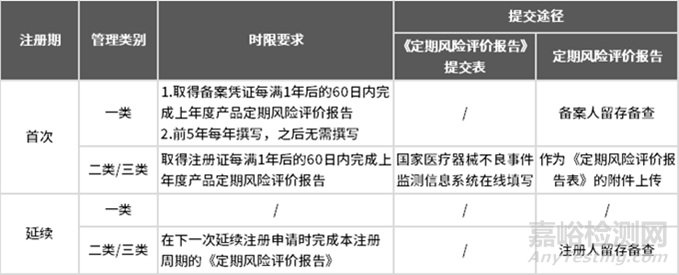
撰寫周期要求
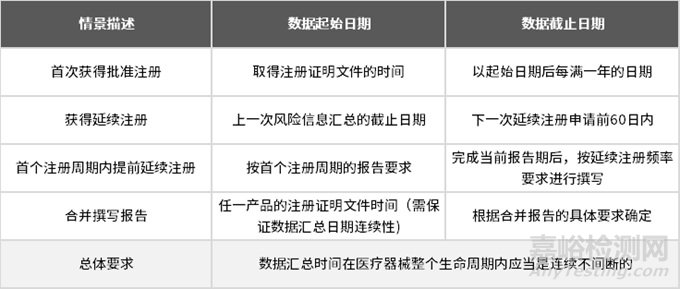
數(shù)據(jù)匯總時間要求
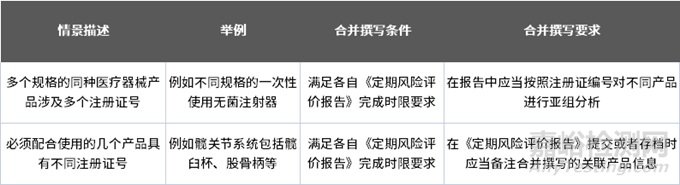
合并撰寫報(bào)告要求
原則上�����,每個具有單獨(dú)注冊證編號的產(chǎn)品應(yīng)當(dāng)單獨(dú)撰寫《定期風(fēng)險評價報(bào)告》���,但在以下情況下可以合并:
報(bào)告內(nèi)容與格式
《定期風(fēng)險評價報(bào)告》包含封面�、目錄和正文三部分內(nèi)容:
封面包括產(chǎn)品名稱�����、注冊證/備案證批準(zhǔn)日期�、報(bào)告類別(首次注冊/延續(xù)注冊)、報(bào)告次數(shù)���、報(bào)告期���、本期國內(nèi)銷量、本期境外銷量�、本期不良事件報(bào)告數(shù)量���,企業(yè)名稱�����、聯(lián)系地址、郵編�、傳真�,負(fù)責(zé)產(chǎn)品安全的的部門�、負(fù)責(zé)人及聯(lián)系方式(包括手機(jī)、固定電話���、電子郵箱等)���,報(bào)告提交時間,以及隱私保護(hù)等相關(guān)信息(參見附表1)�����。
目錄應(yīng)當(dāng)盡可能詳細(xì)�,一般包含三級目錄�����。
正文的主要內(nèi)容包括:產(chǎn)品基本信息�、國內(nèi)外上市情況、既往風(fēng)險控制措施�����、不良事件報(bào)告信息���、其他風(fēng)險信息�����、產(chǎn)品風(fēng)險分析�、本期結(jié)論以及附件。
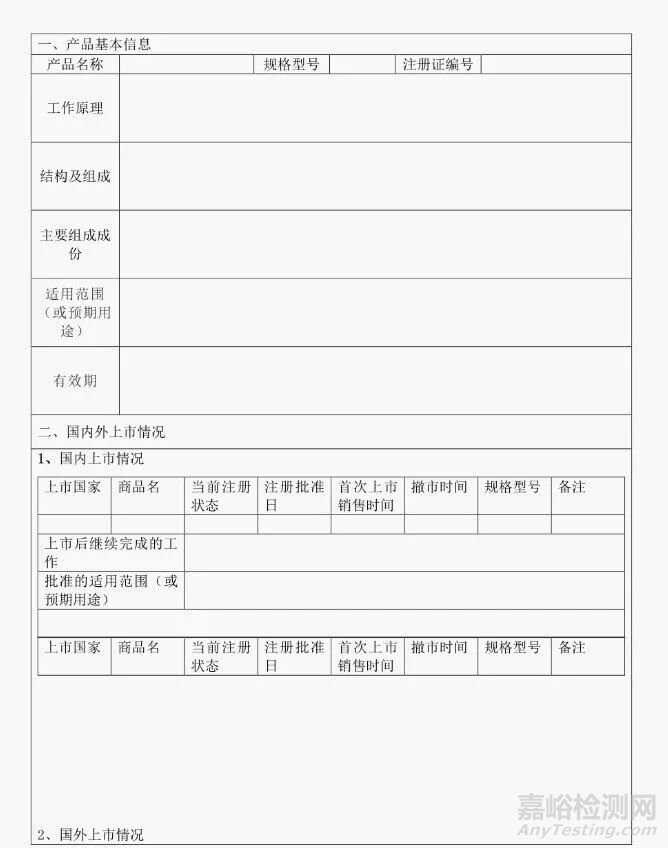
1.產(chǎn)品基本信息:主要包括:醫(yī)療器械名稱�、型號和/或者規(guī)格、注冊證編號���、結(jié)構(gòu)及組成�、主要組成成分�、適用范圍(預(yù)期用途)、有效期等�。
2.國內(nèi)外上市情況:主要介紹醫(yī)療器械在國內(nèi)外上市信息,包括獲得上市許可的主要國家和地區(qū)�、批準(zhǔn)注冊/備案時間、注冊/備案狀態(tài)等�����;產(chǎn)品批準(zhǔn)上市時提出的有關(guān)要求�,特別是與風(fēng)險控制有關(guān)的要求;批準(zhǔn)的適用范圍(預(yù)期用途)以及特殊人群情況,如該產(chǎn)品在我國的適用范圍(預(yù)期用途)與其他國家或者地區(qū)存在差異�,應(yīng)當(dāng)給予說明。
3.既往風(fēng)險控制措施:匯總報(bào)告期內(nèi)監(jiān)管部門或者注冊人因醫(yī)療器械風(fēng)險問題而采取的控制措施和原因�����,并附加相關(guān)文件���。
4.不良事件報(bào)告信息:匯總注冊人在報(bào)告期內(nèi)發(fā)現(xiàn)或者獲知的所有國內(nèi)外個例不良事件和群體不良事件�����。
其中個例不良事件報(bào)告�����,應(yīng)以個例不良事件報(bào)告列表和匯總表進(jìn)行匯總分析�����,如報(bào)告期內(nèi)未收集到不良事件報(bào)告,用文字描述即可���。
群體不良事件則是匯總報(bào)告期內(nèi)所有群體不良事件的報(bào)告���、調(diào)查和處置情況���。
5.其他風(fēng)險信息:介紹與產(chǎn)品風(fēng)險相關(guān)的文獻(xiàn)資料研究、產(chǎn)品風(fēng)險評價�、重點(diǎn)監(jiān)測、再評價等情況���。如果在數(shù)據(jù)截止日期后、報(bào)告提交前,發(fā)生因產(chǎn)品風(fēng)險原因而采取措施的情況���,也應(yīng)在此部分介紹�。
6.產(chǎn)品風(fēng)險分析:從設(shè)計(jì)開發(fā)、生產(chǎn)管理���、流通與儲存�����、操作使用、維修保養(yǎng)���、售后服務(wù)等多方面分析綜合產(chǎn)品風(fēng)險情況�����,重點(diǎn)分析不良事件發(fā)生的主要原因���,不良事件的特點(diǎn)是否發(fā)生改變�、不良事件的報(bào)告頻率是否增加���、不良事件的特點(diǎn)和頻率變化對產(chǎn)品總體安全性的影響�。明確具體產(chǎn)品所有已知風(fēng)險,結(jié)合產(chǎn)品上市后的投訴�、風(fēng)險信息和不良事件報(bào)告�,按規(guī)范要求逐項(xiàng)開展風(fēng)險分析�����。
7.本期結(jié)論:指出本期報(bào)告與既往報(bào)告的風(fēng)險分析結(jié)果差異及這些風(fēng)險差異的可接受程度���,總結(jié)產(chǎn)品當(dāng)前的風(fēng)險與受益情況,得出產(chǎn)品安全性的總體結(jié)論���。
8.附件:包括醫(yī)療器械注冊批準(zhǔn)證明文件�����、產(chǎn)品使用說明書(操作手冊)、參考文獻(xiàn)以及其他需要提交的資料���。
附定期風(fēng)險評價報(bào)告模板