ASTM協(xié)會發(fā)布了關(guān)于驗證的新指南E2500−25��。指南整體思路延續(xù)了 ISPE C&Q第二版指南的關(guān)鍵方面 CA(Critical Aspect) 和關(guān)鍵設(shè)計要素CDE(critical design element)的思路����。
該指南適用于制藥和生物制藥生產(chǎn)系統(tǒng)的所有要素����,包括:GMP公用設(shè)施�����、生產(chǎn)設(shè)備���、工藝監(jiān)測和控制系統(tǒng)的規(guī)范�����、設(shè)計和驗證�����。
要點
1. 在ASTM E2500-25標(biāo)準(zhǔn)中�����,系統(tǒng)負(fù)責(zé)人(System Owner) 被定位為制藥和生物制藥生產(chǎn)系統(tǒng)全生命周期的核心責(zé)任主體,其職責(zé)相較于傳統(tǒng)驗證指南更加聚焦于技術(shù)決策和系統(tǒng)整體效能���,這主要體現(xiàn)在:
① 系統(tǒng)交付總責(zé):對系統(tǒng)從概念到退役的整個生命周期負(fù)責(zé)�����,確保系統(tǒng)交付的連續(xù)性和一致性���。
② 規(guī)范與設(shè)計參與:參與制定系統(tǒng)規(guī)格和需求��,并參與風(fēng)險評估活動,確保系統(tǒng)設(shè)計符合預(yù)定目的�����。
③ 驗證過程主導(dǎo):在主題專家(SMEs)的協(xié)助下�����,主導(dǎo)或密切參與系統(tǒng)的驗證策略制定�、測試執(zhí)行和結(jié)果審查����,并對系統(tǒng)的持續(xù)適用性負(fù)責(zé)。
④ 供應(yīng)商文件利用:負(fù)責(zé)評估供應(yīng)商����,并決策是否采納供應(yīng)商的測試文件(如FAT/SAT)作為驗證證據(jù)���,以提升效率��,避免重復(fù)工作����。
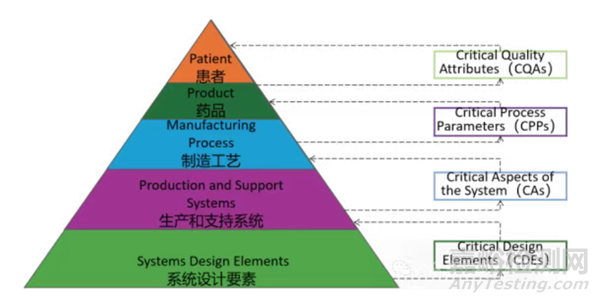
2. 展示了CDEs, CAs, CPPs 及CQAs與產(chǎn)品質(zhì)量�����、患者安全之間的對應(yīng)關(guān)系�����,見下圖���。
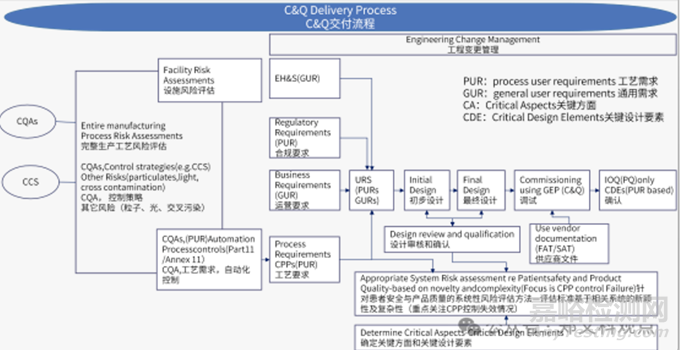
3. 構(gòu)建了基于CQA、CPP�����、CCS的調(diào)試與確認(rèn)交付流程��,見下圖���。