對(duì)藥品雜質(zhì)譜的控制是保證藥品安全有效的重要措施,也是提升國(guó)產(chǎn)藥品質(zhì)量的關(guān)鍵環(huán)節(jié)����。
自2010 年提出實(shí)施雜質(zhì)譜控制的基本策略以來(lái),經(jīng)近十年持續(xù)的努力, 國(guó)內(nèi)已經(jīng)形成了一個(gè)比較成熟的藥品雜質(zhì)譜控制體系����。
筆者曾對(duì)2010年之前、2010~2015 年間化學(xué)藥品雜質(zhì)譜控制的進(jìn)展進(jìn)行了綜述����。
2015 年以來(lái)�,該領(lǐng)域在雜質(zhì)譜控制理念、分析技術(shù)及技術(shù)應(yīng)用等方面均得以迅速發(fā)展����,因此本文綜述2015 年以來(lái)化學(xué)藥品雜質(zhì)控制的進(jìn)展情況,并闡述亟待解決的問(wèn)題和發(fā)展前景����。
對(duì)藥物雜質(zhì)譜(impurity profile)的控制是保證藥品安全性的重要環(huán)節(jié),也是目前國(guó)內(nèi)新藥研發(fā)的關(guān)鍵制約因素�。
與雜質(zhì)譜控制相關(guān)的關(guān)鍵技術(shù)問(wèn)題可概括為:復(fù)雜體系樣本的分離分析、微量組分的結(jié)構(gòu)分析和微量組分的毒性評(píng)價(jià)三個(gè)方面[1]�。
理想的“雜質(zhì)譜控制(impurity profiling)”理念應(yīng)針對(duì)藥品中的每一個(gè)雜質(zhì)����,依據(jù)其生理活性制定相應(yīng)的質(zhì)控限度。
在國(guó)家重大新藥創(chuàng)制等項(xiàng)目的支持下,近年來(lái)國(guó)內(nèi)雜質(zhì)譜控制技術(shù)得以迅速發(fā)展�。
作者曾對(duì)2010—2015 年間化學(xué)藥品雜質(zhì)譜的研究進(jìn)展進(jìn)行過(guò)綜述[2],本文綜述了2015 年以來(lái)化學(xué)藥品雜質(zhì)譜研究的進(jìn)展�。
1法規(guī)���、指導(dǎo)原則與應(yīng)用
人用藥品注冊(cè)技術(shù)要求國(guó)際協(xié)調(diào)會(huì)(ICH)在制訂的原料藥���、制劑雜質(zhì)研究指導(dǎo)原則(ICH Q3A���,ICH Q3B),殘留溶劑研究指導(dǎo)原則(ICH Q3C)和元素雜質(zhì)研究指導(dǎo)原則(ICH Q3D)的基礎(chǔ)上,2014 年又頒布了基因毒性雜質(zhì)研究指導(dǎo)原則[Assessment and Control of DNA Reactive (Mutagenic) Impurities inPharmaceuticals to limit Potential Carcinogenic Risk����,ICH M7 (R1)]�,進(jìn)一步指導(dǎo)創(chuàng)新化學(xué)藥研發(fā)中的雜質(zhì)研究����。
雖然ICH 的指導(dǎo)原則對(duì)新藥注冊(cè)時(shí)藥品中的各類雜質(zhì)有了明確的要求����,但如何將指導(dǎo)原則與具體的研發(fā)實(shí)踐相結(jié)合仍有諸多問(wèn)題需要探討。
藥品中的雜質(zhì)可能來(lái)源于原料合成中的起始物����、溶劑、催化劑�、中間體、副產(chǎn)物等工藝過(guò)程�,也可能在制劑生產(chǎn)、貯存和使用過(guò)程中產(chǎn)生����。
從藥品的研發(fā)至產(chǎn)品上市通常要經(jīng)歷較長(zhǎng)的時(shí)間����,不同研發(fā)階段的關(guān)注重點(diǎn)應(yīng)有所不同���,且人們對(duì)產(chǎn)品中雜質(zhì)的認(rèn)識(shí)也是伴隨著對(duì)產(chǎn)品工藝、生產(chǎn)、貯存的不斷認(rèn)知而深入了解���。
然而���,目前僅美國(guó)食品藥品監(jiān)督管理局(FDA)和歐洲藥品管理局(EMA)針對(duì)新藥不同研發(fā)階段雜質(zhì)研究的關(guān)注點(diǎn)進(jìn)行過(guò)原則性地討論。
Olsen 等[3]對(duì)此進(jìn)行了綜述。
對(duì)于工藝雜質(zhì)���,應(yīng)在原料合成階段重點(diǎn)關(guān)注產(chǎn)品中可能出現(xiàn)的各類潛在雜質(zhì)����;當(dāng)最終合成路線確定后應(yīng)重點(diǎn)分析雜質(zhì)的去除途徑�,確定生產(chǎn)過(guò)程中的關(guān)鍵質(zhì)控點(diǎn)�;隨著工藝過(guò)程的不斷成熟���,再開(kāi)展未知雜質(zhì)的結(jié)構(gòu)確認(rèn)工作�,并開(kāi)發(fā)新的分析方法確定是否有潛在雜質(zhì)的存在�。
對(duì)于手性雜質(zhì)����,通常需從合成工藝的角度控制各類手性異構(gòu)體的產(chǎn)生���。
在新藥研發(fā)的早期���,雜質(zhì)的水平與產(chǎn)品的毒理學(xué)安全性評(píng)價(jià)結(jié)果相匹配;當(dāng)新藥進(jìn)入臨床研究階段����,產(chǎn)品中的雜質(zhì)限度可以按ICH 的要求進(jìn)行控制���,也可以基于臨床暴露劑量和毒理學(xué)結(jié)果適度調(diào)整�;有時(shí)根據(jù)內(nèi)控的安全警戒線����,雜質(zhì)的鑒別閾值和界定閾值可以調(diào)整至ICH Q3 的3倍,并隨著臨床暴露劑量的變化進(jìn)行相應(yīng)的調(diào)整[4]���;當(dāng)進(jìn)入III 期臨床時(shí)�,產(chǎn)品應(yīng)符合ICH 的要求���。
ICH M7 (R1) 對(duì)藥品中的基因毒性雜質(zhì)(mutagenic impurities, MIs)已經(jīng)有明確的控制要求���,依據(jù)毒理學(xué)關(guān)注閾值(TTC)�,最大的日攝入量為1.5 μg�。
最初人們普遍認(rèn)為在臨床試驗(yàn)階段也需要將MIs 控制在TTC 水平,但TTC 是基于“終身暴露時(shí)間(life time exposure)”(通常為75 年)設(shè)定的���,而早期臨床研究的暴露時(shí)間通常< 30 天����。
業(yè)界很快就認(rèn)識(shí)到這一規(guī)定缺乏科學(xué)性����,并提出分階段達(dá)到TTC 的建議[5]。
盡管ICH M7 (R1)已經(jīng)允許在周期較短的臨床試驗(yàn)中對(duì)MIs的控制可適度放寬�,但這一選項(xiàng)并未被充分利用,而更多的是選擇默認(rèn)的TTC限度[6]�。
這也不同程度的制約了新藥研發(fā)的進(jìn)程。
雜質(zhì)界定(qualification)是雜質(zhì)譜控制的關(guān)鍵環(huán)節(jié)���。
由于缺少有效的界定方法�,通常建議在允許的情況下應(yīng)盡可能地控制雜質(zhì)水平以符合ICH 的要求���。
應(yīng)特別關(guān)注文獻(xiàn)中是否已有足夠的數(shù)據(jù)證明已知雜質(zhì)的安全性����。
對(duì)特定的雜質(zhì)是否需要進(jìn)行界定,不僅取決于患者每日的攝入劑量�,而且還與藥品的適應(yīng)癥、給藥途徑����、服用時(shí)間等因素有關(guān)。
雖然在新藥研發(fā)中對(duì)雜質(zhì)進(jìn)行充分的研究是藥品注冊(cè)的基本要求�,但對(duì)已知和潛在雜質(zhì)的界定應(yīng)分階段進(jìn)行。
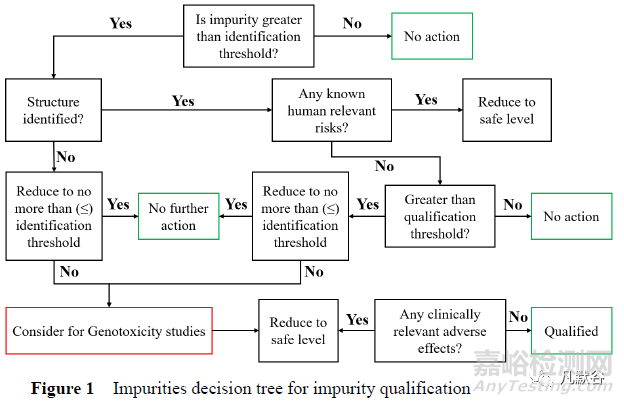
Shaikh 等[7]從確?���;颊甙踩慕嵌?,提出了新藥研發(fā)中進(jìn)行雜質(zhì)界定的決策樹(shù)(圖1):
①力爭(zhēng)將雜質(zhì)水平控制在ICH 的各種閾值以下;
②對(duì)含量大于鑒別限的雜質(zhì)結(jié)構(gòu)進(jìn)行鑒定����,根據(jù)文獻(xiàn)結(jié)果判斷其可能的臨床風(fēng)險(xiǎn);
③對(duì)含量大于界定限的雜質(zhì)�,評(píng)估其導(dǎo)致臨床中發(fā)生不良反應(yīng)的可能;
④對(duì)含量大于鑒定限的雜質(zhì)����,應(yīng)根據(jù)ICH M7 的要求進(jìn)行基因毒性的評(píng)估。
各種烷基磺酸酯類雜質(zhì)目前普遍被各國(guó)監(jiān)管部門認(rèn)為是磺酸鹽類藥物中的潛在基因毒性雜質(zhì)����,推測(cè)其在合成過(guò)程中與乙醇等低級(jí)醇發(fā)生酯化反應(yīng)產(chǎn)生���,因而要求企業(yè)必需對(duì)產(chǎn)品中是否可能殘留有相應(yīng)的烷基酯進(jìn)行全面驗(yàn)證。
然而Snodin 等[8]依據(jù)烷基磺酸酯的反應(yīng)機(jī)制和實(shí)驗(yàn)證據(jù)���,認(rèn)為合成工藝中形成的磺酸酯不可能達(dá)到具有顯著毒理學(xué)意義水平:
從熱力學(xué)角度�,磺酸鹽在醇中的酯化反應(yīng)極難發(fā)生����,需在強(qiáng)酸性條件下才能發(fā)生少量的轉(zhuǎn)化;
在乙醇溶劑中���,加入與藥物堿基等摩爾的磺酸根后���,二者即刻成鹽,進(jìn)而阻止了磺酸酯的形成�;
雖然合成中更易形成氯代烷烴,但氯代烷烴極易被清除���,且其在生物體內(nèi)的烷基化作用較磺酸酯弱很多�,根據(jù)現(xiàn)有的毒理學(xué)數(shù)據(jù)和ICH M7(R1)的規(guī)定,采用磺酸酯的安全限量控制氯代烷烴也是不科學(xué)的����。
因此,監(jiān)管部門對(duì)磺酸鹽相關(guān)工藝管理方式的科學(xué)性應(yīng)重新進(jìn)行評(píng)估���?���?贵w偶聯(lián)藥物(antibody-drug conjugates, ADCs)作為一種新興的藥物����,目前ICH Q3A、Q3B和Q6B(質(zhì)量標(biāo)準(zhǔn):生物技術(shù)產(chǎn)品/生物制品的試驗(yàn)程序和驗(yàn)收標(biāo)準(zhǔn))的相關(guān)規(guī)定均不能完全滿足對(duì)其中小分子雜質(zhì)的控制要求����。
國(guó)際藥物研發(fā)創(chuàng)新與質(zhì)量聯(lián)盟(The International Consortium for Innovation and Quality inPharmaceutical Development, IQ)成立專門的工作組(IWG)對(duì)該問(wèn)題進(jìn)行討論[9]����。
基于風(fēng)險(xiǎn)評(píng)估的方法,基于ADCs中小分子雜質(zhì)的分子量�、與蛋白載體的結(jié)合特性、ADC的給藥濃度和給藥方式等���,提出了ADC中小分子雜質(zhì)的安全性評(píng)估策略和構(gòu)建ADC質(zhì)量控制體系的方案����。
ADCs中的小分子雜質(zhì)不管是否已與蛋白載體結(jié)合均應(yīng)進(jìn)行控制;通過(guò)對(duì)ADC結(jié)合工藝的控制���,減少雜質(zhì)與載體蛋白的結(jié)合���;通過(guò)對(duì)后續(xù)純化工藝的控制,保證對(duì)游離雜質(zhì)及藥物的有效去除���,使之滿足ICH Q3A的一般要求���;通過(guò)ADC藥物穩(wěn)定性的評(píng)估,預(yù)測(cè)制劑中游離小分子雜質(zhì)是否能滿足ICH Q3B的要求���。
評(píng)價(jià)結(jié)果提示�,ADC中的小分子雜質(zhì)含量通常非常低�,基本不會(huì)導(dǎo)致臨床安全風(fēng)險(xiǎn)。
對(duì)仿制藥技術(shù)標(biāo)準(zhǔn)的協(xié)調(diào)是藥物研發(fā)的另一熱點(diǎn)���。
2018 年10 月18 日美國(guó)FDA 向ICH 提議協(xié)調(diào)全球仿制藥審評(píng)標(biāo)準(zhǔn)[10]:以提高全球仿制藥質(zhì)量的一致性���;提高監(jiān)管監(jiān)督效率并降低監(jiān)管成本����;擴(kuò)大全球仿制藥市場(chǎng)規(guī)模���,通過(guò)競(jìng)爭(zhēng)降低仿制藥研發(fā)的成本����,最終使患者受益����。
2019 年2 月6 日,ICH 發(fā)布了對(duì)此問(wèn)題的思考[11]:認(rèn)為雖然許多ICH 指南適用于仿制藥�,但建立協(xié)調(diào)一致的仿制藥注冊(cè)標(biāo)準(zhǔn)具有重要意義,并將在2019 年組建仿制藥討論組(Informal Generic DrugDiscussion Group, IGDG)對(duì)其可行性進(jìn)行評(píng)估����。
2015 年8 月18 日,國(guó)務(wù)院印發(fā)的《關(guān)于改革藥品醫(yī)療器械審評(píng)審批制度的意見(jiàn)》���,將“提高仿制藥質(zhì)量,加快仿制藥質(zhì)量一致性評(píng)價(jià)”作為我國(guó)改革藥品審評(píng)審批制度的五大目標(biāo)之一����;以2016年3 月5 日國(guó)務(wù)院辦公廳發(fā)布的《關(guān)于開(kāi)展仿制藥質(zhì)量和療效一致性評(píng)價(jià)的意見(jiàn)》為節(jié)點(diǎn)����,國(guó)內(nèi)以生物等效為目標(biāo)的口服制劑一致性評(píng)價(jià)工作蓬勃開(kāi)展�;2017 年12 月,CDE 一致性評(píng)價(jià)辦公室又發(fā)布了《已上市化學(xué)仿制藥(注射劑)一致性評(píng)價(jià)技術(shù)要求(征求意見(jiàn)稿)》�,揭開(kāi)了注射劑仿制藥一致性評(píng)價(jià)的大幕。
雜質(zhì)研究一直是仿制藥一致性評(píng)價(jià)中審評(píng)的重點(diǎn)����。
鑒于仿制藥與參比制劑生產(chǎn)工藝的差異,二者的雜質(zhì)譜可能不完全相同���。
雖然按新仿制藥的一般要求���,對(duì)參比制劑中不存在的“新雜質(zhì)”原則上要按照ICH 的要求進(jìn)行控制,對(duì)各國(guó)藥典已經(jīng)收載的“已知雜質(zhì)”原則上要進(jìn)行鑒別與比較���。
但進(jìn)行一致性評(píng)價(jià)的國(guó)產(chǎn)制劑通常在臨床中已應(yīng)用了較長(zhǎng)時(shí)間����,歷年的藥物不良反應(yīng)信息可以在一定程度上揭示仿制藥的安全信息����。
如何基于風(fēng)險(xiǎn)控制理念�,形成我國(guó)仿制藥一致性評(píng)價(jià)中的雜質(zhì)評(píng)估/控制策略�,是業(yè)界和監(jiān)管部門面臨的新挑戰(zhàn)。
2雜質(zhì)譜分析技術(shù)進(jìn)展
伴隨著對(duì)原料藥和制劑中各種工藝雜質(zhì)(包括基因毒性雜質(zhì))和降解產(chǎn)物監(jiān)管要求的不斷提高���,對(duì)痕量水平雜質(zhì)的表征和分析在藥物雜質(zhì)譜分析中越來(lái)越受到重視���。
各類分析儀器的發(fā)展,特別是GC-MS���、LC-MS����、CE-MS���、SFC-MS����、LC-NMR�、CE-NMR、LC-FTMS 等聯(lián)用技術(shù)的發(fā)展���,可實(shí)現(xiàn)在線對(duì)含量在~0.1%水平的雜質(zhì)進(jìn)行快速分析���。
近年來(lái),對(duì)已知雜質(zhì)的快速識(shí)別策略已經(jīng)相當(dāng)完善[3,12]���;利用在線或離線的HPLC-MS 和/或HPLC-NMR 技術(shù)����,或樣品不經(jīng)分離直接進(jìn)行NMR 分析并結(jié)合光譜分析����,對(duì)未知雜質(zhì)和降解物快速進(jìn)行結(jié)構(gòu)確認(rèn)也取得較大進(jìn)展;基因毒性雜質(zhì)(MIs)和手性藥物對(duì)映體的分析檢查也受到高度重視[12]����。
2.1 MIs 分析
Teasdale 等[6]對(duì)ICH M7 實(shí)施以來(lái)MIs 的分析進(jìn)展進(jìn)行了系統(tǒng)的綜述:新的分析方法更注重對(duì)一類而不是單一的MIs 進(jìn)行分析,方法開(kāi)發(fā)除要求具有更高的靈敏度和專屬性外���,還應(yīng)盡量減少基質(zhì)效應(yīng)的干擾����。
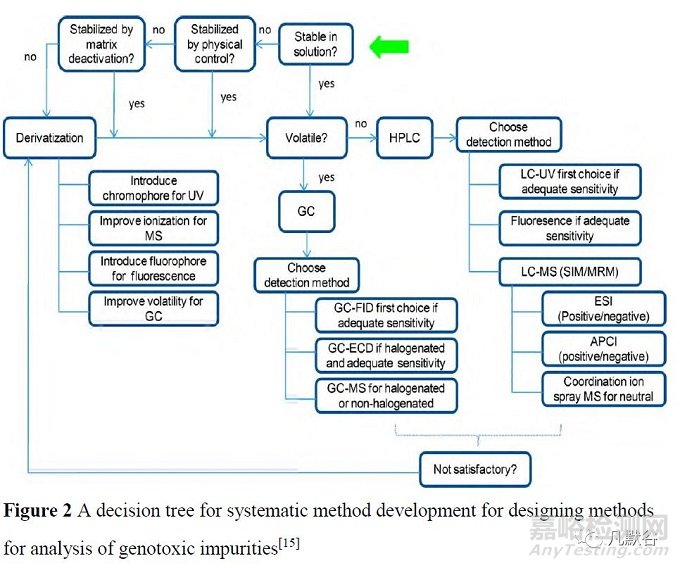
氣相色譜法(GC)是分析具揮發(fā)性MIs 的首選方法���,高效液相色譜法(HPLC)用于對(duì)非揮發(fā)性MIs 的分析���;可以通過(guò)衍生化等方法改善MIs 的揮發(fā)性和穩(wěn)定性�;采用頂空進(jìn)樣方式可以有效避免基質(zhì)效應(yīng)���,使得更易方法開(kāi)發(fā)����。
已有綜述詳細(xì)論述了系統(tǒng)分析MIs 的一般策略與方法[13, 14]�。
Sun 等[15]基于MIs 的揮發(fā)性,從避免基質(zhì)干擾的角度提出了選擇MIs 分析方法的決策樹(shù)(圖2)����,并用于探討穩(wěn)定性實(shí)驗(yàn)中易形成基因毒性雜質(zhì)的常見(jiàn)降解途徑,用以指導(dǎo)藥物的研發(fā)與審批[16]���。
HILIC(親水相互作用色譜法)作為其他色譜技術(shù)特別是GC 的互補(bǔ)方法����,常用于替代GC 對(duì)極性MIs 進(jìn)行分析����。
McCalley[18]對(duì)HILIC 的分離機(jī)制進(jìn)行了綜述�,可指導(dǎo)方法的開(kāi)發(fā)����。
采用HILIC-UV 法測(cè)定達(dá)伐吡啶(dalfampridine)中5 種潛在的芳香胺類MIs���,其中�,色譜柱的選擇是關(guān)鍵:Zorbax 硅膠柱(5 μm)能給出理想的分析結(jié)果���,其他HILIC 柱如兩性柱(ZIC-HILIC 柱)或腈基柱(nitrile-HILIC 柱)的峰形較差�,離子對(duì)試劑可導(dǎo)致方法的回收率變差����;而C8或C18 色譜系統(tǒng)的選擇性較差[18]。
利用ZIC-pHILIC 親水作用色譜柱���,采用CAD或NQAD 檢測(cè)器�,在含TFA 流動(dòng)相中可對(duì)12 種不具紫外吸收的堿性MIs 包括已知致癌物肼(hydrazine)進(jìn)行測(cè)定[19]����。
Denton 等[20]利用HILIC 實(shí)現(xiàn)了對(duì)微量氯丙二醛(2-chloromalonaldehyde)的分析。
Douša 等[21]利用HILIC-MS 方法分析沃替西?。?vortioxetine ) 中微量的二(2- 氯乙基) 胺[2-chloro-N-(2-chloroethyl)ethanamine]���。
衍生化技術(shù)可以進(jìn)一步提高M(jìn)Is 分析的靈敏度。
Grinberg 等在乙腈中以吡啶為衍生化試劑����,對(duì)美托洛爾起始原料中的硫酸二甲酯(dimethyl sulfate, DMS)進(jìn)行衍生化處理,分析衍生化產(chǎn)物N-甲基吡啶�;
采用HILIC-ESI-MS 的SIM 檢測(cè)模式,DMS 的線性范圍為0.05~10 ppm���,LOD 和LOQ分別為0.4 和1 ppm[22]�;
利用新型的衍生化試劑BPPC [butyl-1-(pyridine-4-yl)piperidine-4-carboxylate]�,采用HILIC-MS/MS 方法,可作為API 中烷基鹵化物和烷基磺酸鹽的常規(guī)分析方法或篩查方法�,前者的檢測(cè)水平為0.1 ppm,后者為1ppm���,且方法不易受基質(zhì)的干擾[23]�。
離子色譜法雖然常作為 GC-MS 或HPLC-MS 的輔助技術(shù)���,用于分析強(qiáng)極性的MIs 如烷基氯化物(alkyl chlorides)���、肼等�,但近年來(lái)的進(jìn)展較小[6]�。
Frenzel等[24]對(duì)離子色譜分析中常用的膜凈化方法進(jìn)行了綜述;采用在線固相萃取技術(shù)����,測(cè)定甲磺酸雷沙吉蘭中的痕量羥胺:樣品溶液中的甲磺酸雷沙吉蘭被截留在IonPac CG12A 固相萃取柱上,羥胺進(jìn)入色譜測(cè)定單元(CG12A 保護(hù)柱����、CS12A分析柱�、安培檢測(cè)器);方法的LOD 和LOQ 分別為0.02 和0.04 μg·mL-1 [25]�。
超臨界色譜(SFC)也常作為HPLC 的互補(bǔ)方法。
Lesellier 和Westd 對(duì)近年來(lái)SFC的技術(shù)進(jìn)展進(jìn)行了綜述[26]���。
以超臨界二氧化碳為流動(dòng)相����,甲醇為極性改性劑���,采用兩種不同的苯基柱(Synergi polar RP 和Cosmosil 5PBB)����,比較SFC 對(duì)多環(huán)芳烴(PAHs)分離的選擇性:發(fā)現(xiàn)PAHs 在SFC 和HPLC 中的保留行為不同;改性劑甲醇的濃度對(duì)MIs 在Synergi polar RP 柱的分離影響較大����,但對(duì)Cosmosil 柱的分離影響較小[27]。
比較SFC-ELSD 和HPLC-ELSD 分析PVC 塑料中的塑化劑(ATBC����、DEHA、DEHT���、TOTM)����,SFC-ELSD 的靈敏度更高�,但HPLC-ELSD的精密性更好[28]。
毛細(xì)管電泳(CE)及電色譜技術(shù)對(duì)極性樣品具有良好的分離選擇性���,雖然其靈敏度較低���,通常不宜用于MIs 分析;但CE 的載樣量高�,間接紫外檢測(cè)的檢測(cè)限可達(dá)2 ~ 3 ppm;作為HPLC 的互補(bǔ)分離技術(shù),在分析原料藥中磺酸基�、肼/烷基胺、疊氮化物�、硫酸二甲酯和氯乙酰等PMIs 中均有應(yīng)用[6]。
硼酸及相關(guān)酯類作為新的MIs���,主要在一些高效偶聯(lián)反應(yīng)如鈴木-宮浦(Suzuki-Miyaura) 反應(yīng)中產(chǎn)生����。
由于硼酸類MIs 可以通過(guò)對(duì)硼元素的測(cè)定�,再通過(guò)化學(xué)計(jì)量關(guān)系得到其含量,因此����,利用ICP-MS 和硼靶對(duì)樣品中的殘留硼進(jìn)行測(cè)定�,不僅靈敏度高(LOQ 為0.8 ppm����,限度值為40 ppm),選擇性好���,且可避免常見(jiàn)的基質(zhì)干擾�。
Patel 等[29]對(duì)該方法的參數(shù)設(shè)置及優(yōu)化中常見(jiàn)的問(wèn)題進(jìn)行了綜述。
對(duì)烷化劑類MIs 的測(cè)定常采用GC-MS 或HPLC-MS(經(jīng)衍生化處理)方法���,但鑒于ICP 對(duì)硫和鹵素元素的測(cè)定已達(dá)到ppb 級(jí)���,這為烷化劑的分析提供了新的解決方案[30]。
利用HPLC-ICP-MS 分析烷基化劑4-氯-1-丁醇���,采用3-碘苯甲酰試劑進(jìn)行衍生化���,方法的LOD和LOQ分別為0.2 和0.5 ppm����,線性范圍(μg·g-1API)為0.5~50 ppm�,1~50 ppm 的準(zhǔn)確性為95.1% ~ −114.7%����,重復(fù)性(RSD)為6.2%[31]����。
采用相同的方法測(cè)定烷化劑苯肼可得到相似的結(jié)果,如采用三碘代衍生物試劑�,可提高方法的靈敏度,LOD 和LOQ 分別為0.06 和0.2 ppm[32]����。
2.2 元素雜質(zhì)分析
各類元素雜質(zhì)可能在藥品生產(chǎn)的諸環(huán)節(jié)中被無(wú)意引入終產(chǎn)品對(duì)患者造成危害。
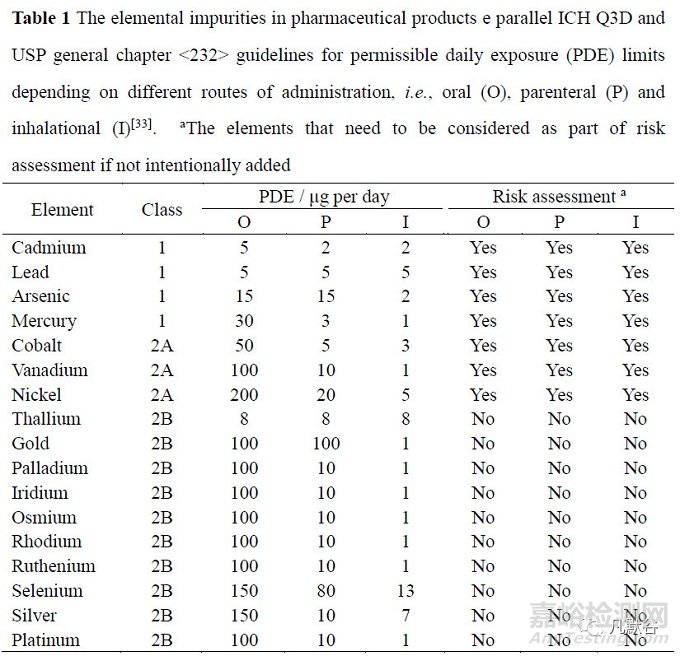
ICH Q3D 建議對(duì)藥品中的元素雜質(zhì)應(yīng)進(jìn)行定性和定量限制���,藥品中各類元素雜質(zhì)的可接受的每日接觸量(permissible daily exposure, PDE)限度與給藥途徑有關(guān)����,USP 在新頒布的通則<232>中對(duì)藥品中的24 個(gè)元素雜質(zhì)提出了明確的質(zhì)控要求(表1)���,目前國(guó)內(nèi)藥物研發(fā)的相關(guān)法規(guī)政策也正逐漸向ICH 靠攏。
通常藥品終產(chǎn)品中殘存的痕量或超痕量的 Ir����、Os�、Pd、Pt���、Rh 和Ru 等元素雜質(zhì)���,可能與原料合成中使用的催化劑有關(guān)�;Cd����、Hg、Ni����、Pb 等元素雜質(zhì)可能通過(guò)生產(chǎn)中的水和溶劑、合成試劑����、輔料(穩(wěn)定劑、填充劑���、粘合劑����、顏料�、香料和涂料)等途徑污染藥物;而Cr���、Cu�、Mo、Ni�、V 等元素雜質(zhì)可能與制造過(guò)程中產(chǎn)品與混合罐、過(guò)濾器���、填充線�、包裝容器等表面的接觸污染產(chǎn)品[33]�。
enke等[34]對(duì)由藥品生產(chǎn)和包裝環(huán)節(jié)引入元素雜質(zhì)的風(fēng)險(xiǎn)進(jìn)行了綜述。
與藥物接觸的各類生產(chǎn)線����、包裝容器等材料,與藥品接觸時(shí)通常只有微量的元素實(shí)體可轉(zhuǎn)移至藥品中�。
因此,雖然某些元素雜質(zhì)在自然環(huán)境中普遍存在����,但經(jīng)制藥過(guò)程和包裝材料引入藥品的風(fēng)險(xiǎn)并不高。
Boetzel 等[35]介紹了一個(gè)由制藥公司聯(lián)盟整理的包括201 種輔料���、26 723 個(gè)檢測(cè)數(shù)據(jù)的元素雜質(zhì)數(shù)據(jù)庫(kù)����,是目前同類數(shù)據(jù)庫(kù)的佼佼者����,且仍在迅速擴(kuò)大,可用于藥品的風(fēng)險(xiǎn)評(píng)估�。
Paskiet 等[36]對(duì)注射劑從常用的密封橡膠實(shí)體引入元素雜質(zhì)的風(fēng)險(xiǎn)進(jìn)行了評(píng)估。
電感耦合等離子體-質(zhì)譜法(ICP-MS)是目前測(cè)定元素雜質(zhì)的最常用手段���,其次是電感耦合等離子體原子發(fā)射光譜法(ICP-AES)���,它們均可在多類樣品基質(zhì)中同時(shí)檢測(cè)多種元素雜質(zhì);當(dāng)僅對(duì)一種或幾種特定元素雜質(zhì)如Hg,����、As 和Cr 進(jìn)行測(cè)定時(shí),傳統(tǒng)的原子吸收光譜法(AAS)也可得到理想的分析結(jié)果[33]�。
Wollein 等[37]采用ICP-MS、電感耦合等離子體-發(fā)射光譜法(ICP-OES)和原子吸收光譜法(GFAAS, CVAAS, HGAAS)�,對(duì)市場(chǎng)中113 個(gè)樣品的21 種金屬雜質(zhì)進(jìn)行了分析,Li 等[38]綜述了31 種190 個(gè)藥用輔料樣品元素雜質(zhì)的檢測(cè)方法及測(cè)定結(jié)果����,ICP-MS 特別適用于對(duì)日攝入量高的注射劑和吸入制劑中微量元素雜質(zhì)的測(cè)定,定量精密度(RSD)小于4.5%����;
ICP-OES 的操作較簡(jiǎn)單且具有較快的分析速度����,通?���?捎糜谠牧虾涂诜苿┲械脑仉s質(zhì)分析;兩種分析技術(shù)的測(cè)定結(jié)果均可滿足USP 通則<232>的要求[33, 37]���。
Menoutis 等[39]采用超聲霧化(UN)軸向電感耦合等離子原子發(fā)射光譜法(ICP-AES)測(cè)定微量的一類和二類元素雜質(zhì)����,較常規(guī)ICP-MS 分析具有更低的檢出限����。
Balaram[40]對(duì)各類儀器分析方法包括便攜式儀器、原子吸收光譜法(AAS)、X-射線熒光光譜分析(XRF)法、儀器中子活化分析(INAA)法���、ICP-AES 和ICP-MS 的應(yīng)用進(jìn)行了綜述。
采用微波輔助消解(MWAD)技術(shù)對(duì)樣品進(jìn)行前處理是元素雜質(zhì)分析的關(guān)鍵環(huán)節(jié)。
USP 通則< 233 >給出了兩種通用方法����,分別用于ICP-AES 分析和ICP-MS分析。
Jin[41]對(duì)元素雜質(zhì)分析樣本前處理中的常見(jiàn)污染途徑進(jìn)行了綜述���,對(duì)實(shí)驗(yàn)室環(huán)境、試劑和器皿的控制是保證測(cè)定結(jié)果準(zhǔn)確的關(guān)鍵����。
Muller 等[42]通過(guò)比較濃硝酸、王水(aqua regia)和逆王水(inverse aqua regia)對(duì)4 種原料藥的微波消解效率�,發(fā)現(xiàn)硝酸和逆王水較理想,前者可有效消解500 mg 樣品���,后者適用于250 mg 以下樣品的消解�,所有的測(cè)定元素(除Os 元素易形成OsO4 影響回收外)均有較好的回收率(91% ~ 109%)���;
da Silva 等[43]利用逆王水建立了適用于采用ICP-OES 和ICP-MS 快速分析As����、Cd���、Hg、Pb 的簡(jiǎn)單微波輔助消解方法�;Paskiet等[36]比較了多種對(duì)合成橡膠中元素雜質(zhì)的提取方法。
2.3 浸出物/萃取物分析
藥品中的浸出物一般認(rèn)為是在常規(guī)或加速條件下,從與藥物接觸的實(shí)體(包裝材料���、注射器�、輸液管等)中遷移至藥品中的化學(xué)物質(zhì)���;對(duì)藥品中各類浸出物的分析屬于雜質(zhì)譜分析的一部分�。
而萃取物一般認(rèn)為是在實(shí)驗(yàn)室受控萃取研究中從試驗(yàn)品釋放到萃取介質(zhì)中的化學(xué)物質(zhì)����。
萃取物包括各類揮發(fā)性、半揮發(fā)性���、非揮發(fā)性的有機(jī)和無(wú)機(jī)化合物���,開(kāi)展受控萃取研究是希望了解藥品真實(shí)的浸出物譜,進(jìn)而評(píng)估各類浸出物的安全風(fēng)險(xiǎn)[44]���。
理想的情況是按照質(zhì)量源于設(shè)計(jì)(QbD)的理念����,依據(jù)藥品的組成�、包裝系統(tǒng)的組成與型狀�、與藥物的接觸情況等�,評(píng)估得到在生產(chǎn)及貯存過(guò)程藥品中浸出物的安全空間;Jenke以塑料包裝的注射液為例�,論證了該理念的可行性[45]。
從藥用聚合物材料萃取物中鑒定出的540 余種化合物的毒理學(xué)信息包括未觀察到作用的水平(no observed effect levels, NOELs)���、未觀察到有害作用的水平(no observed adverse effect levels, NOAELs) 、公布的最低中毒劑量(lowestpublished toxic dose, TDLOs)等毒理學(xué)終點(diǎn)指標(biāo)已被匯總�,可用于浸出物的風(fēng)險(xiǎn)評(píng)估[46];
由一個(gè)非營(yíng)利性聯(lián)合體-產(chǎn)品質(zhì)量研究所(PQRI)設(shè)立的浸出物/萃取物工作小組����,對(duì)藥品研發(fā)過(guò)程中與浸出物/萃取物有關(guān)的科學(xué)和管理問(wèn)題進(jìn)行了探討,目前已在浸出物/萃取物分析的標(biāo)準(zhǔn)化工作程序和安全閾值等方面達(dá)成共識(shí)�,且分別用于對(duì)口腔吸入劑、鼻腔制劑����、注射劑、眼用制劑中的浸出物的風(fēng)險(xiǎn)評(píng)估[47,48]�。
采用水和有機(jī)萃取溶劑對(duì)生產(chǎn)注射劑包裝袋的21 種常用聚丙烯樹(shù)脂進(jìn)行萃取研究,并根據(jù)萃取物譜評(píng)估其對(duì)注射劑長(zhǎng)期����、大劑量治療時(shí)的潛在風(fēng)險(xiǎn)[49]。
雖然由于處方工藝的差異,在不同萃取條件下不同的聚丙烯樹(shù)脂的有機(jī)萃取物譜差異較大����,但依據(jù)特定的萃取成分如抗氧劑等可將其分為不同的組,同組樣品的萃取物譜具有相似性���;大多數(shù)萃取液中元素雜質(zhì)(鋁���、硅、堿金屬和堿土金屬)的量均較低���。
浸出物/萃取物分析的另一關(guān)鍵點(diǎn)是如何保證所有浸出/萃取出的物質(zhì)都得到檢出���。
色譜法是常用的分析方法。
Jenke 等[50]采用互補(bǔ)的色譜系統(tǒng)如GC 和HPLC結(jié)合多種檢測(cè)方式�,分析藥物包裝、生產(chǎn)和釋藥系統(tǒng)等常用的塑料材料中的萃取物譜���,為防止色譜分析中遺漏了某些萃取物����,利用總有機(jī)碳含量(TOC)測(cè)定法評(píng)估對(duì)各類水提物(包括緩沖液提取物)分析結(jié)果的完整性����,并在對(duì)無(wú)菌濾器水提物等的分析中得到了較好的應(yīng)用����。
對(duì)提取物中不適合用GC 進(jìn)行分析的非揮發(fā)性及熱不穩(wěn)定化合物���,在由大氣化學(xué)電離質(zhì)譜結(jié)合紫外檢測(cè)器組成的UPLC 系統(tǒng)中����,22 min 即可實(shí)現(xiàn)對(duì)多種常見(jiàn)提取物中的代表性化合物混合物進(jìn)行充分的分離與檢測(cè)���,在對(duì)實(shí)際萃取樣品進(jìn)行分析時(shí),即使分析對(duì)象是不相容的有機(jī)萃取液����,也不會(huì)對(duì)色譜系統(tǒng)產(chǎn)生顯著影響[51]。
通過(guò)模擬浸出(遷移)試驗(yàn)(由低密度聚乙烯瓶����、聚丙烯瓶蓋和膠塞等組成、萃取溶劑分別為pH 2.5 的緩沖溶液���、pH9.5 的緩沖溶液和體積比1:1 的異丙醇/水)�,揭示注射劑和滴眼劑包材的浸出物譜。
包材的萃取物譜與包材的化學(xué)組成與結(jié)構(gòu)密切相關(guān)����,且受萃取介質(zhì)和具體浸出物化學(xué)性質(zhì)的影響;雖然藥物與包材直接接觸可能加速某些浸出物的遷移���,但并不是發(fā)生遷移和浸出的先決條件[52]���。
膠塞中的析出物與頭孢菌素相互作用,導(dǎo)致貯存過(guò)程中藥品溶解時(shí)逐漸變渾濁是國(guó)內(nèi)突出的質(zhì)量問(wèn)題[53]����。
利用GC-MS 建立的膠塞揮發(fā)性成分分析數(shù)據(jù)庫(kù),不僅可以快速分析常用膠塞中的主要揮發(fā)性遷移物����,還可以快速確認(rèn)易與頭孢菌素相互作用的遷移物;結(jié)合模擬吸附試驗(yàn)���,可形成有效的頭孢菌素-膠塞相容性試驗(yàn)策略�,進(jìn)而針對(duì)性地建立膠塞質(zhì)控方法[54]����。
2.4 AQbD 理念及應(yīng)用
風(fēng)險(xiǎn)管理理念與質(zhì)量保證體系的緊密結(jié)合是保證藥品質(zhì)量的重要環(huán)節(jié)�。
雜質(zhì)譜控制過(guò)程中�,保證雜質(zhì)質(zhì)控分析方法在整個(gè)藥品生命周期都具有良好的專屬性和敏感性。
分析方法質(zhì)量源于設(shè)計(jì)(analytical quality bydesign, AQbD)理念作為一種面向風(fēng)險(xiǎn)管理的方法論�,近年來(lái)在建立雜質(zhì)譜分析方法時(shí)被廣泛接受。
與傳統(tǒng)的質(zhì)量源于檢測(cè)(quality by testing, QbT)方法相比較����,其根據(jù)分析目標(biāo)的變化范圍(analytical target profile, ATP),利用實(shí)驗(yàn)設(shè)計(jì)(DoE)的方法�,同時(shí)考慮管理與分析方法的風(fēng)險(xiǎn)來(lái)確定設(shè)計(jì)空間(design space,DS),可最大程度的保證方法的有效性[55, 56]����。
采用AQbD 理念建立的分析方法,由于允許實(shí)驗(yàn)參數(shù)在操作設(shè)計(jì)區(qū)域(method operable design region, MODR)內(nèi)變化�,方法具有更好的粗放性����,可減少實(shí)驗(yàn)中的超出趨勢(shì)結(jié)果(out of trend, OOT)和超出標(biāo)準(zhǔn)結(jié)果(out of specification, OOS)[57];
同時(shí)�,由于可最大限度地減少在方法轉(zhuǎn)移(transfer)、性能確認(rèn)(verification)和方法變更中的工作量���,有助于降低對(duì)分析方法生命周期管理包括方法設(shè)計(jì)����、方法開(kāi)發(fā)和方法驗(yàn)證(儀器的檢定、持續(xù)的方法性能驗(yàn)證和方法轉(zhuǎn)移)的成本[58]�。
Dispas 等[56]對(duì)近年來(lái)AQbD 在雜質(zhì)譜分析中的應(yīng)用進(jìn)展進(jìn)行了綜述。
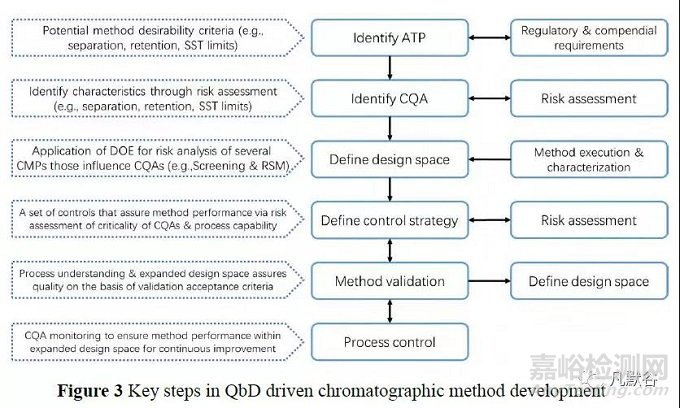
在基于AQbD 理念的HPLC 方法開(kāi)發(fā)中�,化學(xué)計(jì)量學(xué)方法在確定適宜的設(shè)計(jì)方案篩選關(guān)鍵影響因子,建立定量關(guān)系模型確定方法的操作空間等方面����,發(fā)揮著越來(lái)越重要的作用(圖3)[59]。
Tumpa 等[60]提出了基于QbD 的理念建立HILIC 方法的指導(dǎo)原則����;Zhang 等[61]利用混合過(guò)程變量(mixture-process variable, MPV)設(shè)計(jì),建立了基于QbD 理念的HPLC 雙梯度洗脫分析方法�,用于氯唑西林穩(wěn)定性試驗(yàn)中降解雜質(zhì)的測(cè)定;Taheri 等[62]在對(duì)塞來(lái)昔布(celecoxib)共洗脫物的半制備分離中����,利用中心復(fù)合設(shè)計(jì)成功的選擇出最佳色譜分離條件。
對(duì)利用 HPLC-MS/MS 等聯(lián)用技術(shù)建立的可同時(shí)測(cè)定幾十至幾百種目標(biāo)分析物的分析方法����,如對(duì)殘留農(nóng)藥等的測(cè)定,按傳統(tǒng)的方法驗(yàn)證要求�,通常需要采用標(biāo)準(zhǔn)加入法對(duì)定量準(zhǔn)確性等參數(shù)進(jìn)行驗(yàn)證����。
該驗(yàn)證程序不僅費(fèi)時(shí)����、費(fèi)力;且當(dāng)目標(biāo)分析物變化如增加了新的控制對(duì)象時(shí)�,需重新對(duì)方法進(jìn)行驗(yàn)證;實(shí)驗(yàn)中如對(duì)照品的加入量不適宜����,還可能得到不正確的驗(yàn)證結(jié)果。
Alladio 等[63]利用化學(xué)計(jì)量學(xué)方法����,建立了對(duì)新目標(biāo)分析物的保留時(shí)間、基質(zhì)效應(yīng)����、回收率����、LOD 和LOQ進(jìn)行預(yù)測(cè)的偏最小二乘法模型,用于評(píng)價(jià)已有方法對(duì)新目標(biāo)分析物的分析能力����,并取得了預(yù)期的評(píng)價(jià)效果�。
利用定量結(jié)構(gòu)-保留關(guān)系(QSRR)不僅可以預(yù)測(cè)分析物的保留時(shí)間���,且有助于對(duì)其分離機(jī)制的了解����。
對(duì)未知組分保留值的預(yù)測(cè)可以幫助選擇分析方法���,減少方法開(kāi)發(fā)的時(shí)間����。
Amos 等[64]對(duì)建立QSRR 模型的方法����、關(guān)鍵點(diǎn)和預(yù)測(cè)精度等進(jìn)行了綜述。
根據(jù)溶質(zhì)的色譜相似度指數(shù)(chromatographicsimilarity index)建立局部QSRR 模型可準(zhǔn)確預(yù)測(cè)溶質(zhì)的保留值[65]����。
比較4 種常用的評(píng)價(jià)QSRR 模型預(yù)測(cè)準(zhǔn)確性的表征方法,認(rèn)為預(yù)測(cè)均方根誤差百分比(RMSEP)是對(duì)QSRR 模型預(yù)測(cè)能力的最佳估計(jì)值[66]�。
利用定量結(jié)構(gòu)-保留關(guān)系(QSRR)模型,通過(guò)預(yù)測(cè)分析物在5 種不同HILIC 固定相上的保留值,可以幫助選擇最適宜分離的固定相[67]�。
利用定量結(jié)構(gòu)-保留關(guān)系(QSRR)結(jié)合疏水消除模型(HSM),預(yù)測(cè)分析物在反相液相色譜系統(tǒng)(RPLC)中的保留值���,可以預(yù)測(cè)藥物雜質(zhì)是否與藥物活性成分(API)的共洗脫[68]���。
當(dāng)缺乏雜質(zhì)對(duì)照品,無(wú)法判斷一個(gè)新建立的色譜方法是否可以對(duì)藥物中所有的已知雜質(zhì)都能檢出時(shí)����,利用QSRR 模型,通過(guò)預(yù)測(cè)已知雜質(zhì)的保留時(shí)間���,可以幫助判斷方法對(duì)已知雜質(zhì)的檢出能力[69]����,并可以預(yù)測(cè)新雜質(zhì)的色譜行為[70]�。
2.5 其他
選擇適宜的色譜柱依然是藥物雜質(zhì)譜分析的熱點(diǎn)。
不同色譜柱的選擇性差異�,常導(dǎo)致無(wú)法重現(xiàn)文獻(xiàn)甚至藥典中收載的成熟的雜質(zhì)分析方法。
因此�,如何快速尋找到性能適宜的色譜柱常成為實(shí)驗(yàn)的關(guān)鍵?��;谑杷P偷纳V柱表征體系已在色譜柱的選擇包括選擇相似或互補(bǔ)的色譜柱���,選擇最佳分離色譜柱中廣泛應(yīng)用[71],并推動(dòng)了色譜柱選擇模式的發(fā)展[72-74]���。
基于疏水消除模型�,發(fā)現(xiàn)影響β-內(nèi)酰胺類抗生素難分離雜質(zhì)對(duì)分離的關(guān)鍵色譜柱參數(shù)是柱參數(shù)A���,并提出了參數(shù)A 的最佳區(qū)間[75]���。
以克拉霉素雜質(zhì)分析為例,選擇適用于分離難分離雜質(zhì)對(duì)的色譜柱����,提出了應(yīng)用疏水消除模型針對(duì)特定分析方選擇最佳色譜柱的策略[76]。
上述研究體現(xiàn)了色譜柱選擇理論在實(shí)用化方面取得的進(jìn)展�,而通過(guò)分子模擬方法如分子動(dòng)力學(xué)或蒙特卡羅方法,最大化地減少實(shí)驗(yàn)篩選過(guò)程是色譜柱選擇應(yīng)用研究的目標(biāo)[77]�。
藥物雜質(zhì)譜分析中的另一關(guān)鍵點(diǎn)是對(duì)雜質(zhì)的檢測(cè)與定量。在對(duì)各類不具有UV吸收的樣品的分析中���,基于氣溶膠(aerosol-based)檢測(cè)的各類通用性檢測(cè)器特別是電噴霧檢測(cè)器(charged aerosol detectors���,CAD)和電化學(xué)檢測(cè)器發(fā)揮著越來(lái)越重要的作用���。
雖然CAD檢測(cè)器被普遍認(rèn)為是一種質(zhì)量型檢測(cè)器,可以在沒(méi)有對(duì)照品的情況下實(shí)現(xiàn)對(duì)溶質(zhì)絕對(duì)含量的準(zhǔn)確估計(jì)�,然而對(duì)50種具有廣泛物理化學(xué)性質(zhì)的化合物的HPLC-CAD測(cè)定結(jié)果表明,相對(duì)于傳統(tǒng)的質(zhì)量校正定量方法�,通過(guò)估計(jì)檢測(cè)顆粒的相對(duì)表面積進(jìn)行校正,可得到更準(zhǔn)確的定量結(jié)果�,特別是可以明顯提高對(duì)密度較高溶質(zhì)定量的準(zhǔn)確性(與NMR定量的平均誤差為5.8%)[78]。
在雜質(zhì)譜分析中利用雜質(zhì)對(duì)照品進(jìn)行定性與定量分析是最理想的方案�,在藥典等質(zhì)量標(biāo)準(zhǔn)中,雜質(zhì)對(duì)照品的使用也越來(lái)越普遍�。
與此同時(shí),對(duì)雜質(zhì)對(duì)照品的制備�、供應(yīng)等全生命周期的管理要求也越來(lái)越嚴(yán)格[79]。
我國(guó)在2016年5月施行的《化學(xué)藥品新注冊(cè)分類申報(bào)資料要求(試行)》中���,對(duì)不同注冊(cè)分類的藥品包括原料和制劑研制過(guò)程中使用的對(duì)照品(包括主成分對(duì)照品和雜質(zhì)對(duì)照品)需提供相關(guān)資料���。
對(duì)于藥典對(duì)照品,不僅需提供批號(hào)���、純度���、說(shuō)明書(shū)等詳細(xì)信息����,還要提供來(lái)源證明����;研制過(guò)程中如果使用了外購(gòu)對(duì)照品或自制對(duì)照品����,除需提供來(lái)源證明外,還需提供結(jié)構(gòu)確證����、質(zhì)量標(biāo)準(zhǔn)以及含量標(biāo)定過(guò)程等信息。
如何協(xié)調(diào)各國(guó)監(jiān)管部們對(duì)雜質(zhì)對(duì)照品的要求����,提高各類雜質(zhì)對(duì)照品的可及性是雜質(zhì)譜研究的另一關(guān)鍵點(diǎn)[80]。
采用混合雜質(zhì)對(duì)照品進(jìn)行定性[80,81]���,采用加校正因子的主成分自身對(duì)照法定量���,是解決方案之一����。當(dāng)
雜質(zhì)與主成分的校正因子在0.9~1.1�,可直接采用主成分自身對(duì)照法計(jì)算含量;當(dāng)雜質(zhì)與主成分的校正因子相差較大時(shí)����,利用校正因子消除雜質(zhì)響應(yīng)值差異對(duì)測(cè)定結(jié)果的影響。根據(jù)質(zhì)量平衡原理���,利用HPLC-DAD結(jié)合ELSD和MS分析����,可以保證校正因子測(cè)定的準(zhǔn)確性[82]����。
然而,利用定量NMR結(jié)合HPLC分析是消除校正因子測(cè)定中由雜質(zhì)對(duì)照品含量不準(zhǔn)確引入的誤差的最方便有效途徑[83]���。
3雜質(zhì)分析技術(shù)應(yīng)用進(jìn)展
藥物中的雜質(zhì)包括工藝雜質(zhì)和降解雜質(zhì)���,基于藥物的結(jié)構(gòu)、來(lái)源����、工藝等特點(diǎn)����,從整體上思考一類藥物的雜質(zhì)譜分析策略�,是雜質(zhì)譜控制的一個(gè)飛躍,對(duì)產(chǎn)品的質(zhì)量控制具有更實(shí)際的意義�。
王麗娟等[84]對(duì)二氫吡啶類藥物的雜質(zhì)來(lái)源�、檢測(cè)方法、雜質(zhì)限度以及評(píng)價(jià)標(biāo)準(zhǔn)等相關(guān)內(nèi)容進(jìn)行了綜述����;袁耀佐等[85]回顧氨基糖苷類抗生素組分/雜質(zhì)分析技術(shù)的發(fā)展歷程,討論了常見(jiàn)氨基糖苷類抗生素組分/雜質(zhì)分析方法的優(yōu)缺點(diǎn)����,進(jìn)而分析應(yīng)用液相色譜脈沖安培電化學(xué)檢測(cè)方法在氨基糖苷類抗生素組分分析的優(yōu)勢(shì),探討該類藥物未來(lái)質(zhì)控的發(fā)展方向���。
3.1 雜質(zhì)譜分析方法
如何明確藥品中的雜質(zhì)組成進(jìn)而建立適宜的分析方法是雜質(zhì)譜分析首先需要解決的問(wèn)題���。
在國(guó)內(nèi)根據(jù)特定品種在藥典標(biāo)準(zhǔn)中收載的具體雜質(zhì)結(jié)構(gòu),結(jié)合文獻(xiàn)報(bào)道結(jié)果���,對(duì)已有雜質(zhì)譜分析方法進(jìn)行改進(jìn)與優(yōu)化����,依然具有較好的實(shí)用性。
如對(duì)塞來(lái)昔布[86]����、鹽酸西那卡塞[87]、桿菌肽[88]原料藥���、克霉唑乳膏[89]和復(fù)方依折麥布瑞舒伐他汀鈣片[90]有關(guān)物質(zhì)HPLC分析方法的改進(jìn)等�。
而根據(jù)原料合成及制劑工藝的特點(diǎn)���,建立適宜的雜質(zhì)譜分析方法���,對(duì)生產(chǎn)工藝進(jìn)行評(píng)價(jià)與控制則成為新的熱點(diǎn)。
如對(duì)安塞曲匹[91]����、富馬酸沃諾拉贊[92]、呋布西林鈉[93]原料及鹽酸伐地那非口腔崩解片[94]有關(guān)物質(zhì)的分析等���。
藥物穩(wěn)定性試驗(yàn)作為確定藥物中降解雜質(zhì)的重要環(huán)節(jié)����,強(qiáng)制降解試驗(yàn)作為預(yù)測(cè)藥物長(zhǎng)期穩(wěn)定性的重要工具,可以了解藥品的可能降解途徑和降解產(chǎn)物等�,進(jìn)而指導(dǎo)建立雜質(zhì)譜分析方法[95]。
通過(guò)對(duì)穩(wěn)定性試驗(yàn)方案的合理設(shè)計(jì)���,不僅可以評(píng)價(jià)藥物處方的合理性�,確定產(chǎn)品的有效期����、復(fù)驗(yàn)期和貯存條件等�,滿足監(jiān)管的需要,且穩(wěn)定性試驗(yàn)中產(chǎn)生的降解雜質(zhì)還可以用于驗(yàn)證雜質(zhì)譜分析方法的有效性[96]�。
如通過(guò)對(duì)氨曲南穩(wěn)定性實(shí)驗(yàn)中3個(gè)新未知降解雜質(zhì)的鑒定,建立了新的雜質(zhì)控制方法[97]�。
利用強(qiáng)制降解試驗(yàn)還有助于在雜質(zhì)譜分析中對(duì)雜質(zhì)的結(jié)構(gòu)進(jìn)行確認(rèn),如利用強(qiáng)制降解試驗(yàn)分析利奈唑胺片[98]�、頭孢拉定二水合物[99]、紫杉醇及其注射液[100]的雜質(zhì)譜等���。
此外�,通過(guò)對(duì)不同廠家生產(chǎn)的注射用頭孢西丁鈉雜質(zhì)譜及雜質(zhì)降解途徑異同的分析����,并結(jié)合強(qiáng)力破壞試驗(yàn)對(duì)樣品中主要雜質(zhì)的來(lái)源和降解途徑進(jìn)行研究���,可以更全面地了解產(chǎn)品的特性,進(jìn)而完善藥品質(zhì)量標(biāo)準(zhǔn)[101]���。
在國(guó)家評(píng)價(jià)性抽驗(yàn)中���,通過(guò)對(duì)市場(chǎng)中不同企業(yè)相同產(chǎn)品的雜質(zhì)譜的系統(tǒng)比較,可以較好地掌握同品種藥品制劑中雜質(zhì)譜的組成等信息�,進(jìn)而建立理想的雜質(zhì)譜分析方法。
如對(duì)多肽類藥物醋酸奧曲肽原料及其制劑[102]����、半合成抗生素依托紅霉素片[103]與醋酸麥迪霉素顆粒劑[104]、化學(xué)藥口服制劑普伐他汀鈉及其制劑[105]����、纈沙坦膠囊[106]、非甾體抗炎藥酮咯酸氨丁三醇注射液[107]���、順鉑注射劑[108]和利多卡因氣霧劑[109]等有關(guān)物質(zhì)分析方法的建立����;而采用試驗(yàn)設(shè)計(jì)理念對(duì)復(fù)雜成分的樣品如丙酸交沙霉素進(jìn)行方法優(yōu)化,可獲得更理想的分離結(jié)果[110]����。
而對(duì)不同企業(yè)產(chǎn)品雜質(zhì)譜的比較,可用以評(píng)價(jià)產(chǎn)品質(zhì)量的差異�,揭示生產(chǎn)工藝與雜質(zhì)譜的相關(guān)性。
如對(duì)硫酸依替米星[111]���、注射用磺芐西林鈉[112]����、和注射用頭孢西丁鈉[113]等的質(zhì)量評(píng)價(jià)�。
將雜質(zhì)譜分析與生產(chǎn)過(guò)程相關(guān)聯(lián),則可以更好地理解生產(chǎn)工藝與雜質(zhì)譜的關(guān)系���,進(jìn)而實(shí)現(xiàn)精準(zhǔn)地對(duì)關(guān)鍵生產(chǎn)工藝的控制。
如阿莫西林克拉維酸鉀片劑雜質(zhì)譜分析結(jié)果揭示�,制劑過(guò)程中阿莫西林三水合物的脫水與阿莫西林閉環(huán)二聚體的產(chǎn)生呈正相關(guān)[114];頭孢拉定顆粒雜質(zhì)譜分析結(jié)果揭示�,對(duì)制粒前溫濕度的控制是工藝控制的關(guān)鍵[115];注射用鹽酸甲氯芬酯雜質(zhì)譜分析結(jié)果揭示���,雜質(zhì)A為水解雜質(zhì)���,主要由制劑冷凍干燥過(guò)程引入�,雜質(zhì)B 和雜質(zhì)C為醇解雜質(zhì)����,主要由原料藥合成工藝引入,與工藝中使用的低級(jí)醇類有關(guān)[116]���。
而注射用氨芐西林鈉氯唑西林鈉雜質(zhì)譜的差異主要與氨芐西林鈉原料的生產(chǎn)工藝有關(guān)�,冷凍干燥工藝的氨芐西林鈉原料較溶媒結(jié)晶工藝產(chǎn)品更不穩(wěn)定���,制劑更易受溫度等環(huán)境因素的影響[117]�。
選擇適宜的手性色譜柱常規(guī)HPLC方法����,對(duì)實(shí)際產(chǎn)品中的手性雜質(zhì)進(jìn)行分析,依然是藥品質(zhì)量控制的常用方法���。
如采用硅膠表面涂布直鏈淀粉-三(3����,5-二甲苯基氨基甲酸酯)為填充劑的手性色譜柱,對(duì)替格瑞洛中異構(gòu)體雜質(zhì)[118]����、枸櫞酸托法替尼原料及片劑中對(duì)映異構(gòu)體雜質(zhì)[179]的測(cè)定等。
然而采用超臨界流體色譜法對(duì)藥物中對(duì)映異構(gòu)體的分析是近年來(lái)的研究熱點(diǎn)����。
如對(duì)1,4-二氫吡啶類鈣拮抗劑(尼索地平、西尼地平�、普拉地平、阿折地平�、鹽酸馬尼地平)的手性拆分[120],對(duì)依折麥布及其R-對(duì)映體的手性拆分[121]等�。對(duì)多肽類藥物的雜質(zhì)控制研究也受到關(guān)注。
如以多肽合成中的中間體�、潛在副產(chǎn)物和降解產(chǎn)物等為研究對(duì)象,建立醋酸亮丙瑞林(一種合成的線性九肽)有關(guān)物質(zhì)分析方法[122]����;采用LC-MS分析鮭降鈣素注射液中的降解雜質(zhì)[123];采用離子色譜對(duì)糖肽類藥物中游離糖含量的分析[124]等���。
對(duì)氨基酸類、糖類和酯類等結(jié)構(gòu)相對(duì)簡(jiǎn)單且不具有UV吸收的藥物/輔料的雜質(zhì)分析研究的進(jìn)展較緩慢���,雖然有采用超臨界流體色譜質(zhì)譜聯(lián)用技術(shù)定性分析中/長(zhǎng)鏈結(jié)構(gòu)甘油三酯組成[125]的報(bào)道�,但主要研究仍采用HPLC紫外末端檢測(cè),如測(cè)定門冬氨酸鉀鎂注射液中門冬氨酸的有關(guān)物質(zhì)[126]����、鹽酸氨基葡萄糖的有關(guān)物質(zhì)[127]等;如引入新分離機(jī)制的色譜系統(tǒng)如HILIC等�,結(jié)合新型的檢測(cè)器如CAD、NQAD等����,有望促進(jìn)該領(lǐng)域的發(fā)展。
對(duì)b - 內(nèi)酰胺抗生素中聚合物的分析���,目前中國(guó)藥典收載的Sephadex-G10凝膠色譜系統(tǒng)已經(jīng)無(wú)法滿足現(xiàn)代質(zhì)控的需要�,而基于高效凝膠色譜技術(shù)方法的專屬性也越來(lái)越受到挑戰(zhàn)[128]����。
由于二維色譜技術(shù)的發(fā)展,利用柱切換技術(shù)可以方便地將凝膠色譜系統(tǒng)中的色譜峰在常規(guī)HPLC色譜系統(tǒng)中進(jìn)行定位�,結(jié)合LC-MS技術(shù)即可在雜質(zhì)分析方法中將聚合物雜質(zhì)作為特定雜質(zhì)進(jìn)行控制[128,129],這也將成為控制? -內(nèi)酰胺抗生素聚合物的發(fā)展方向���。
3.2 微量雜質(zhì)結(jié)構(gòu)解析
采用LC-MS技術(shù)對(duì)產(chǎn)品中的工藝雜質(zhì)和降解產(chǎn)物等微量成分的結(jié)構(gòu)特征進(jìn)行分析,依然是目前識(shí)別雜質(zhì)結(jié)構(gòu)的主要方法[130]���,對(duì)同系物藥物及雜質(zhì)裂解規(guī)律的探討有助于對(duì)雜質(zhì)的識(shí)別����。
王聰?shù)萚131]對(duì)7個(gè)β-受體激動(dòng)劑的電噴霧質(zhì)譜裂解規(guī)律進(jìn)行了探討�,Wang等[132]對(duì)b - 內(nèi)酰胺抗生素和其開(kāi)環(huán)物的質(zhì)譜裂解差異進(jìn)行了比較,Qian等[133]對(duì)頭孢克洛和其△3異構(gòu)體的質(zhì)譜裂解差異進(jìn)行了比較�;而NMR技術(shù)及聯(lián)用技術(shù)在雜質(zhì)定性分析中的應(yīng)用也越來(lái)越廣泛[134]。
國(guó)內(nèi)近年來(lái)在對(duì)結(jié)構(gòu)復(fù)雜且存在手性中心的未知雜質(zhì)進(jìn)行鑒別時(shí)�,普遍采用制備分離,再利用各種波譜技術(shù)對(duì)其結(jié)構(gòu)進(jìn)行推測(cè)的策略����。
如對(duì)鹽酸多西環(huán)素[135]和利福拉齊[136]雜質(zhì)等的鑒別。
而利用高分辨質(zhì)譜����,根據(jù)一級(jí)、二級(jí)質(zhì)譜裂解規(guī)律推測(cè)化學(xué)藥品中雜質(zhì)的結(jié)構(gòu)已逐漸成為主流�。
如對(duì)尼麥角林[137]、碘海醇中有關(guān)物質(zhì)O-烷基化合物和N-烷基化合物的準(zhǔn)確分子量和結(jié)構(gòu)推測(cè)[138]���,采用電噴霧離子化正負(fù)2種離子模式鑒定達(dá)比加群酯中間體[139]和瑞舒伐他汀中間體[140]中的雜質(zhì)���,采用飛行時(shí)間質(zhì)譜推測(cè)佐匹克隆[141]、鹽酸左西替利嗪片[142]中的雜質(zhì)結(jié)構(gòu)���;采用高分辨飛行時(shí)間質(zhì)譜分析氯沙坦鉀[143]和創(chuàng)新藥物艾托莫德[144]中的未知雜質(zhì)�。
二維液相色譜-質(zhì)譜聯(lián)用技術(shù)則解決了色譜流動(dòng)相不適宜直接用于質(zhì)譜分析的難題���。
如用于分析來(lái)氟米特片的雜質(zhì)譜[145]和對(duì)咪達(dá)唑侖注射液中雜質(zhì)結(jié)構(gòu)的解析[146]等����。