2020年2月�,為了支持僅以電子格式提供510(k)遞交文件的過渡,CDRH開發(fā)并試行eSTAR�。
2020年9月,CDRH將eSTAR的使用范圍擴(kuò)大到所有未遞交組合產(chǎn)品的510(k)遞交者�。隨后,2021年9月���,F(xiàn)DA發(fā)布了一份電子遞交模板指南草案。
2022年7月,F(xiàn)DA推行以電子方式上傳由CDRH主導(dǎo)的510(k)和De Novo的eSTAR和eCopy格式的上市前醫(yī)療器械遞交文件���,以最終取代制作包含eSTAR或eCopy文件的任何光盤(CD)���、數(shù)字視頻光盤(DVD)或閃存驅(qū)動器并將其郵寄給FDA的需求。自2022年7月18日起�,客戶協(xié)作門戶網(wǎng)站的進(jìn)度跟蹤器的現(xiàn)有用戶(如510(k)遞交的官方通訊員)可以試用這個新的電子遞交方式,并向FDA提供有關(guān)該工具的關(guān)鍵用戶反饋�。
2022年9月22日,F(xiàn)DA發(fā)布了最終指南�����,即Electronic Submission Template for Medical Device 510(k) Submissions�����,指南指出�����,自2023年10月1日起�����,所有510(k) 遞交文件,除非獲得豁免�,否則必須使用eSTAR電子文檔形式遞交。
也就是說�,F(xiàn)DA對于在2023年10月1日之前收到的510(k) 遞交文件,F(xiàn)DA接受通過以下兩種方式之一遞交eCopy或eSTAR格式的510(k) 遞交文件:
*線下快遞郵寄:保存在電子存儲介質(zhì)中并郵寄給FDA���;或
*線上發(fā)送電子版510(k)文檔�����;
但是2023年10月1日之后�,只能使用線上eSTAR電子方式遞交510(k)���。
2022年10月3日�,F(xiàn)DA宣布可以通過CDRH客戶協(xié)作門戶("CDRH Portal")在線發(fā)送eCopy或eSTAR上市前遞交文檔�,即允許任何人通過注冊一個CDRH Portal的賬號來線上發(fā)送CDRH eCopy或eSTAR。
eSTAR是什么呢�?
eSTAR的英文全稱是electronic Submission Template And Resource,它是構(gòu)建在結(jié)構(gòu)化動態(tài)PDF中的電子提交模板���,它將510(k)遞交內(nèi)容都自動化嵌入到一個PDF文檔中�����,并包含從IMDRF文件以及監(jiān)管文件(如指南)中提取的監(jiān)管信息�。它可以指導(dǎo)準(zhǔn)備510(k)遞交文檔���,申請人在建立�����、查看和編輯510(k)時可以使用更多動態(tài)功能�����,能夠組織很復(fù)雜的信息�����。
eSTAR是目前唯一一種電子提交模板�。為了簡單起見�,使用此電子遞交模板創(chuàng)建的電子遞交通常被稱為eSTAR。
eSTAR旨在通過幫助確保提交者為CDRH的上市前審查提供高質(zhì)量���、全面的數(shù)據(jù)�����,提高各種醫(yī)療器械的提交質(zhì)量���。通過標(biāo)準(zhǔn)化的格式�����,提交者可以確保其提交內(nèi)容完整�����,CDRH可以更有效地進(jìn)行上市前審查�,以幫助及時獲得安全���、有效和高質(zhì)量的醫(yī)療器械���。
eSTAR 電子遞交的特點有哪些?
1. 界面直觀�����;
2. 無需安裝特殊軟件���;
3. 支持圖像和動態(tài)信息�����;
4. 支持移動設(shè)備和iOS系統(tǒng)�����;
5. 遞交內(nèi)容結(jié)構(gòu)具有指導(dǎo)性�����;
6. 可以自動驗證���,不需進(jìn)行RTA,但是這取決于對每項內(nèi)容的準(zhǔn)確答復(fù)�����,F(xiàn)DA會驗證答復(fù)的準(zhǔn)確性���,回答不準(zhǔn)確可能會導(dǎo)致遞交審核提前暫停�����,即���,如果問題的任何附件都與問題無關(guān)�,或者如果對任何問題的答復(fù)不準(zhǔn)確���,則遞交文件可能會提前進(jìn)行技術(shù)審查�����,要求糾正這些不足之處�����;
7. eSTAR PDF不需要遵守eCopy指南文件�����,也不需要壓縮并放在MISC FILES文件夾中�,但是���,與eSTAR PDF一起提供的任何其他文件都需要遵守eCopy指南文件�����;
8. eSTAR無需提供的IFU聲明(FDA 3881表格)�、上市前審查遞交封面(FDA 3514表格)或符合性聲明(如適用),因為所有這些都內(nèi)置在eSTAR PDF中�。此外,如果您選擇使用eSTAR創(chuàng)建510(k) Summary�,則無需在eSTAR中提供額外的510(k) Summary。
目前有哪些遞交類型支持eSTAR電子遞交�?
醫(yī)療器械和體外診斷醫(yī)療器械的510(k) 和 Novo遞交,支持eSTAR電子遞交���。
如何使用eSTAR準(zhǔn)備遞交文檔���?
1. 下載正確的eSTAR PDF模板并保存�����,然后在Adobe Acrobat Pro中打開它�。
2. 閱讀、理解并遵循eSTAR PDF模板的Introduction, Key, FAQ, 以及 Version History部分中的說明�����。
3. 相應(yīng)地填寫模板�����。該模板僅用于構(gòu)建而不是提交您的遞交文檔。模板末尾的說明提供了如何提交的說明�。
請注意:如果eSTAR PDF的大小超過1 GB,則提交的處理可能會延遲�����;如果可能���,請合并類似內(nèi)容的附件(例如���,軟件需求規(guī)范),以便僅需要為eSTAR中的每個附件類型問題提供一個附件�����。
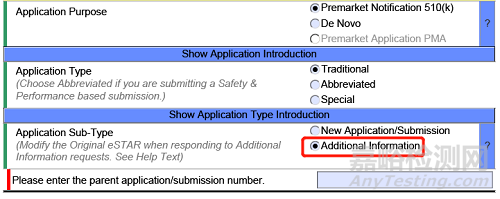
如何遞交對AI請求的回復(fù)文件�����?
修改您的原始eSTAR�����,并在eSTAR的“申請/遞交類型”部分指出,申請子類型是對AI請求的回復(fù)���。在您表示打算對FDA的AI請求作出回復(fù)后�,eSTAR末尾將出現(xiàn)一個附加部分�,您可以在該部分對AI請求進(jìn)行回復(fù)。

510(k) 遞交�����、審核過程中豁免eSTAR情形有哪些���?
目前���,F(xiàn)DA豁免以下510(k)遞交文件/信息的510(k)電子提交要求:
※交互式審查答復(fù);
※修正:
· 監(jiān)督審查的上訴/請求�����;
· 實質(zhì)性簡要請求�����;
· 相應(yīng)修正的變更�;和
· 最終決定后的修改(即,add-to-files)�。
備注:如果FDA審核員通過電話或電子郵件進(jìn)行交互式審核,遞交者應(yīng)通過電子郵件向?qū)徍藛T回復(fù)所需附件和附加信息�。對AI請求的其他回復(fù)必須以eSTAR提交,應(yīng)在eSTAR的相應(yīng)章節(jié)中包含F(xiàn)DA審查信息的實際變更(例如�,Labeling章節(jié)中應(yīng)包含更新的labeling草稿)。
與eSTAR提交相關(guān)的MDUFA用戶費用是多少�?
eSTAR遞交與遞交類型相關(guān)聯(lián),具體用戶費用�,請見之前的微信文章:
美國FDA評審費漲幅56%,小企業(yè)助力節(jié)省75%
如何線上遞交eSTAR文檔�����?
通過CDRH客戶協(xié)作門戶("CDRH Portal")在線發(fā)送eSTAR上市前遞交文檔���,需先注冊一個客戶協(xié)作門戶的賬戶�,即CCP賬戶�,網(wǎng)址如下:
https://www.fda.gov/medical-devices/industry-medical-devices/send-and-track-medical-device-premarket-submissions-online-cdrh-portal
如何線下快遞郵寄遞交eSTAR文檔?
通過郵寄快遞�,向CDRH文件控制中心(DCC)提交eSTAR:
目前DCC郵寄地址如下:
eSTAR審查時長是多久?
在FDA收到eSTAR遞交文件后�,盡管eSTAR不會有RTA過程,但是FDA會對eSTAR進(jìn)行病毒掃描和技術(shù)篩查(預(yù)計在收到510(k) eSTAR后15天內(nèi)進(jìn)行)�。
如果遞交的eSTAR不完整�,F(xiàn)DA將通過電子郵件通知遞交者�,并告知不完整的信息,遞交文件將被擱置180天或直到向FDA遞交完整的替代eSTAR�。
以上就是FDA eSTAR---醫(yī)療器械510(k)電子提交的具體要求