我國兒童用藥需求大,但目前市場上兒童用藥種類少����、劑型少����,企業(yè)也缺乏研發(fā)熱情�,針對以上問題��,政府有關(guān)部門推出一系列政策措施����,旨在加快兒童用藥上市�,保障兒童用藥供給��。本文首先梳理了近年來我國兒童用藥審評審批政策����,對近 6 年兒童用藥優(yōu)先審評審批通過數(shù)量及其比例進(jìn)行統(tǒng)計(jì)分析,以考察政策成效; 其次��,對比分析了美國����、歐盟�、日本兒童用藥的審評審批政策; 最后����,提出我國兒童用藥審評審批未來改革方向�。分析結(jié)果表明�,雖然我國兒童用藥發(fā)展起步較晚�,但可以借鑒國外有益的經(jīng)驗(yàn)�、做法,不斷完善兒童用藥審評審批相關(guān)政策法規(guī)��,簡化審評審批流程�,成立兒童用藥專門審評部門��,以加快兒童用藥上市�,提高兒童用藥可及性。
一�、我國兒童用藥現(xiàn)狀
中國第七次人口普查數(shù)據(jù)顯示: 0 ~ 14 歲兒童數(shù)量約為 2. 5 億元����,占全國總?cè)丝诘?17. 97% ��。根據(jù)2021 年我國發(fā)布的《2020 中國衛(wèi)生健康統(tǒng)計(jì)年鑒》中所發(fā)布的數(shù)據(jù)����,2018 年 0 ~ 14 歲兒童兩周就診率達(dá)到 36. 7% �,住院率達(dá) 16. 8% ��,兩周患病率 36. 1% ;2019 年兒童醫(yī)院入院人數(shù)達(dá)到 226 萬��,病床使用率達(dá)到 94. 12%[1]��。以上數(shù)據(jù)可見 0 ~ 14 歲的兒童對醫(yī)藥資源的需求非常大�,我國的兒童用藥卻少之又少����,很多藥物沒有專門的兒童劑量��,超說明書使用頻繁�,用藥時(shí)按兒童患者的體重自行計(jì)算比例��,將藥物分成幾份服用。這樣的做法存在安全隱患�,給服用藥物的兒童患者帶來不良反應(yīng)后果�。
兒童用藥目前的主要問題有: 企業(yè)研發(fā)熱情低,兒童患者數(shù)量遠(yuǎn)少于廣大的成年人群體��,研發(fā)兒童用藥所能獲得的利潤較少; 臨床試驗(yàn)難以開展,兒童由于本身生理特征不穩(wěn)定����、差異性高,造成臨床試驗(yàn)開展困難; 藥品規(guī)格少�、劑型單一; 國內(nèi)目前兒童用藥劑型與成人無異�,而國外在這方面發(fā)展較為快速��,擁有較多選擇范圍的劑型以及規(guī)格; 說明書在關(guān)于兒童用藥方面不規(guī)范����,部分說明書寫明不建議兒童使用或兒童請?jiān)卺t(yī)師監(jiān)護(hù)下使用����,大部分說明書則表明酌情減少劑量等�。為改善以上我國兒童用藥的主要問題����,我國已發(fā)布了一系列的政策促進(jìn)兒童合理用藥以及兒童用藥物的可及性�。
二�、兒童用藥審評審批政策梳理與評價(jià)
加快審評審批為政府激勵(lì)企業(yè)研制和生產(chǎn)兒童用藥的有效手段之一�。政府就關(guān)于加快兒童用藥物審評審批出臺了一系列的政策。2013 年原國家食品藥品監(jiān)督管理局發(fā)布《關(guān)于深化藥品審評審批改革進(jìn)一步鼓勵(lì)創(chuàng)新的意見》[2]�,提出鼓勵(lì)企業(yè)積極研發(fā)兒童專用劑型和規(guī)格����,對立題依據(jù)充分且具有臨床試驗(yàn)數(shù)據(jù)支持的注冊申請,給予加快審評����。2014 年原國家衛(wèi)計(jì)委發(fā)布《關(guān)于保障兒童用藥的若干意見》提出針對國外已上市使用但國內(nèi)缺乏且臨床急需的兒童適宜品種�、劑型、規(guī)格�,加快申報(bào)審評進(jìn)度[3]��。2015年國務(wù)院發(fā)布《國務(wù)院關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》提出,加快審評審批轉(zhuǎn)移到境內(nèi)生產(chǎn)的創(chuàng)新藥和兒童用藥[4]; 原國家食品藥品監(jiān)督管理局發(fā)布《關(guān)于藥品注冊審評審批若干政策的公告》明確提出����,兒童用藥注冊申請實(shí)行單獨(dú)排隊(duì),加快審評審批[5]����。2016 年為貫徹落實(shí)《關(guān)于藥品注冊審評審批若干政策的公告》�,國家藥品監(jiān)督管理局藥品審評中心制定了《臨床急需兒童用藥申請優(yōu)先審評審批品種評定的基本原則》和首批優(yōu)先審評審批的兒童用藥注冊申請品種目錄[6]����?���;驹瓌t指出�,新增用于兒童人群品種、改劑型或新增兒童適用規(guī)格品種��、目前市場短缺的兒童用仿制藥品,可以申請優(yōu)先審評審批程序��。2016 年我國相關(guān)部門聯(lián)合印發(fā)《首批鼓勵(lì)研發(fā)申報(bào)兒童藥品清單》��,大部分藥品為國外已上市但國內(nèi)還缺乏的藥品�,有關(guān)部門對《清單》中所涉及的藥品給予一定的傾斜政策����,建立專門的審批通道[7]��。2017 年發(fā)布《關(guān)于鼓勵(lì)藥品創(chuàng)新實(shí)行優(yōu)先審評審批的意見》,將具有明顯臨床優(yōu)勢的兒童用藥納入優(yōu)先審評審批范圍[8]��。2019 年 12 月 1 日國家開始實(shí)施新《藥品管理法》[9],設(shè)專門兒童用藥品條款�,鼓勵(lì)兒童用藥品的研制和創(chuàng)新,支持開發(fā)符合兒童生理特征的兒童用藥品新品種��、劑型和規(guī)格,對兒童用藥品予以優(yōu)先審評審批�。2021 年發(fā)布《中國兒童發(fā)展綱要( 2021—2030 年) 》提出了加快兒童用藥申報(bào)審批工作��,探索制定國家兒童基本藥物目錄[10]�。
我國醫(yī)藥行業(yè)迅速發(fā)展,每年都有大量的藥品流向市場��,但兒童用藥物的臨床需求卻一直得不到滿足。在這種供需失衡下迫使我國的制度從關(guān)注藥品結(jié)構(gòu)轉(zhuǎn)向臨床需求進(jìn)行改革[11]��。我國自 2013 年首次提出優(yōu)先審評審批����,到 2017 年正式開展優(yōu)先審評審批程序����,并將兒童用藥納入優(yōu)先審評審批范圍中�。在優(yōu)先審評審批制度下��,可以加快兒童用藥上市時(shí)間��,大幅度滿足臨床用藥需求: 2020 年國家藥監(jiān)局共批準(zhǔn)兒童專用藥和增加兒童應(yīng)用的藥品 26 個(gè),2021年兒童用藥研發(fā)和審評審批繼續(xù)保持增長勢頭��,共有47 個(gè)兒童用藥品得到批準(zhǔn)�,相比 2020 年增長近 2倍。此外�,我國還積極發(fā)布系列指導(dǎo)原則����,從 2014 年至 2021 年底,藥品審評中心共發(fā)布指導(dǎo)原則 12 份����,更好地引導(dǎo)企業(yè)進(jìn)行兒童用藥的研發(fā)��。
三、兒童用藥審評審批政策創(chuàng)新成效
3. 1 兒童用藥通過優(yōu)先審評審批數(shù)量
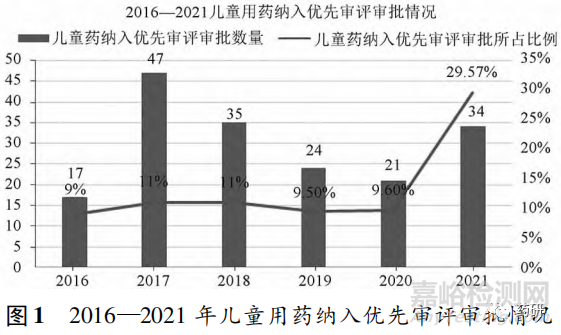
2016—2021 年兒童用藥納入優(yōu)先審評審批的情況見圖 1�,數(shù)據(jù)來源于國家藥品監(jiān)督管理局藥品審評中心��。從兒童用藥納入優(yōu)先審評審批數(shù)量可以看出,2017 年共有 47 個(gè)兒童用藥納入優(yōu)先審評審批��,為近6 年中納入數(shù)量最多的 1 年,但所占比例沒有明顯上升����。結(jié)合當(dāng)時(shí)的審批環(huán)境��,在特殊審批制度實(shí)施后,審評速度并沒有得到提升�,大量的藥品注冊申請積壓��,不能得到及時(shí)審批��。2016 年發(fā)布政策《關(guān)于解決藥品注冊申請積壓實(shí)行優(yōu)先審評審批的意見》,提出了優(yōu)先審評審批程序�,自納入優(yōu)先審評審批起�,可以繞開積壓排隊(duì),直接進(jìn)入審批程序[12]��。截至 2017 年7 月,藥 品 注 冊 積 壓 量 已 經(jīng) 從 2015 年 的 高 峰22 000 件降至 6 000 件�,在 2018 年年底降至3 440件��,基本解決了藥品注冊積壓問題。2021 年兒童用藥納入優(yōu)先審評審批數(shù)量相對 2020 年增加 13 件��,所占同年納入優(yōu)先審評審批藥品數(shù)量的比例為 29. 57% ����,遠(yuǎn)高于前 5 年所占比例����,可以看出我國藥品審評機(jī)構(gòu)正將優(yōu)先審評資源向兒童用藥注冊傾斜,根據(jù)年度報(bào)告所示�,審評中心還在審評系統(tǒng)中設(shè)立“兒童用藥”特殊標(biāo)識��,優(yōu)化審評資源配置��,設(shè)置專人對接程序����,加快兒童用藥上市����。
3. 2納入優(yōu)先審評審批兒童用藥獲批上市數(shù)量
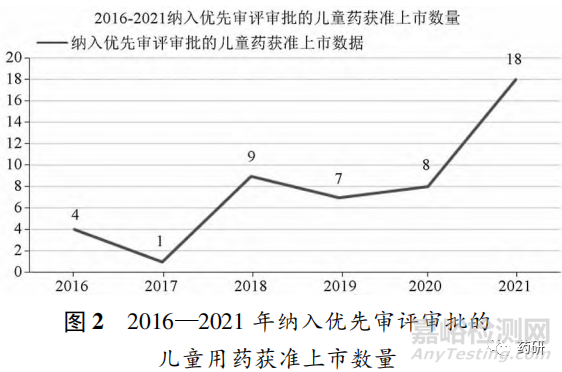
圖 2 為 2016—2021 年納入優(yōu)先審評審批的兒童用藥獲批上市的數(shù)量�,整體趨勢呈上升狀態(tài)����,2017 年僅 1 件藥品獲批上市��,2021 年兒童用藥獲準(zhǔn)上市的數(shù)量最多,為 18 件����。2021 年兒童用藥獲批數(shù)量成倍增加����,初步判斷原因主要為審評中心政策傾斜����,且兒童用藥研發(fā)企業(yè)感受到了切實(shí)的傾向政策,加大對兒童用藥的研發(fā)����,增加注冊數(shù)量。獲準(zhǔn)上市的兒童用藥涉及范圍廣泛����,既有臨床常用的維生素注射液同時(shí)也有治療 C 型尼曼匹克病的孤兒藥�,麥格司他膠囊����,可以盡可能的滿足不同需求的用藥兒童人群����。
四��、國際兒童用藥審評審批相關(guān)政策
4. 1美國兒童用藥審評審批政策
1997 年��,美國 FDA 出臺了第一部關(guān)于兒童用藥的法案《FDA 現(xiàn)代化法案》( FDA Modernization Act) ,鼓勵(lì)企業(yè)進(jìn)行兒童用藥的研發(fā)����。2002 年,美國 FDA發(fā)布《兒童最佳藥品法》( Best Pharmaceuticals forChildren Act�,BPCA) 和《兒科研究公平法》( PediatricResearch Equity Act����,PREA) ����,這兩項(xiàng)法案相輔相成����,形成了美國兒童用藥法律的基本框架�。BPCA 引入了兒科市場獨(dú)占權(quán),規(guī)定開展兒童臨床研究的企業(yè)可以享受 6 個(gè)月的市場獨(dú)占權(quán)�,該獨(dú)占期可以理解為對原有專利權(quán)的延長保護(hù); PREA 則規(guī)定了企業(yè)在申請兒童用藥上市前����,必須開展臨床試驗(yàn)�,并將實(shí)驗(yàn)結(jié)果體現(xiàn)在藥品說明書中[13]�。BPCA 和 PREA 法案既有切實(shí)激勵(lì)企業(yè)開展兒童用藥臨床試驗(yàn)的政策�,同時(shí)又規(guī)定了申報(bào)兒童用藥注冊程序時(shí)所應(yīng)承擔(dān)的義務(wù)����。以上 BPCA 和 PREA 法案實(shí)施至今,不僅促進(jìn)了兒童用藥臨床試驗(yàn)的開展����,藥品說明書中有關(guān)兒童用藥的部分信息也逐步增加��,增加了美國兒童用藥審評審批的品種[14]��。
4. 2歐盟兒童用藥審評審批政策
歐盟于 2006 年正式發(fā)布了《兒科藥品管理?xiàng)l例》�,并由此為基礎(chǔ)構(gòu)建起歐盟兒童用藥審評架構(gòu);2007 年設(shè)立兒科委員會(huì)( PDCO) ,評估并審批兒科調(diào)查計(jì)劃( PIP) ����,企業(yè)想要兒童用藥品獲得上市許可就需提交 PIP 計(jì)劃�,并按照計(jì)劃開展臨床研究。政府可以通過 PIP 獲得關(guān)于該藥品在兒科中使用的信息的存在和符合性[15]; 2008 年建立兒童科研網(wǎng)絡(luò)����,促進(jìn)交流合作,降低重復(fù)研究����,教育和鼓勵(lì)父母與兒童參與臨床研究�,并協(xié)助倫理委員會(huì)解決相關(guān)問題��。歐盟對于積極開展兒童用藥臨床研究并滿足申請條件的企業(yè)�,共有三種不同的激勵(lì)政策: 兒童用藥通過 PIP計(jì)劃并獲得相關(guān)臨床數(shù)據(jù)����,可以得到一年市場保護(hù)期或 6 個(gè)月的專利延長期; 兒童罕見病相關(guān)的藥品通過PIP 計(jì)劃��,可以獲得 2 年的市場獨(dú)占期; 專利保護(hù)期或補(bǔ)充保護(hù)期外的藥品��,如果獲得兒科應(yīng)用上市許可( PUMA) ,可以獲得 10 年的市場保護(hù)[16]�。歐盟還出臺了一系列指導(dǎo)兒童用藥的研發(fā)指南����,指導(dǎo)企業(yè)更好的研發(fā)兒童用藥�。目前歐盟兒童用藥的用藥情況已產(chǎn)生了積極影響����,臨床信息得到進(jìn)一步的豐富����。
4. 3日本兒童用藥審評審批政策
日本目前并未出臺像美國�、歐盟那樣的專門法案用于促進(jìn)對兒童用藥的研發(fā)��,目前��,日本的藥品研發(fā)法案使用的依舊是《藥事法》( PAL) 。1999 年發(fā)布相關(guān)文件簡化兒童用藥審批程序: 如醫(yī)療必需且為學(xué)會(huì)要求的����,可基于臨床試驗(yàn)的結(jié)果,使用補(bǔ)充申請的方式�,增加適應(yīng)證�。臨床急需但未經(jīng)批準(zhǔn)的兒童用藥,對已在法國��、德國��、英國和美國等指定國家中任意廣泛使用�,可以豁免臨床試驗(yàn); 日本厚生勞動(dòng)省通過提高兒童用藥價(jià)格����,以此為方法激勵(lì)企業(yè)研發(fā)兒童用藥����,兒童用藥價(jià)格加算幅度在 5% ~ 20% ,方式分為兒童新 藥 初 次 定 價(jià) 補(bǔ) 正 和 目 錄 內(nèi) 新增兒童適應(yīng)證[17]��。此外��,日本還建立了兒童用藥實(shí)驗(yàn)網(wǎng)絡(luò)��,并成立了專門的兒童藥品工作小組����,加強(qiáng)各界的聯(lián)系��,加快兒童用藥的研發(fā)和上市。
五�、我國兒童用藥審評審批政策未來改革方向
5. 1完善相關(guān)政策
近年來我國關(guān)于兒童用藥的法律法規(guī)發(fā)布已有明顯的改善����。但還可以進(jìn)一步完善相關(guān)政策����,針對目前存在的一些問題�,動(dòng)態(tài)調(diào)整兒童藥品清單,將臨床急需�、價(jià)格適宜的兒童用藥及時(shí)納入基本藥物目錄和醫(yī)保目錄中��,加強(qiáng)兒童用藥品研發(fā)、審評審批��、標(biāo)簽�、說明書等方面的指導(dǎo)原則發(fā)布。
5. 2簡化審評審批流程
日本雖未出臺專門的兒童用藥法律法規(guī)����,但也在加快兒童用藥方面做了很多積極的調(diào)整����,如優(yōu)化審評審批流程��,可以使用補(bǔ)充申請的方式增加新適應(yīng)證; 在國外已長時(shí)間大量使用的兒童用藥�,臨床數(shù)據(jù)可以推至日本兒童身上,則可申請豁免臨床試驗(yàn)�。這樣既可以減少重復(fù)兒童臨床試驗(yàn)����,又可以加快國外兒童用藥進(jìn)入日本市場����。鑒于我國目前研發(fā)能力不足�,兒童臨床試驗(yàn)開展較少,可以對國外已上市��、且安全性良好的兒童用藥�,減免臨床試驗(yàn)����,優(yōu)化審評審批流程��,加快上市��,同時(shí)加強(qiáng)上市后監(jiān)測和不良反應(yīng)檢測。
5. 3成立兒童用藥審評部門
歐盟����、美國皆建立了兒童用藥相關(guān)審評咨詢部門��,負(fù)責(zé)提供兒童用藥審評審批政策咨詢服務(wù)��、宣傳工作、參與兒童用藥相關(guān)政策的制定�、更新兒童藥品清單等��。建議我國建立相關(guān)部門,成立兒童用藥專家小組����,內(nèi)部可以向各省審評部門提供審評審批指導(dǎo)����,外部向積極開展兒童用藥研發(fā)����、注冊的企業(yè)提供相關(guān)政策建議; 同時(shí)宣傳�、鼓勵(lì)家長和兒童參與兒童用藥臨床研究; 并設(shè)置專門的基金項(xiàng)目��,鼓勵(lì)企業(yè)對非專利兒童用藥的開發(fā)��。
綜上,促進(jìn)兒童用藥可及性是我國政府正不斷推進(jìn)的目標(biāo)之一�。我國兒童使用藥品的不良反應(yīng)發(fā)生率從 2016 年的 10. 6% 到 2021 年的 8. 4% �,已有逐步減少的趨勢,這和近兩年來政府�、企業(yè)的不斷努力是分不開的��。我國兒童用藥起步較晚����,仍可從國外的政策中取其精華����,對我國兒童用藥審評審批政策進(jìn)行不斷改革,為我國兒童健康不斷努力��。