2 0 0 0 年起, 歐盟著手對經(jīng)分散審批程序(DCP)和互認(rèn)審批程序(MRP)的藥品質(zhì)量狀況進(jìn)行市場監(jiān)督抽檢���。該抽檢計劃最初由歐盟官方檢驗實驗室主要協(xié)作網(wǎng)(GEON)自發(fā)組織����,經(jīng)過多年實踐����,逐步形成了以歐洲藥品質(zhì)量管理局(EDQM)為核心的過程管理體系,以歐盟醫(yī)藥管理局首腦協(xié)作組(HMA)為核心的風(fēng)險管控路徑���,有效促進(jìn)了各成員國檢驗與執(zhí)法體系的互聯(lián)共享����。截至2021年�,歐盟共完成抽檢DCP/MRP品種14500余個。作為集中審批藥品(CAPs)抽檢的重要補(bǔ)充���,DCP/MRP藥品市場監(jiān)督抽檢旨在對歐盟全境DCP/MRP藥品質(zhì)量進(jìn)行風(fēng)險監(jiān)測����,與我國省級藥品抽檢功能定位相似����。因此,研究DCP/MRP藥品市場監(jiān)督抽檢策略�,對進(jìn)一步完善我國省級藥品抽檢管理機(jī)制,探索國抽與省抽統(tǒng)籌管理模式�,具有一定借鑒意義���。
一���、法規(guī)框架
歐盟議會和理事會頒布的相關(guān)指令,是DCP/MRP藥品市場監(jiān)督抽檢的主體法規(guī)框架�。其中���,《關(guān)于人用藥品的歐盟法典》和《獸用藥品歐盟法典》�,要求各成員國藥品監(jiān)管部門對上市后藥品質(zhì)量進(jìn)行監(jiān)督檢查���;同時,規(guī)定各級官方檢驗實驗室(OMCL)建立協(xié)調(diào)網(wǎng)絡(luò)����,確保檢驗結(jié)果共享互認(rèn)。在此基礎(chǔ)上����,歐盟逐步確立了DCP/MRP藥品市場監(jiān)督抽檢機(jī)制?���;谥黧w法規(guī)框架要求,歐盟制定了DCP/MRP藥品市場監(jiān)督抽檢的管理程序���。一是《DCP/MRP藥品市場監(jiān)督抽檢協(xié)作規(guī)范》���,介紹了DCP/MRP藥品市場監(jiān)督抽檢工作原則、主要流程����,以及組織管理框架���。二是《基于風(fēng)險的市場監(jiān)督檢驗網(wǎng)絡(luò)協(xié)作規(guī)范》���,對上市后藥品的質(zhì)量風(fēng)險來源進(jìn)行分類,并提出了基于GEON的抽樣與檢驗風(fēng)險管理策略���。三是《打擊藥品犯罪協(xié)定》與《藥品質(zhì)量安全犯罪與假劣藥品處置合作規(guī)范》����,建立了各成員國協(xié)同防控質(zhì)量風(fēng)險的管理機(jī)制���。為保證檢驗結(jié)果的有效互認(rèn)與準(zhǔn)確性�,歐盟還要求承檢實驗室應(yīng)符合官方實驗室質(zhì)量管理體系規(guī)范����,并制定了相應(yīng)的質(zhì)量管理指南���。
二���、組織結(jié)構(gòu)與抽檢過程管理
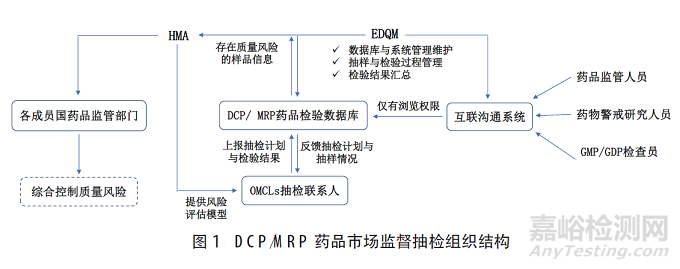
DCP/MRP藥品市場監(jiān)督抽檢以EDQM和HMA為核心,基于DCP/MRP藥品檢驗數(shù)據(jù)庫(以下簡稱數(shù)據(jù)庫)和互聯(lián)溝通系統(tǒng)(CTS)進(jìn)行(圖1)。其中�,EDQM作為DCP/MRP藥品市場監(jiān)督抽檢秘書處,主要負(fù)責(zé)數(shù)據(jù)庫的管理維護(hù)����、抽樣與檢驗過程管理����、檢驗結(jié)果匯總。HMA作為各成員國藥品管理部門的綜合協(xié)作組織�,主要負(fù)責(zé)對發(fā)現(xiàn)的質(zhì)量風(fēng)險進(jìn)行綜合防控����。數(shù)據(jù)庫為抽檢計劃與數(shù)據(jù)管理的主要平臺����,主要提供抽檢計劃與數(shù)據(jù)儲存����、質(zhì)量風(fēng)險信息匯總報送�,以及在線制圖與數(shù)據(jù)統(tǒng)計功能�。在使用權(quán)限方面,主要分為兩級����,各承檢的官方檢驗實驗室具有1級權(quán)限����,可直接對數(shù)據(jù)進(jìn)行報送修改;各成員國藥品監(jiān)管人員���、藥物警戒研究人員�、GMP/GDP檢查員等具有CTS訪問權(quán)限的用戶具有2級權(quán)限����,只能對數(shù)據(jù)進(jìn)行瀏覽。此外����,EDQM要求各承檢OMCLs設(shè)置抽檢聯(lián)系人����,以“點對點的方式”通過數(shù)據(jù)庫報送抽檢計劃與檢驗結(jié)果。
三�、風(fēng)險處置與轉(zhuǎn)化應(yīng)用
對于抽檢發(fā)現(xiàn)的一般性技術(shù)與方法學(xué)問題���,OMCLs通過檢驗協(xié)作網(wǎng)絡(luò)或DCP/MRP審評的組織協(xié)調(diào)機(jī)構(gòu)—人用與獸用藥品分散與互認(rèn)審批協(xié)作組(CMDh/CMDv),反饋給參與該品種審評的藥品管理機(jī)構(gòu);對于發(fā)現(xiàn)的標(biāo)準(zhǔn)問題�,則發(fā)送給EDQM下設(shè)的標(biāo)準(zhǔn)管理部門。
針對檢出的假劣藥品���,各成員國按照《藥品質(zhì)量安全犯罪與假劣藥品處置合作規(guī)范》����,建立由藥品管理部門、警察執(zhí)法部門���、司法機(jī)關(guān)組成的單點聯(lián)系工作組(SPOCs)。工作組中每個部門都應(yīng)設(shè)置一位決策聯(lián)系人����,定期組織聯(lián)系會議、協(xié)同處置假劣藥品����。決策聯(lián)系人應(yīng)當(dāng)具有醫(yī)藥相關(guān)專業(yè)背景和資深管理執(zhí)法經(jīng)驗。對于涉及多個國家的風(fēng)險品種����,各成員國通過HMA執(zhí)法人員工作組(WGEO)進(jìn)行綜合協(xié)調(diào)����,并以SPOCs的方式設(shè)置國際協(xié)調(diào)聯(lián)系人���,進(jìn)行聯(lián)合執(zhí)法����、制定風(fēng)險控制措施(圖2)����。
隨著抽檢數(shù)據(jù)與風(fēng)險信號的積累,基于發(fā)現(xiàn)的問題�,GEON分別對特定品種進(jìn)行市場監(jiān)測研究(MSS)與潛在假劣藥品市場監(jiān)測研究(MSSIP),促進(jìn)抽檢研究結(jié)果進(jìn)一步轉(zhuǎn)化���。其中����,MSS主要選取在歐盟不同成員國可能出現(xiàn)質(zhì)量差異的品種進(jìn)行比較分析�,并將提升行業(yè)標(biāo)準(zhǔn)的建議反饋至EDQM標(biāo)準(zhǔn)管理部門����。總結(jié)近5年EDQM年度報告�,除2020年受疫情影響外�,完成MSS的數(shù)量基本在2項以上���,提示抽檢研究成果轉(zhuǎn)化鏈條較為穩(wěn)定���,形成了良性反饋與循環(huán)�。
2 0 1 2 年����,基于《打擊藥品犯罪協(xié)定》�,歐盟各成員國OMCLs通過GEON組織MSSIP專項研究���,旨在充分評估疑似存在假劣藥品的供應(yīng)鏈風(fēng)險狀況���。截至2022年,各成員國OMCLs共完成5項研究���,分別涉及合成代謝類固醇、勃起功能障礙治療藥物���、減肥藥品以及未被WHO統(tǒng)一命名的藥物活性成分(“non-INN”APIs)。與MSS不同的是�,MSSIP的樣品來源范圍更廣。在由各成員國OMCLs或藥品管理部門直接抽取樣品的基礎(chǔ)上,MSSIP還接受來自醫(yī)生���、患者以及執(zhí)法機(jī)關(guān)認(rèn)為存在質(zhì)量風(fēng)險的樣品。隨機(jī)抽樣與靶向收樣相結(jié)合的研究模式���,有助于最大范圍收集風(fēng)險信號,更為系統(tǒng)全面地評估供應(yīng)鏈安全狀況����。
四、評價與思考
法規(guī)體系:基于管理通則�,實現(xiàn)了CAPs年度抽檢與DCP/MRP藥品市場監(jiān)督抽檢風(fēng)險管理體系的有機(jī)統(tǒng)籌依托《關(guān)于人用藥品的歐盟法典》與《獸用藥品歐盟法典》這一法規(guī)基礎(chǔ)���,歐盟DCP/MRP藥品市場監(jiān)督抽檢相關(guān)的制度體系主要可分為四個方面:一是過程管理規(guī)范,《DCP/MRP藥品市場監(jiān)督抽檢協(xié)作規(guī)范》介紹了DCP/MRP藥品市場監(jiān)督抽檢的工作原則與組織框架���,并對計劃制定、樣品抽取����、檢驗結(jié)果評估與反饋等方面,提出了總體性的指導(dǎo)要求���;二是風(fēng)險管理通則�,EDQM通過制定《基于風(fēng)險的市場監(jiān)督檢驗網(wǎng)絡(luò)協(xié)作規(guī)范》���,對境內(nèi)上市后的CAPs與DCP/MRP藥品質(zhì)量風(fēng)險進(jìn)行統(tǒng)一歸納����、分類,在對GEON提出抽樣與檢驗風(fēng)險管理策略的基礎(chǔ)上���,也為HMA組織制定品種遴選風(fēng)險評估模型�,實現(xiàn)CAPs年度抽檢與DCP/MRP藥品市場監(jiān)督抽檢風(fēng)險管理體系的有機(jī)統(tǒng)一����,提供制度基礎(chǔ)與管理建議����;三是假劣藥品處置要求����,歐盟于2008年制定《藥品質(zhì)量安全犯罪與假劣藥品處置合作規(guī)范》����,并在2010年簽署了《打擊藥品犯罪協(xié)定》���,提出了綜合防控假劣藥品風(fēng)險的主體要求�,為建立橫跨多個國家、多個部門的執(zhí)法協(xié)調(diào)機(jī)制提供了制度基礎(chǔ)���。因此�,可參考?xì)W盟經(jīng)驗�,統(tǒng)籌挖掘國家與省級藥品抽檢數(shù)據(jù),對質(zhì)量風(fēng)險進(jìn)行綜合分類���,制定統(tǒng)一的風(fēng)險評估指導(dǎo)通則與量化模型����,從制度體系上進(jìn)一步促進(jìn)國抽與省抽風(fēng)險管理體系有機(jī)融合。
計劃管理:建立互評機(jī)制���,提高抽檢的靶向性與協(xié)作性�、集約監(jiān)管資源按程序要求,DCP/MRP藥品市場監(jiān)督抽檢基于DCP/MRP藥品檢驗數(shù)據(jù)庫,建立了計劃在線互評制度���。承檢OMCLs完成計劃制定后���,會上傳至數(shù)據(jù)庫內(nèi)公示�。根據(jù)互評意見�,OMCLs可隨時對抽檢計劃進(jìn)行調(diào)整,從而避免重復(fù)���、過度抽檢���,充分利用監(jiān)管資源。此外����,通過與CTS建立信息溝通渠道����,實現(xiàn)了CAPs抽檢與DCP/MRP藥品市場監(jiān)督抽檢數(shù)據(jù)的互聯(lián)互通����,促進(jìn)數(shù)據(jù)挖掘�、利用的統(tǒng)籌管理。目前����,雖然我國已對省級藥品抽檢結(jié)果數(shù)據(jù)進(jìn)行統(tǒng)一的管理�、分析與利用���,但尚未從國家層面建立統(tǒng)一的計劃管理平臺����。建議參考?xì)W盟經(jīng)驗����,將管理端口前移,依托國家藥品抽檢信息系統(tǒng)建立省抽計劃統(tǒng)一上傳模塊與互評機(jī)制���,協(xié)同管理國抽與省抽計劃���,促進(jìn)監(jiān)管資源高效利用����。
檢驗管理:制定統(tǒng)一的檢驗質(zhì)量管理體系,可為綜合利用抽檢結(jié)果提供技術(shù)支撐歐盟對于檢驗質(zhì)量的管理���,主要基于兩個層面:一個是基礎(chǔ)層面,官方實驗室質(zhì)量管理體系規(guī)范����,對歐盟全境藥品檢驗實驗室提出了最基礎(chǔ)也最為重要的管理要求;另一個是執(zhí)行細(xì)則���,根據(jù)GEON的過程管理特點����,EDQM制定了較為完備的質(zhì)量管理指南,從細(xì)節(jié)上對檢驗過程中的質(zhì)量保障���、樣品登記流轉(zhuǎn)�、檢驗分析、結(jié)果研判與上報進(jìn)行規(guī)范指導(dǎo)�。統(tǒng)一的質(zhì)量管理要求,為不同藥品質(zhì)量監(jiān)測或檢驗項目的結(jié)果互認(rèn)與統(tǒng)籌分析利用提供了技術(shù)支撐���。因此���,基于歐盟經(jīng)驗���,可在資格認(rèn)證的基礎(chǔ)上,制定藥品抽檢質(zhì)量管理體系指導(dǎo)原則����,逐步提高抽檢檢驗質(zhì)量管理體系的針對性����,促進(jìn)基層藥品檢驗機(jī)構(gòu)整體專業(yè)水平進(jìn)一步提升。
風(fēng)險處置:建立單點聯(lián)系工作組����,有助于形成執(zhí)法標(biāo)準(zhǔn)一致的假劣藥品管控體系依托《藥品質(zhì)量安全犯罪與假劣藥品處置合作規(guī)范》與《打擊藥品犯罪協(xié)定》,歐盟建立了覆蓋全境的假劣藥品風(fēng)險處置體系�。每個成員國的處置單元����,通過WGEO 進(jìn)行綜合協(xié)調(diào),并以SPOCs的模式進(jìn)行溝通合作����,聯(lián)合執(zhí)法并制定風(fēng)險控制措施����。在處置單元內(nèi)部�,由藥品管理部門、警察執(zhí)法部門�、司法機(jī)關(guān)組成的SPOCs���,定期組織聯(lián)席會議�,研討假劣藥品協(xié)同處置方式�。這樣“由點及面”的工作模式���,促使各成員國形成一致的執(zhí)法標(biāo)準(zhǔn)����,對境內(nèi)假劣藥品進(jìn)行有效管控。建議參照歐盟模式����,從法規(guī)政策入手����,統(tǒng)一風(fēng)險處置標(biāo)準(zhǔn)�,以點對點的方式建立由藥品注冊、標(biāo)準(zhǔn)管理����、稽查執(zhí)法、公安司法等組成的風(fēng)險處置工作組�,從而進(jìn)一步提高風(fēng)險信號挖掘與控制能力。
轉(zhuǎn)化應(yīng)用:多元化的樣品來源途徑與國際化的檢驗協(xié)作體系���,有利于充分監(jiān)測供應(yīng)鏈體系歐盟主要進(jìn)行了兩方面專項研究:一是市場監(jiān)測研究,旨在比較同一品種在不同成員國之間的質(zhì)量差異�,進(jìn)而為標(biāo)準(zhǔn)提升提供建議�;二是潛在假劣藥品市場監(jiān)測研究���,主要根據(jù)問題線索評估供應(yīng)鏈?zhǔn)欠翊嬖诩倭铀幤凤L(fēng)險���。在樣品來源方面,專項研究不光從市場直接抽取樣品���,還接受醫(yī)務(wù)工作者�、患者與執(zhí)法人員寄送的樣品,針對性地擴(kuò)大了監(jiān)測范圍����;在承檢機(jī)構(gòu)方面,積極與歐盟外的檢驗實驗室合作研究���。因此,建議我國在探索國抽與省抽統(tǒng)籌新模式的過程中���,結(jié)合監(jiān)管實際積極擴(kuò)大樣品來源,比如對常見的網(wǎng)售藥品進(jìn)行抽檢���;并且在設(shè)置抽檢專項時���,進(jìn)一步拓展國際合作,以充分評估海外供應(yīng)鏈質(zhì)量安全���。



