美國藥典-處方集�,是由美國藥典委員會編寫的。它分為兩個部分����,前面是USP,后面是NF����。
美國藥典是美國政府對藥品質(zhì)量標(biāo)準(zhǔn)和檢定方法作出的技術(shù)規(guī)定,也是藥品生產(chǎn)�、使用、管理�、檢驗的法律依據(jù)。NF收載了美國藥典(USP)尚未收入的新藥和新制劑����。
USP-NF通常會每年更新?���,F(xiàn)在官方只提供在線版本(USP-NF Online),現(xiàn)行最新版為USP-NF 2022����,Issue 3。USP–NF 2023, Issue 1, will become official on May 1, 2023.
凡例
1����、與中國藥典一致,凡例部分規(guī)定了USP-NF的基本假設(shè)�、定義和默認(rèn)條件。除另有規(guī)定外�,凡例中的要求適用于所有藥典中收錄的品種正文和基本通則��。
2��、美國藥典的全稱是The Pharmacopeia of the United States of America and the National Formulary (USP–NF)��。雖然USP和NF是共同發(fā)布且共用凡例��,但它們是相互獨立的����。
3�、當(dāng)使用USP、NF或USP-NF這些描述且沒有特別說明時��,指的則是當(dāng)前最新版本����。
4、美國藥典會持續(xù)修訂����,新增補內(nèi)容會定期添加到USP-NF中。常規(guī)修訂每年會發(fā)表3次��,以USP-NF 2021為例��,日期為
USP–NF 2021 Issue 1: Published November 1, 2020
USP–NF 2021 Issue 2: Published February 1, 2021
USP–NF 2021 Issue 3: Published June 1, 2021
5、藥典的正文發(fā)表在https://online.uspnf.com網(wǎng)站�。藥典的常規(guī)修訂會指定生效日期,通常在發(fā)布之日起的6個月后��??焖傩抻唲t是為了更快地生效藥典中的標(biāo)準(zhǔn)�,發(fā)布之日起取代原先內(nèi)容后立即生效。
6�、定期的����,與藥典增修訂相關(guān)的一個非正式卷會通過印刷或其他媒體發(fā)表。它的作用是作為一個歷史參考文件而非正式文本����。
7�、正文是指被藥典收錄的內(nèi)容����。當(dāng)它在一個各論中發(fā)表且有一個指定的生效日期時,即被視為認(rèn)可和收錄于藥典中�。
8、各論中指定的標(biāo)題是正文的正式名稱�,不能用其它同義詞代替。
9�、正文包括活性物質(zhì)和產(chǎn)品。其中:
活性物質(zhì)是指原料藥��、輔料�、膳食成分或其他組分��,或成品設(shè)備的組件�。
產(chǎn)品是指藥品、膳食補充劑����、復(fù)方制劑����、或成品設(shè)備。
10�、USP-NF藥典中正文的標(biāo)準(zhǔn)會在各論、適用的通則和凡例中進(jìn)行表述��。各論中�,正文的要求有兩種表述方法:
對特定各論,在標(biāo)題之后�,文本主要信息部分描述完后會跟著一段要求文本,并通過“《 ”符號將后面這段內(nèi)容引出��。
對近期重新設(shè)計的各論�,要求內(nèi)容出現(xiàn)在標(biāo)題和定義“Definition”之間�。
11�、無論何種格式,出現(xiàn)在這些地方的信息僅用于參考��。
標(biāo)題之后和“《 ”之前�;
標(biāo)題之后和定義之前����;
輔助信息里面或后面。
12�、適用的通則是指編號在1000以下或2000以上的通則����,它通過引用凡例����、各論或其他另一個編號小于1000的適用的通則使之適用于藥典����。
當(dāng)某個各論的要求不同于凡例或通則的要求時����,無論各論是否說明差異�,均以各論中的要求為準(zhǔn)。
編號在1000~1999的通則僅供參考����。無論是否在編號小于1000的通則��、各論或凡例中有被引用�,它們包含的是藥典中的非強制性測試、含量��、或其他要求�。
編號大于2000的通則僅用于準(zhǔn)備用來當(dāng)作膳食成分或補充劑的正文��。
13、除非在發(fā)布時另有說明����,否則 USP 允許在正式日期之前提前采用修訂后的標(biāo)準(zhǔn)����。
14、相關(guān)各論��、通則和凡例中的標(biāo)準(zhǔn)在整個正文內(nèi)容的生命周期內(nèi)都適用��,從發(fā)布生效起到過期失效��。
15��、為了保證產(chǎn)品按照要求貯藏�,在規(guī)定的效期內(nèi)符合藥典標(biāo)準(zhǔn)�,通常會遵循廠家的標(biāo)準(zhǔn)和生產(chǎn)規(guī)范�。每個商業(yè)化的藥典產(chǎn)品都應(yīng)照此來構(gòu)建,這樣當(dāng)用這些含量和檢查方法檢驗時��,它才能夠符合藥典要求�。
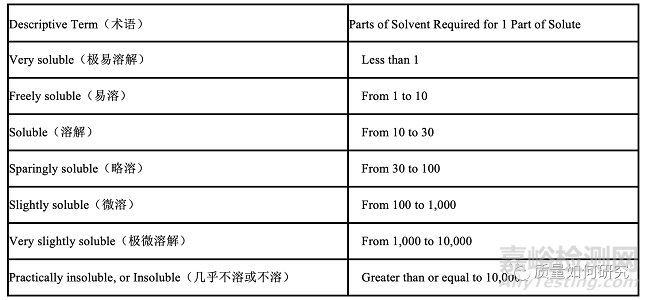
16��、一些測試(如溶出度和制劑含量均一性)需要多個計量單位與決策方案相結(jié)合����。這些測試雖然使用了許多劑量單位,但實際上是一次測定�。這些方法不應(yīng)和統(tǒng)計抽樣方案相混淆�。與統(tǒng)計方法的相似的是,它似乎可以用來推斷一些更大的單位組�。但是,關(guān)于是否符合藥典標(biāo)準(zhǔn)的陳述只是針對于測試的單位����。
17��、重復(fù)��、平行��、異常的統(tǒng)計拒絕����、或外推結(jié)果到更大的樣本,以及批檢測的必要性和適當(dāng)?shù)念l率��,這些在藥典中既未具體規(guī)定也沒有禁止��。這些決定主要是基于測試的目的�。測試的頻率和取樣主要取決于執(zhí)行符合性測試人員的偏好或決定��,以及其他USP-NF的使用者��,包括生產(chǎn)廠家����、買家或監(jiān)管機構(gòu)�。
18、適用的USP或NF標(biāo)準(zhǔn)適用于所有在美國上市的產(chǎn)品�,包括:
收錄在藥典中的
準(zhǔn)備用于或標(biāo)記用于藥品中的一個藥品或一個組分。
這些產(chǎn)品(藥品����、原料藥和輔料)包括了人用藥物(無論是通過處方�、非處方或其他方式分發(fā))和獸用藥物。
19��、當(dāng)某個產(chǎn)品標(biāo)簽上有“USP”,“NF”或“USP-NF”時����,表示它符合美國藥典的標(biāo)準(zhǔn)�,字母應(yīng)與產(chǎn)品標(biāo)題一起出現(xiàn)����。另外字母不能用圓圈、正方形等圈起來�,且應(yīng)大寫。
20�、各論規(guī)定了產(chǎn)品的名稱�、定義、質(zhì)量標(biāo)準(zhǔn)以及與包裝����、貯藏和標(biāo)簽相關(guān)的其他要求。質(zhì)量標(biāo)準(zhǔn)包括了檢查項目����,方法和可接受標(biāo)準(zhǔn)��,有助于確保產(chǎn)品的特性、劑量��,質(zhì)量和純度�。
21����、單個各論可能包括同一屬性的多個測試、程序和驗收標(biāo)準(zhǔn)��。除非各論中另有說明��,否則所有測試都是要求�。在某些情況下��,各論說明允許選擇反映不同生產(chǎn)企業(yè)產(chǎn)品屬性的測試����,例如不同的多晶型、雜質(zhì)�、水合物和溶出度�。
22、各項測試的排列順序是按照相關(guān)專家委員會批準(zhǔn)將其納入各論的順序�。測試1不一定是針對原研或參比樣品的測試�。根據(jù)各論�,如果使用測試1����,通常不需要在標(biāo)簽上注明。
23����、可接受標(biāo)準(zhǔn)中包括了分析誤差��,生產(chǎn)制造和復(fù)方組合中不可避免的變化�,以及實際條件下可接受的惡化程度�。藥典可接受標(biāo)準(zhǔn)的存在不能作為說明一個純度更接近100%的產(chǎn)品質(zhì)量超過了藥典質(zhì)量的依據(jù)。同樣的����,當(dāng)一個產(chǎn)品準(zhǔn)備收緊各論中的藥典標(biāo)準(zhǔn)時,也并不能作為說明這個產(chǎn)品超過了藥典要求的依據(jù)�。
24、每個通則都分配有一個數(shù)字��,出現(xiàn)在通則名稱的后面并用尖括號框?�。ㄈ纾V法<621>)����。通則通常包括以下內(nèi)容:
應(yīng)用于各論的檢查項目和方法描述
藥物配制的條件和實踐的描述和標(biāo)準(zhǔn)
解釋藥典要求的一般信息
一般藥物儲存、分發(fā)和包裝實踐的描述
給官方物質(zhì)或產(chǎn)品制造商的一般指南
25�、當(dāng)各論中引用了一個通則,那么相應(yīng)的可接受標(biāo)準(zhǔn)可能會出現(xiàn)在冒號之后����。有一些通則可能只是作為一項測試或者分析技術(shù)的介紹性概述,那么它們可能會引用其他的包含技術(shù)��、詳細(xì)程序以及可接受標(biāo)準(zhǔn)的通則����。
26、在藥典中使用分子式是為了指定化學(xué)實體�,類似于給出產(chǎn)品的完整化學(xué)名稱,使其在規(guī)定強度時具有絕對的(100%)純度����。
27、如果由于添加物質(zhì)的存在影響了藥品的生物利用度�,治療效果或者安全性,或者干擾了確認(rèn)符合標(biāo)準(zhǔn)的含量及測試時,那么它會被認(rèn)為不適合包含在品種正文中而被禁止�。
28、藥品包裝中的空氣有時候會根據(jù)需要進(jìn)行抽空或用二氧化碳����、氦氣、氬氣或氮氣以及這些氣體的混合物所置換��。這些氣體的使用無需在標(biāo)簽中聲明�。
29、藥典中僅允許包含指定的各論下批準(zhǔn)的添加物質(zhì)�。此類添加物質(zhì)不能超過發(fā)揮預(yù)期作用所需的量。如果批準(zhǔn)了添加物質(zhì)�,那么標(biāo)簽上就需要注明每一個添加物質(zhì)的名稱和數(shù)量�。
30、除非各論中另有規(guī)定�,否則可以將合適的原料藥和輔料,如抗菌劑��、藥物基質(zhì)�、載體、包衣����、香料、防腐劑����、穩(wěn)定劑和媒介物添加到制劑產(chǎn)品中�,以增強其穩(wěn)定性�、實用性、美觀性或便于其制備��。
31��、根據(jù)FDA發(fā)布的有關(guān)使用色素的規(guī)定��,僅用于賦予顏色的添加物質(zhì)和輔料可以摻入用于腸胃外或眼科用途以外的官方產(chǎn)品中����,前提是此類添加物質(zhì)或輔料在所有方面都是合適的。
32�、只有當(dāng)各論中給出了一個定量溶解度測試并指定它為定量溶解度測試時,它才是一個純度檢查項��。盡管各論中提供的信息和參考表中提供的信息可能間接有助于文章的初步評估�,但它并不作為純度的標(biāo)準(zhǔn)或測試方法。
33����、藥典中“鑒別”測試是用來確認(rèn)藥品的身份。特定產(chǎn)品的鑒別檢查可能包含一個或多個程序。當(dāng)進(jìn)行鑒別檢查時�,必須所有指定流程的要求都滿足才能滿足測試要求。若未能滿足所有要求�,則表明產(chǎn)品貼錯標(biāo)簽或者摻假了。
34����、復(fù)方制劑的含量測試不是用來做分發(fā)前的評估,而是用來處理復(fù)方制劑是否符合藥典標(biāo)準(zhǔn)的爭議時作為官方測試�。
35、雜質(zhì)和異物的檢查方法是將這些物質(zhì)限制在藥品日常使用時沒有爭議的量��。
36����、如果USP-NF的各論中包括了一個基于色譜方法的含量或有機雜質(zhì)檢測,它不是殘留溶劑�,并且各論程序中沒有檢測到物質(zhì)中存在的雜質(zhì)�,雜質(zhì)的數(shù)量和身份都是知道的,那么在產(chǎn)品標(biāo)簽(COA)的“其他雜質(zhì)”項下應(yīng)該進(jìn)行說明��。
37����、藥典中未標(biāo)記的其他雜質(zhì),如果含量是0.1%或更大,是根據(jù)標(biāo)準(zhǔn)的不同而變化��。除非各論另有規(guī)定�,其他雜質(zhì)加上各論中檢出的雜質(zhì)之和不得大于2.0%。
38��、以下類別的原料藥不包括在“其他雜質(zhì)”要求中:
發(fā)酵產(chǎn)物和衍生的半合成產(chǎn)品�,放射性藥物,生物制品����,生物技術(shù)衍生產(chǎn)品,肽�,草藥,動物或植物來源的粗產(chǎn)品��。
39����、任何被認(rèn)為是有毒的物質(zhì)不能被列在“其他雜質(zhì)”項下。
40����、所有USP和 NF制品均受到殘留溶劑的相關(guān)控制,即使各論中未指定測試也是如此����。如果在生產(chǎn)過程中使用溶劑��,它們必須具有合適的質(zhì)量����。此外��,應(yīng)考慮每種溶劑的毒性和殘留水平��,并根據(jù)殘留溶劑〈467〉中定義的原理和要求����,使用其中介紹的一般方法或其他合適的方法限制溶劑。
41��、官方藥品中的元素雜質(zhì)按照元素雜質(zhì)—限量〈232〉中規(guī)定的原則和要求進(jìn)行控制����。
42、USP 標(biāo)準(zhǔn)品是經(jīng)批準(zhǔn)適用于 USP 或 NF 測試和分析的真實樣品����。如果USP或NF測試或測定要求使用USP標(biāo)準(zhǔn)品��,則只有使用指定的USP標(biāo)準(zhǔn)品獲得的結(jié)果才是決定性的。如果程序要求使用藥典產(chǎn)品而不是USP標(biāo)準(zhǔn)物質(zhì)作為參考物質(zhì)標(biāo)準(zhǔn)品�,則應(yīng)使用符合該物品所有藥典各論要求的物質(zhì)。如果任何新的USP 或NF標(biāo)準(zhǔn)要求使用尚未提供的新USP標(biāo)準(zhǔn)品�,則在指定的USP標(biāo)準(zhǔn)物質(zhì)可用之前,包含該要求的標(biāo)準(zhǔn)品部分不能正式生效�。
43、除非在個別各論或通則中另有說明�,否則USP標(biāo)準(zhǔn)品應(yīng)按照標(biāo)準(zhǔn)物質(zhì)標(biāo)簽上的說明使用。