1.體系核查優(yōu)先
2.審評審批優(yōu)先
3.專項交流
二�����、申請優(yōu)先審批的相關要求
符合下列情形之一的醫(yī)療器械:
(1) 診斷或者治療罕見病��,且具有明顯臨床優(yōu)勢��;
(2) 診斷或者治療惡性腫瘤��,且具有明顯臨床優(yōu)勢��;
(3) 診斷或者治療老年人特有和多發(fā)疾病�����,且目前尚無有效診斷或者治療手段��;
(4) 專用于兒童,且具有明顯臨床優(yōu)勢��;
(5) 臨床急需��,且在我國尚無同品種產品獲準注冊的醫(yī)療器械����。
列入國家科技重大專項或國家重點研發(fā)計劃的醫(yī)療器械。
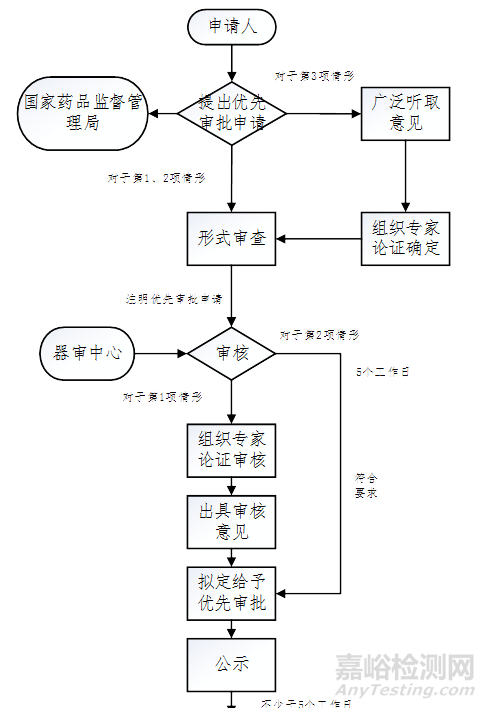
對于其他應當優(yōu)先審批的醫(yī)療器械��,由國家藥品監(jiān)督管理局廣泛聽取意見�����,并組織專家論證后再確定是否予以優(yōu)先審批��。
以上所提及醫(yī)療器械均需屬于境內第三類和進口第二類����、第三類醫(yī)療器械。
三�����、審批流程
四、TIPS
1.對公示項目有異議的����,器審中心在收到異議起10個工作日內��,對相關意見進行研究��,并將研究意見告知申請人和提出異議方��。
2.器審中心經審核不予優(yōu)先審批的�����,將不予優(yōu)先審批的意見和原因告知申請人�����,并按常規(guī)審批程序辦理�����。
3.對于已納入優(yōu)先審評通道的醫(yī)療器械����,在國家藥監(jiān)局、器審中心已發(fā)布實施的溝通交流機制保持不變的基礎上�����,由器審中心定期更新產品清單并交換至分中心,分中心按照專人負責����、主動對接、全程指導的工作機制�����,指派專人主動服務��,給予指導��。