經(jīng)過(guò)一兩年甚至更久的研究開發(fā)籌備,又經(jīng)歷遞交前長(zhǎng)達(dá)數(shù)周甚至數(shù)月加班制作申報(bào)資料�,大家都希望項(xiàng)目受理后可以順利獲批臨床或上市,然而前期的一點(diǎn)疏漏可能導(dǎo)致整個(gè)的項(xiàng)目進(jìn)程受阻����。在此�,我總結(jié)了近期經(jīng)歷的撤回及提交異議的一點(diǎn)小經(jīng)驗(yàn),希望可以為有同樣困擾的同行提供一些信息�����,當(dāng)時(shí)更希望這些信息您永遠(yuǎn)都用不到���。
如果遞交注冊(cè)申請(qǐng)后�,CDE老師經(jīng)過(guò)審評(píng),結(jié)論為不通過(guò),那么在審評(píng)的過(guò)程中��,會(huì)將項(xiàng)目計(jì)時(shí)暫停�,轉(zhuǎn)到異議通道。以本次IND申請(qǐng)為例����,在40-50工作日收到CDE老師的審評(píng)意見(jiàn)�����,審評(píng)暫停計(jì)時(shí),掛到異議通道��。根據(jù)和其他同行老師的溝通��,有一些項(xiàng)目若存在更為明顯的問(wèn)題����,會(huì)在更早期如三十多個(gè)工作日的時(shí)候收到老師的反饋,因?yàn)轫?xiàng)目缺少關(guān)鍵的試驗(yàn)���,老師直接建議項(xiàng)目撤回�。
相關(guān)的審評(píng)意見(jiàn)可以在“不批準(zhǔn)異議申請(qǐng)”的通道找到�。根據(jù)申報(bào)產(chǎn)品為制劑或原料,選擇不同的通道即可看到老師的意見(jiàn)���。其中�,有一份word版資料為綜合審評(píng)意見(jiàn)�,會(huì)注明項(xiàng)目不予批準(zhǔn)的原因(此處要注意,對(duì)于其他部門未導(dǎo)致不批準(zhǔn)結(jié)論的審評(píng)意見(jiàn)��,此word文件中不做展示,可以后續(xù)和項(xiàng)目的主審老師進(jìn)行溝通���,看是否可以拿到其他老師的審評(píng)意見(jiàn)����,便于對(duì)項(xiàng)目進(jìn)行改進(jìn))��。同時(shí)可以看到一份不予通過(guò)的審評(píng)結(jié)論告知書��,告知書中會(huì)再次告訴申請(qǐng)人不予通過(guò)的原因�,同時(shí)告訴申請(qǐng)人下一步可以采取的行動(dòng)�����。
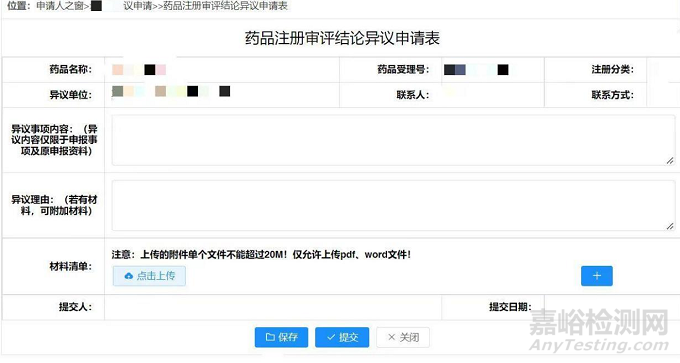
如果申請(qǐng)人選擇通過(guò)申請(qǐng)人之窗提出異議�,需要參考如下《藥品注冊(cè)審評(píng)結(jié)論異議申請(qǐng)表》進(jìn)行相關(guān)資料的準(zhǔn)備,相關(guān)的材料為:
1. 申請(qǐng)人之窗或郵件打印的不予通過(guò)的申請(qǐng)結(jié)論材料�。
2. 藥品注冊(cè)審評(píng)結(jié)論異議申請(qǐng)表和異議報(bào)告。注意��,申請(qǐng)表中可以上傳支持性的資料���,但是僅限于20MB以內(nèi)的PDF或word文件�。
3. 授權(quán)委托書
4. 境外申請(qǐng)人制定中國(guó)境內(nèi)的企業(yè)法人辦理相關(guān)注冊(cè)事項(xiàng)的,可由注冊(cè)代理提出異議申請(qǐng)�,同時(shí)需要提交原委托文書復(fù)印件以及注冊(cè)代理機(jī)構(gòu)的營(yíng)業(yè)執(zhí)照復(fù)印件。
異議的相關(guān)資料僅限于原申報(bào)事項(xiàng)和原申報(bào)資料�。如果想利用異議的機(jī)會(huì)跟CDE老師探討新的試驗(yàn)設(shè)計(jì)思路或項(xiàng)目的整改方案,原則上是不允許的����。
我司最終未選擇提交異議申請(qǐng),但是經(jīng)過(guò)同行交流����,有些公司在提交異議申請(qǐng)獲得和CDE的開會(huì)資格后,CDE老師并未改變不批準(zhǔn)的決定���。但是申請(qǐng)人可以利用本次機(jī)會(huì)和CDE老師充分進(jìn)行項(xiàng)目探討����,了解老師的想法���,明確下一步的行動(dòng)安排��。
根據(jù)2020年3月30日頒布的《藥品注冊(cè)管理辦法(國(guó)家市場(chǎng)監(jiān)督管理總局令第27號(hào))》
第九十條 藥品注冊(cè)期間����,對(duì)于審評(píng)結(jié)論為不通過(guò)的,藥品審評(píng)中心應(yīng)當(dāng)告知申請(qǐng)人不通過(guò)的理由�,申請(qǐng)人可以在十五日內(nèi)向藥品審評(píng)中心提出異議。藥品審評(píng)中心結(jié)合申請(qǐng)人的異議意見(jiàn)進(jìn)行綜合評(píng)估并反饋申請(qǐng)人��。
申請(qǐng)人對(duì)綜合評(píng)估結(jié)果仍有異議的����,藥品審評(píng)中心應(yīng)當(dāng)按照規(guī)定,在五十日內(nèi)組織專家咨詢委員會(huì)論證����,并綜合專家論證結(jié)果形成最終的審評(píng)結(jié)論。
申請(qǐng)人異議和專家論證時(shí)間不計(jì)入審評(píng)時(shí)限����。
第九十三條 藥品注冊(cè)申請(qǐng)審批結(jié)束后��,申請(qǐng)人對(duì)行政許可決定有異議的��,可以依法提起行政復(fù)議或者行政訴訟�。
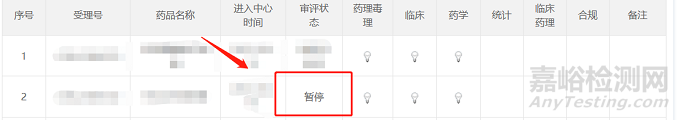
項(xiàng)目處于異議流程中時(shí),在藥審中心網(wǎng)站-信息公開-審評(píng)任務(wù)公示欄中��,項(xiàng)目的狀態(tài)會(huì)變?yōu)闀和����!?/span>
根據(jù)2020年3月30日頒布的《藥品注冊(cè)管理辦法(國(guó)家市場(chǎng)監(jiān)督管理總局令第27號(hào))》
第八十八條 藥物臨床試驗(yàn)申請(qǐng)����、藥物臨床試驗(yàn)期間的補(bǔ)充申請(qǐng)����,在審評(píng)期間,不得補(bǔ)充新的技術(shù)資料�����;如需要開展新的研究����,申請(qǐng)人可以在撤回后重新提出申請(qǐng)。
第八十九條 藥品注冊(cè)申請(qǐng)受理后���,申請(qǐng)人可以提出撤回申請(qǐng)����。同意撤回申請(qǐng)的���,藥品審評(píng)中心或者省���、自治區(qū)�����、直轄市藥品監(jiān)督管理部門終止其注冊(cè)程序�����,并告知藥品注冊(cè)核查�����、檢驗(yàn)等技術(shù)機(jī)構(gòu)��。審評(píng)�����、核查和檢驗(yàn)過(guò)程中發(fā)現(xiàn)涉嫌存在隱瞞真實(shí)情況或者提供虛假信息等違法行為的,依法處理����,申請(qǐng)人不得撤回藥品注冊(cè)申請(qǐng)。
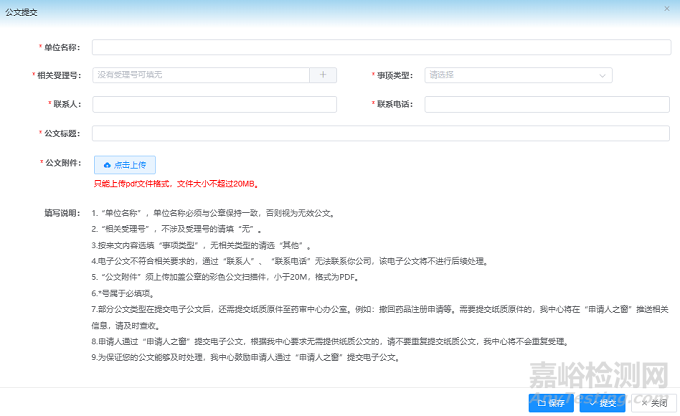
如果申請(qǐng)人對(duì)CDE老師的審評(píng)結(jié)論沒(méi)有異議��,同時(shí)又想盡快將項(xiàng)目狀態(tài)從暫停調(diào)整回正常,可以通過(guò)撤回流程進(jìn)行操作��。撤回申請(qǐng)可以通過(guò)申請(qǐng)人之窗-公文提交欄目先行遞交電子公文���。注意根據(jù)公文提交中的填寫說(shuō)明第7項(xiàng)��,撤回藥品注冊(cè)申請(qǐng)的公文同時(shí)需要郵寄紙質(zhì)原件至藥審中心辦公室��。電子公文提交當(dāng)天����,申請(qǐng)人之窗系統(tǒng)提示已收文����,紙質(zhì)公文簽收當(dāng)天或第二天,項(xiàng)目異議通道撤回�����,項(xiàng)目重新啟動(dòng)計(jì)時(shí)��。項(xiàng)目重新回到排隊(duì)序列中��,基本和同期收到默示許可的項(xiàng)目一同收到通知書�,只是撤回項(xiàng)目會(huì)收到《藥品注冊(cè)申請(qǐng)終止通知書》����。通知書內(nèi)容會(huì)顯示根據(jù)《藥品注冊(cè)管理辦法》第八十九條及申請(qǐng)人公文����,同意本品注冊(cè)申請(qǐng)撤回,終止注冊(cè)程序�。
項(xiàng)目異議通道撤回后至發(fā)放藥品注冊(cè)終止通知書之前,在藥審中心網(wǎng)站-信息公開-審評(píng)任務(wù)公示欄中����,項(xiàng)目會(huì)重新回到排隊(duì)序列中,項(xiàng)目狀態(tài)會(huì)變?yōu)榕抨?duì)待審評(píng)���。
不論項(xiàng)目撤回或不批準(zhǔn)�����,在下次申報(bào)時(shí)都需要在申請(qǐng)表的“歷次申請(qǐng)情況”中進(jìn)行呈現(xiàn)���。根據(jù)填表說(shuō)明第29項(xiàng)“歷次申請(qǐng)情況”的要求,申請(qǐng)人需要填寫由同一申請(qǐng)人申報(bào)的該品種末次批準(zhǔn)上市至本次提出申請(qǐng)期間提出的所有相關(guān)申請(qǐng)情況(若該品種仍未批準(zhǔn)上市的���,應(yīng)從首次申請(qǐng)開始填寫歷次申請(qǐng)情況)���。
在這個(gè)過(guò)程中,筆者總結(jié)了一些思考���,希望可以拋磚引玉����,也請(qǐng)經(jīng)驗(yàn)豐富的老師幫忙進(jìn)行補(bǔ)充:
1) 需要撤回的情況:
有些缺陷很明顯的項(xiàng)目����,如某些關(guān)鍵研究未進(jìn)行考察、或試驗(yàn)設(shè)計(jì)有明顯的缺陷��、或取得的試驗(yàn)數(shù)據(jù)很明顯無(wú)法支持臨床設(shè)計(jì)等��,建議直接進(jìn)行撤回操作��。
此時(shí)需要申辦方自行進(jìn)行評(píng)估�,如果對(duì)項(xiàng)目信心不足,且希望盡快可以對(duì)項(xiàng)目存在的問(wèn)題進(jìn)行改進(jìn)完善��,建議還是盡早撤回����,盡早提交新的注冊(cè)申請(qǐng)��。否則按照異議的流程��,后續(xù)還要等待至少五十日�����、且最終的結(jié)果還是大概率審評(píng)不通過(guò)項(xiàng)目撤回����,不如抓緊時(shí)間進(jìn)行試驗(yàn)和資料的完善��。讓老師看到申辦方對(duì)項(xiàng)目的努力及對(duì)審評(píng)意見(jiàn)的態(tài)度��。
2)可以進(jìn)行異議嘗試的情況:
認(rèn)為項(xiàng)目中的信息足夠支持注冊(cè)申請(qǐng)���、或認(rèn)為部分信息老師在初次審評(píng)的時(shí)候存在疏漏和理解錯(cuò)誤���、或希望借此機(jī)會(huì)和CDE老師對(duì)項(xiàng)目中存在的問(wèn)題進(jìn)行深入探索討論。
在申辦方經(jīng)驗(yàn)不夠豐富��,或?qū)@個(gè)項(xiàng)目目前取得的相關(guān)數(shù)據(jù)解讀不夠深入�����,或靶點(diǎn)較新、行業(yè)里并無(wú)太多經(jīng)驗(yàn)��,通過(guò)異議和CDE老師進(jìn)行會(huì)議討論可以幫申辦方更好的明白CDE老師的審評(píng)意見(jiàn)����,請(qǐng)老師幫忙指明項(xiàng)目需要努力的方向��,幫助項(xiàng)目進(jìn)行更好的改善和提升��。這是很好的學(xué)習(xí)機(jī)會(huì)�����。當(dāng)然前提是項(xiàng)目時(shí)間允許�����,能夠讓大家停下來(lái)通過(guò)異議流程將項(xiàng)目梳理的更清晰明確���。
如果申報(bào)資料本身質(zhì)量就不高�,切記不要利用異議的機(jī)會(huì)反復(fù)闡述注冊(cè)資料中已提及的信息�,不要強(qiáng)行和老師argue、硬說(shuō)數(shù)據(jù)沒(méi)問(wèn)題,更不要讓老師幫忙確認(rèn)新的試驗(yàn)或方案設(shè)計(jì)等��,這些操作只會(huì)的增加CDE老師和申辦方內(nèi)部無(wú)意義的工作量����,讓CDE老師對(duì)項(xiàng)目的印象分更差。
以上是我近期整理的注冊(cè)申請(qǐng)撤回及提交異議的一點(diǎn)經(jīng)驗(yàn)��,希望對(duì)同行小伙伴有幫助�����,更希望您用不到該經(jīng)驗(yàn)��。