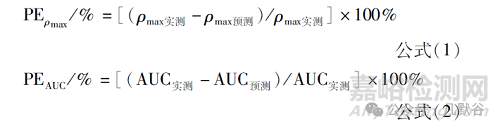摘要:長效注射劑在治療慢性疾病方面具有優(yōu)勢����,本文對體外評價研究、體內(nèi)評價研究的相關(guān)方法和影響因素進行了梳理����,總結(jié)了體外釋放行為與體內(nèi)藥動學(xué)過程的聯(lián)立和數(shù)學(xué)建模,綜述長效注射劑體內(nèi)外相關(guān)性(in vitro-in vivo correlation���,IVIVC)的分類���、實驗方法、建立步驟和模型評價方法����。由于長效注射劑的多樣性,IVIVC研究中不存在通用的體外模型���,因此IVIVC研究只能進行逐例建模。綜合藥物理化性質(zhì)、劑型設(shè)計和藥物制劑與給藥部位的相互作用對建立長效注射劑IVIVC研究十分重要���。
關(guān)鍵詞:長效注射劑���;釋放度檢查方法;體內(nèi)評價����;體內(nèi)外相關(guān)性
長效注射劑(long-acting injectable formulations)主要通過皮下、肌內(nèi)注射或其他非血管途徑給藥�,在給藥部位形成藥物儲庫發(fā)揮長效釋放作用,主要包括微球����、脂質(zhì)體、長效混懸劑���、油狀溶液����、原位凝膠植入劑等[1]���。長效注射劑能夠在幾天至幾個月內(nèi)持續(xù)釋放藥物�,可提供穩(wěn)定的血藥濃度,其優(yōu)點是降低給藥頻率�、簡化藥物治療方案、藥動學(xué)波動較小����、不良反應(yīng)少。很多慢性疾病���,如精神性疾病����、癌癥����、慢性或術(shù)后疼痛、抗成癮治療�、蛋白質(zhì)和激素治療都需要長期甚至終生堅持用藥,以防止癥狀隨著時間的推移惡化�。患者對定期服藥依從性差是治療此類疾病的主要障礙���,開發(fā)長效注射劑可改善這一狀況����。對于易引起胃腸道不良反應(yīng)、首過效應(yīng)高����、生物半衰期短���、口服吸收差的藥物���,也可制備成長效注射劑[2-3]。
《中國藥典》2020年版對體內(nèi)外相關(guān)性(in vitro-in vivo correlation�,IVIVC)的定義是由制劑產(chǎn)生的生物學(xué)性質(zhì)或由生物學(xué)性質(zhì)衍生的參數(shù)(如tmax、cmax或AUC)�,與同一制劑的物理化學(xué)性質(zhì)(如體外釋放行為)之間建立合理的定量關(guān)系[4]。美國藥典(USP43-NF38)定義IVIVC是某一藥物制劑的生物學(xué)特征或源于生物學(xué)特征的參數(shù)與藥物制劑的理化特征之間建立的相關(guān)關(guān)系[5]�。美國食品藥品監(jiān)督管理局(FDA)藥品評價和研究中心(CDER)則明確指出,IVIVC指的是描述劑型的體外特征(通常是藥物的體外釋放速率或釋放程度)與體內(nèi)反應(yīng)(如血漿藥物濃度或吸收的藥物總量)之間關(guān)系的預(yù)測性數(shù)學(xué)模型[6]���。
IVIVC的歷史可以追溯到20世紀(jì)50年代�,當(dāng)時的藥理學(xué)家試圖通過數(shù)學(xué)建模的方法將口服制劑的體外藥物溶出與體內(nèi)藥動學(xué)相關(guān)聯(lián)[7-8]�。1997年,F(xiàn)DA發(fā)布了一份關(guān)于口服緩釋制劑IVIVC的開發(fā)����、評估和應(yīng)用的監(jiān)管指南���。此后,IVIVC的建立和應(yīng)用在制藥領(lǐng)域越來越具有重要意義[6]����。《中國藥典》2020年版規(guī)定緩釋���、控釋和遲釋制劑要求進行IVIVC試驗�,它應(yīng)反映體外釋放曲線與血藥濃度-時間曲線之間的關(guān)系�。只有當(dāng)體內(nèi)外具有相關(guān)性時,才能通過體外釋放曲線預(yù)測體內(nèi)情況[4]�。IVIVC評價體系主要包括藥物的體外釋放研究、體內(nèi)釋放研究和建立模型的數(shù)學(xué)處理方法3方面內(nèi)容���。通過IVIVC在體內(nèi)外釋放行為間建立定量�、可靠的聯(lián)系����,測定藥物體外釋放行為就可以間接得到體內(nèi)釋放結(jié)果。IVIVC的研究應(yīng)用較為廣泛���,可用于制劑處方的早期篩選����、體外釋放限度質(zhì)控標(biāo)準(zhǔn)的確定、增加規(guī)格����、上市后變更等。建立和評價體內(nèi)外相關(guān)性的主要目的就是依據(jù)體外數(shù)據(jù)預(yù)測體內(nèi)藥代參數(shù)�,并有可能通過檢驗不同制劑的體外釋放度研究來替代體內(nèi)生物等效性(bio-equivalence����,BE)的驗證[5]。
1 IVIVC的分類
《中國藥典》2020年版把IVIVC歸納為3種:①體外釋放曲線與體內(nèi)吸收曲線(即由血藥濃度數(shù)據(jù)去卷積而得到的曲線)上對應(yīng)的各個時間點分別相關(guān)����,這種相關(guān)簡稱點對點相關(guān),表明兩條曲線可以重合或者通過使用時間標(biāo)度重合�。②應(yīng)用統(tǒng)計矩分析原理建立體外釋放的平均時間與體內(nèi)平均滯留時間之間的相關(guān),由于能產(chǎn)生相似的平均滯留時間可有很多不同的體內(nèi)曲線�,因此體內(nèi)平均滯留時間不能代表體內(nèi)完整的血藥濃度時間曲線。③1個釋放時間點[到達50%血藥濃度所需時間(t50%)���、到達90%血藥濃度所需時間(t90%)等]與1個藥動學(xué)參數(shù)[如曲線下面積(AUC)�、血藥峰濃度(cmax)或達到cmax所需時間(tmax)]之間單點相關(guān)����,它只說明部分相關(guān)[4]�。
USP43-NF38把IVIVC按照相關(guān)性高低分為A����、B、C3個級別���。A級IVIVC是指整個體外溶出/釋放曲線與整個體內(nèi)吸收曲線之間的相互關(guān)系�。體外釋放曲線與體內(nèi)吸收曲線上對應(yīng)的時間點具有點對點的關(guān)系�。一般來說,相關(guān)性是線性的�。然而,非線性相關(guān)性也是可以接受的����。兩條曲線可以重合或通過添加換算因子后重合,獲得的信息量最大���,也是唯一可以獲得生物豁免的IVIVC水平;B級相關(guān)利用統(tǒng)計矩分析的原理���,建立體外釋放的平均時間(MDTin vitro)與體內(nèi)平均滯留時間(MRTin vivo)之間的相關(guān)���。由于能產(chǎn)生相似的MRTin vivo可有很多不同的體內(nèi)曲線���,因此MRTin vivo不能代表體內(nèi)完整的血藥濃度-時間曲線[4]。因此B級相關(guān)性不被認為是點對點相關(guān)性����,并不一定反映實際的體內(nèi)血藥濃度,因此可能缺乏足夠的可預(yù)測性���;C級相關(guān)在溶出/釋放參數(shù)(如t50%)和藥動學(xué)參數(shù)(如cmax,tmax或AUC)之間建立單點關(guān)系�。由于它是基于單點分析,因此不能反映血漿藥物濃度-時間曲線的完整形狀����,而這對于確定藥物的體內(nèi)性能至關(guān)重要。因此���,C級IVIVC在預(yù)測體內(nèi)藥物性能方面是有限的����。然而����,C級相關(guān)性在配方開發(fā)的早期階段可能是有用的����,選擇試驗配方的多重C級相關(guān)將多個溶出/釋放時間點與1個或多個藥動學(xué)參數(shù)(如cmax���、tmax或AUC)聯(lián)系起來���,多重C級相關(guān)性應(yīng)該基于至少3個釋放時間點,涵蓋釋放過程的早期����、中期和晚期階段。多重C級相關(guān)可能和A級關(guān)聯(lián)一樣有用�。然而,如果可以獲得多重C級相關(guān)性���,那么開發(fā)一個A級相關(guān)性也應(yīng)該是可行的����,并且是更可取的[5]����。
有意義的IVIVC可用于指導(dǎo)藥品開發(fā)各個階段的配方和/或工藝開發(fā)變更����。此外����,IVIVC可用于支持和/或驗證體外溶出/釋放方法的使用,并有助于制定臨床相關(guān)的溶出/釋放檢查方法����,以確保產(chǎn)品質(zhì)量[9]。最重要的是���,當(dāng)A級IVIVC被建立和驗證后����,當(dāng)需要在批準(zhǔn)前和批準(zhǔn)后進行變更時(例如����,制劑組成�、制造工藝、設(shè)備和場地)���,體外釋放法可以作為BE研究的替代方法[10-12]���。通過有意義的IVIVC的成功開發(fā)和應(yīng)用,可以從藥物的體外性能準(zhǔn)確預(yù)測體內(nèi)性能����,從而減少人體或動物研究,減輕監(jiān)管負擔(dān)[13-14]�。盡管FDA在20年前就發(fā)布了延長釋放(extended-release����,ER)口服劑型的IVIVC指南�,但只有14份簡化新藥申請(abbrevia tednewdrugapplicat ion,ANDA)申報具有IVIVC數(shù)據(jù)���,其中大多數(shù)因存在缺陷而不被接受[15]。與口服ER劑型相比����,長效注射劑IVIVC的建立更具挑戰(zhàn)性,因為它們具有復(fù)雜特性且缺乏標(biāo)準(zhǔn)化的藥典體外釋放測試方法�。本文重點介紹長效注射劑IVIVC研究的相關(guān)內(nèi)容及進展。
2 IVIVC的建立步驟
A級IVIVC被認為是體外釋放度和體內(nèi)藥動學(xué)數(shù)據(jù)相關(guān)關(guān)系最有力的證明����,常被認為是最高水平的相關(guān)性����,同時A級相關(guān)也是監(jiān)管機構(gòu)認可的用于替代BE研究的唯一相關(guān)性[16-17]。所以在長效注射劑的研究中只有A級相關(guān)才有指導(dǎo)體內(nèi)研究的實際意義和預(yù)測體內(nèi)釋放的能力���,研究人員多致力于A級相關(guān)性的開發(fā),對B和C級別的IVIVC研究相對較少�。一般長效注射劑A級IVIVC的建立步驟為:①選用具有不同釋放速度(例如慢速、中速和快速)的處方(最好是3種或更多)���,獲得體外釋放度數(shù)據(jù)(至少檢測3個時間點以涵蓋釋放曲線的早期、中期和晚期)����;②獲得所選制劑的體內(nèi)血漿藥物濃度曲線數(shù)據(jù)����,對于釋放與條件無關(guān)的藥物,可以選擇一種速率的處方���;③對血藥濃度-時間曲線選擇合適的數(shù)據(jù)處理方法,將其轉(zhuǎn)換為體內(nèi)釋放百分比-時間的曲線�;④判斷各時間點體內(nèi)釋放百分比與對應(yīng)體外釋放百分比的相關(guān)程度����,包括線性(優(yōu)選)或非線性模型(如Sigmoid、Hixon-Crowell�、Weibull����、Higuchi、Logistic等)����,通常采用最小二乘法進行線性回歸���;⑤在內(nèi)部和/或外部評估已開發(fā)的IVIVC的可預(yù)測性[9]。
IVIVC必須采用具有不同釋放速率(以溶解百分比衡量具有≥10%的差異)的處方建立����,以獲取更可靠���、牢固的體內(nèi)外相關(guān)性����,同時在外部預(yù)測能力評估中也可能獲得更好的結(jié)果[18]����。最終得到的IVIVC可以是線性,也可以是非線性的����,這些結(jié)果都可能對藥物的釋放行為有較好的指示作用[19-21]���。當(dāng)開發(fā)A級IVIVC時���,由于體內(nèi)釋放和體外溶出/釋放條件存在差異���,體內(nèi)吸收曲線和體外溶出/釋放曲線之間可能存在差異�。因此�,可以利用時間移動或縮放來允許反卷積的體內(nèi)數(shù)據(jù)與體外釋放數(shù)據(jù)處于相同的時間尺度上�。
雖然A級IVIVC是最具信息量的���,也是監(jiān)管機構(gòu)推薦的�,但其他級別的IVIVC(例如多重C級和B級)可以幫助確保產(chǎn)品質(zhì)量���,并協(xié)助配方開發(fā)。當(dāng)開發(fā)B級IVIVC時���,至少需要3種配方。根據(jù)統(tǒng)計矩分析原理�,計算MRTin vivo、平均吸收時間(MATin vivo)���,并將其與MDTin vitro相關(guān)聯(lián)�。在多重C級相關(guān)的情況下�,1個或多個藥動學(xué)參數(shù)(例如:Cmax,Tmax或AUC)與至少3個釋放時間相關(guān)點覆蓋早期���、中期和后期階段的釋放曲線�。由于長效注射劑的復(fù)雜特性(例如:多相釋放)和缺乏合適的體外釋放試驗方法���,所以這類制劑的IVIVC開發(fā)是一個相對復(fù)雜的過程[9]����。
3體外評價研究
體外評價主要為藥物釋放度測定�,作為長效注射劑的關(guān)鍵質(zhì)量參數(shù),釋放度檢查是指在模擬體內(nèi)給藥環(huán)境的條件下���,對制劑中藥物釋放的速率和程度進行測定���。體外釋放行為是藥物開發(fā)時必須考察的性質(zhì)�。同時,長效注射劑也需要測定體外釋放來指導(dǎo)藥物的體內(nèi)釋放研究和體內(nèi)外相關(guān)性的預(yù)測�。在許多情況下,沒有得到預(yù)測能力可靠的IVIVC是因為使用的體外釋放度方法對釋藥特征不同的制劑處方不具備較好的區(qū)分能力�,如:體外釋藥測定方法對體內(nèi)釋藥環(huán)境的模擬程度不夠。當(dāng)測定方法更加準(zhǔn)確地反映釋藥行為�,IVIVC創(chuàng)建成功的可能性就會增加[22]。所以,對于長效注射劑體外釋放度測定條件和方法的選擇����,既要考慮藥物和制劑自身的性質(zhì),也要著眼于與體內(nèi)藥動學(xué)參數(shù)有較好的相關(guān)性�。
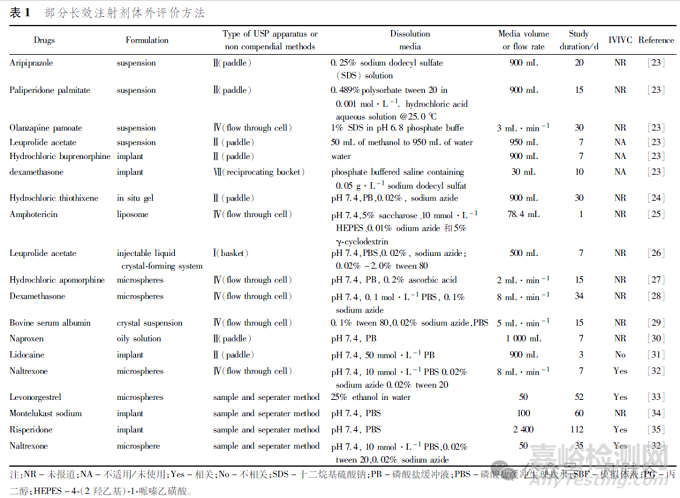
長效注射劑釋藥時間通常為數(shù)周���、數(shù)月甚至數(shù)年����,開發(fā)體外釋放檢查方法時通常包括對藥物釋放進行“實時”監(jiān)測的體外長期釋放度檢查方法和為縮短處方篩選周期可較快進行質(zhì)量評價的體外加速釋放度檢查方法�。釋放度檢查方法通常采用的方法包括藥典方法和非藥典方法�,筆者對部分長效注射劑的體外評價方法總結(jié)見表1���。藥典方法通常包括槳法[23]、籃法[26]���、流池法[23]和往復(fù)筒法[23]等�;非藥典方法包括取樣分離法[32-35]���、透析法[36-40]、擴散池法[41-42]等�。釋放度的研究�,一般考慮以下幾個問題。
3.1 藥物釋放行為的影響因素
藥物活性成分的理化性質(zhì)是所有藥物制劑的關(guān)鍵�,因此活性成分的主要理化性質(zhì)和在給藥部位的穩(wěn)定性是需要首先考慮的因素�。藥物制劑的溶出/釋放行為受藥物活性成分的理化性質(zhì)[如:生物藥劑學(xué)分類(biopharma-ceutical classification system����,BCS)���、粒徑分布���、解離常數(shù)(pKa)���、多晶型等]和劑型特征(如pH敏感性����、載藥量����、空隙度等)的影響。不同制劑類型的釋放特點不同����,長效注射劑中藥物的釋放是體內(nèi)吸收的限速步驟����,相較于口服制劑進行IVIVC時需進行BCS分類評估主成分溶解性和滲透性����,通常在長效注射劑劑型設(shè)計初期���,就需要考慮通過制劑工藝確保主成分能夠長期緩慢釋放[22]���。
3.2 釋放裝置的選擇
各國藥典[中國藥典����、USP、歐洲藥典(EP)]收載的多種釋放裝置通常適用于常規(guī)制劑(如口服和透皮制劑),目前《中國藥典》2020年版收載釋放度檢查的品種有50個�,其中緩釋制劑25個����,這25個釋放度檢查方法中,有11個為籃法����,12個為槳法�,2個為小杯法。除了藥典方法外���,監(jiān)管機構(gòu)還批準(zhǔn)了多種非藥典長效注射劑釋放度檢查方法,如取樣分離法(包括搖床法�、恒溫水浴法等)、透析法����、擴散池法����,這些方法屬于非標(biāo)準(zhǔn)化的檢測方法���。取樣分離法通常用于開發(fā)長效注射劑的長期釋放度方法�;槳法、籃法已用于開發(fā)長效注射劑的加速藥物釋放測定方法�;流通池法����、往復(fù)筒法也可用于長效注射劑的釋放度研究。在長效注射劑釋放度的測定中���,選擇哪種裝置���,應(yīng)考慮具體的劑型及可能的釋藥機制�,發(fā)揮用釋放度測定的結(jié)果預(yù)測體內(nèi)效果的作用����。需要注意的是���,對于非標(biāo)準(zhǔn)化的檢查方法����,設(shè)備參數(shù)的調(diào)整可能會引入較大偏差���。例如用搖床法使用不同性狀和材質(zhì)(吸附性能不同)的孵育容器、釋放介質(zhì)以及搖晃強度均會對藥物釋放產(chǎn)生影響�,這些由試驗方法引入的偏差甚至能夠掩蓋處方或工藝變化帶來的體外釋放行為的差異[43]。非藥典釋放度方法開發(fā)時應(yīng)關(guān)注試驗條件考察�,包括裝置振搖方式���、釋放容器差異�、樣品加入和取樣方法等����。應(yīng)考察方法的適用性和耐用性����,如不同實驗室���、試驗裝置略有差異���、方法參數(shù)適當(dāng)變化等多種情況對釋放度檢測的影響。
3.3 釋放介質(zhì)的選擇
釋放介質(zhì)的選擇對長效注射劑體外釋放方法開發(fā)具有重要意義���,由于長效注射劑一般采用肌注或皮下注射���,而組織環(huán)境的pH為7左右�,所以常采用的介質(zhì)是pH7.4的磷酸鹽緩沖液�。由于長效注射劑進入體內(nèi)會受到巨噬細胞和外周巨噬細胞的吞噬,這些細胞會產(chǎn)生酸性和其他物質(zhì)以加速制劑降解����,使細胞與制劑界面的pH小于7����。所以釋放介質(zhì)有時也會選用pH4.0的醋酸鹽緩沖液�。建議測定不同pH介質(zhì)的釋放曲線����,通過對體內(nèi)吸收過程的研究,找出在何種pH值條件下����,體內(nèi)外相關(guān)性最佳����,作為釋放度質(zhì)量標(biāo)準(zhǔn)制定的依據(jù)���。介質(zhì)中的離子強度以及加入的表面活性劑會影響藥物的溶解度、穩(wěn)定性及聚合物降解速度[44]���。
3.4 釋放條件的選擇
釋放度試驗的操作條件(如溫度、攪拌速度和介質(zhì)流速等)對于藥物釋放結(jié)果同樣有重要影響����。通常釋放度試驗中,以(37±0.5)℃的水浴溫度模擬人體生理溫度����;籃法或槳法等的機械攪拌作用可以模擬生理混勻作用�,籃法100r·min-1與槳法50r·min-1是等效的�,屬于常規(guī)轉(zhuǎn)速����;流通池法中釋放介質(zhì)的單向流動則模擬了人體液的流體動力學(xué)特征等[4]����。
3.5 藥物釋放曲線
通常應(yīng)測定3批產(chǎn)品的釋放度曲線���,以了解釋放的重現(xiàn)性�,每次6個劑量單位[4],也有一些國家藥典[5]規(guī)定12個劑量單位����,至少提供1批產(chǎn)品釋放度均一性�,以相對標(biāo)準(zhǔn)偏差(RSD)表示���,并畫出釋放曲線����。測定釋放曲線,通常根據(jù)所測長效制劑的釋藥周期選擇多個取樣點���,直至測到釋放80%~90%的藥物[4-5]。
3.6 釋放度標(biāo)準(zhǔn)的建立根據(jù)《中國藥典》2020年版���、USP43-NF38和相關(guān)文獻,建立長效注射劑釋放度限度�,要求至少設(shè)計3個時間點�,也可設(shè)計4個或更多個時間點[4-5���,45]。第一點為開始0.5~2h的取樣時間點�,用于考察藥物是否有突釋�;第二點為中間的取樣時間點,用于確定釋藥特性�;最后的取樣時間點,用于考察釋藥是否基本完全����。隨著新型長效注射劑給藥時間的延長����,釋放度取樣點的選取可根據(jù)樣品的真實作用時間進行調(diào)整���。
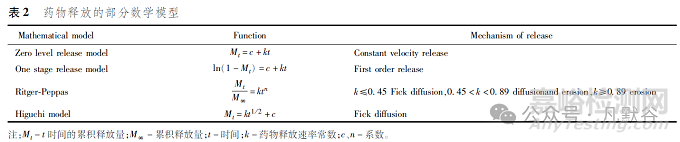
3.7 擬合藥物釋放曲線對于藥物釋放的各種曲線,可以用有關(guān)方程進行擬合����,求出符合該曲線的方程����,可對某一段時間內(nèi)的曲線進行擬合����,或分段擬合����,求出相應(yīng)的方程�,常用的模型有零級釋放����、一級釋放���、Higuchi方程、Weibull分布函數(shù)等[4-5�,9���,46],見表2�。
由于影響藥物釋放的因素較多���,并且不同的制劑難以使用同一模型,故利用一定的模型對釋藥過程進行擬合是釋藥機制研究的常用方法����。一般認為,長效注射劑中藥物的釋放有2種機制:①擴散機制:藥物由進入制劑的溶液溶解后���,經(jīng)空隙擴散到介質(zhì)中,制劑表面藥物的溶解及擴散可形成突釋效應(yīng)����;②降解機制:聚合物降解為代謝產(chǎn)物����,使藥物釋放���,但仍需溶解及擴散進入體液[44]���。Wang等[47]采用Makoid-Banakar模型和Weibull模型擬合利培酮原位形成植入劑體外釋放曲線�,采用Fabs=Diss(Tvivo)模型建立相關(guān)性���。Makoid-Banakar和Weibull模型對釋放曲線的擬合非常相似����,所得的IVIVC也非常相似�,Weibull模型和Makoid-Banakar模型的擬合系數(shù)(r2值)均大于0.97�。
4體內(nèi)評價研究探究
長效注射劑的體內(nèi)釋放特征非常重要,長效注射劑注入人體內(nèi)會依次出現(xiàn)以下3個階段的組織反應(yīng)[48]:①首先是急慢性炎癥反應(yīng)����。②大約在注入體內(nèi)2周���,在長效注射劑與組織界面處會出現(xiàn)纖維包裹反應(yīng),它是纖維原細胞隨著膠原質(zhì)分泌物滲透進入制劑內(nèi)部����,或包裹在其周圍而導(dǎo)致的�。本階段的時間長短與長效注射劑的降解速度有關(guān)。③第3階段是指長效注射劑降解成小顆粒以后的階段���,是由小吞噬細胞吞噬以后加速降解而引發(fā)的反應(yīng)����。第3階段的長短與聚合物加速降解的速度有關(guān)�。直徑大于10μm的顆粒難以被巨噬細胞吞噬�,隨著制劑的降解����,其顆粒小到一定程度后�,便可被巨噬細胞和外周巨噬細胞吞噬�,降解速度可能會加快���。巨噬細胞和外周細胞能夠在制劑界面上產(chǎn)生酸性和其他有助于降解的物質(zhì)。
體內(nèi)釋放行為最為直觀地展示了藥物的臨床性能���,為研究人員提供全面的藥物信息。同時����,由于長效注射劑通常攜帶大劑量的藥物,通過監(jiān)測藥物在體內(nèi)的行為評價復(fù)雜環(huán)境中藥物是否保持平穩(wěn)釋放���,以保障用藥最基本的安全性。與體外研究相比���,體內(nèi)測定方法較統(tǒng)一,目前長效注射劑體內(nèi)釋藥研究主要采用以下2種方法:血藥濃度法和體內(nèi)滯留法���。另外����,因為動物和人在物種上的差異性�,動物模型得到的結(jié)果不能完全推論到人體內(nèi)���。藥物開發(fā)時,常用的受試動物是大鼠�、狗和家兔等,動物模型描述的體內(nèi)釋藥行為可以用來構(gòu)建體內(nèi)外相關(guān)性����,但在監(jiān)管中只有在人體進行的研究可以作為證明BE或生物利用度的依據(jù)[49-50]。
4.1 相關(guān)理論基礎(chǔ)
生物利用度是指藥物經(jīng)血管外途徑給藥后吸收進入全身血液循環(huán)的速率和程度�。生物利用度是個相對概念�,是比較制劑之間利用度的尺度���。根據(jù)比較研究時所采用的參比制劑不同�,分為絕對生物利用度和相對生物利用度。BE是指藥學(xué)等效制劑或可替換藥物�,在相同試驗條件下����,服用相同劑量�,其活性成分吸收程度和速度的差異無統(tǒng)計學(xué)意義���。
4.2 體內(nèi)滯留法
體內(nèi)滯留法是定時取出給藥部位殘留的制劑,選用適宜方法測定藥物的殘留量�,再進一步得出藥物體內(nèi)釋放度的一種方法。Liu等[51]給Sprague-Dawley大鼠分別注射醋酸曲普瑞林微球后于相應(yīng)時間點處死大鼠取出殘留微球�。利用高效液相色譜分析后計算釋藥量���。體內(nèi)釋放曲線顯示,第1天釋放量為30.62%���;在14d內(nèi)釋放較快���,且基本呈線性釋放���,14d之后釋放變緩�,30d醋酸曲普瑞林的累積釋放度為88.32%���。通過篩選和優(yōu)化體外加速釋放條件,對體內(nèi)釋放量(y)和體外加速釋放量(x)進行擬合���,最終擬采用體積分數(shù)15%乙醇溶液(含有0.06%聚山梨酯80和0.1%苯扎氯銨)為釋放介質(zhì)���,在水溫55℃、振搖頻率200r·min-1條件下振搖30h作為加速釋放條件����,線性方程為:y=0.8845x+12.4510(r2=0.9938)����。
4.3 血藥濃度法
該法是在給藥后定時從動物模型或人體取血���,測定血漿樣品中藥物的濃度,得到血藥濃度-時間曲線以評價體內(nèi)的藥物釋放行為����。Hu等[52]采用O/W法制備2種用于評估IVIVC的利培酮PLGA微球�,用Sprague-Dawley大鼠作為實驗動物�,通過高效液相色譜-串聯(lián)質(zhì)譜法進行分析得到血藥濃度-時間曲線�。利培酮混懸液在血漿中的峰值出現(xiàn)在20min時,質(zhì)量濃度為(372.04±44.88)ng·mL-1�,然后迅速消除����,K值為(0.0057±0.0011)min。利培酮微球在初始階段突釋后�,藥物血漿濃度緩慢下降����,直至第40天微球中的利培酮耗盡�,劑型A的血藥濃度在第0.17天達到ρmax�,為(239.12±31.28)ng·mL-1�,劑型B的血藥濃度在第1天達到ρmax,約為(166.18±20.69)ng·mL-1����,劑型A的AUC0-∞達到(1162.88±311.88)ng·d·mL-1���,劑型B的AUC0-∞達到(1004.80±240.78)ng·d·mL-1,2種微球中利培酮的釋放期約為利培酮混懸液的190倍����,顯示出穩(wěn)定的血藥濃度水平�,達到了對藥物緩釋的期望����。采用Wagner-Nelson模型對劑型A和劑型B進行IVIVC擬合�,最小二乘法相關(guān)系數(shù)(r2)分別為0.9758和0.9918���;用Loo-Riegelman模型對劑型A和劑型B進行IVIVC擬合�,r2分別為0.9531和0.9653�;用反卷積法對劑型A和劑型B進行IVIVC擬合����,r2分別為0.9726和0.9903���。r2值均在0.95以上����,說明體外釋藥百分比與大鼠體內(nèi)吸收百分比線性回歸關(guān)系良好����。2種制劑在不同模型下的斜率均在0.9564~1.1868���,表明其體外加速釋放與體內(nèi)吸收的相關(guān)性接近1∶1�。Gan等[53]利用21例患者臨床試驗中獲得的體內(nèi)藥物吸收數(shù)據(jù)和體外釋放數(shù)據(jù)建立了TLD-1(一種新型的多柔比星脂質(zhì)體遞送系統(tǒng))的IVIVC�,并用已上市的多柔比星脂質(zhì)體制劑Doxil?和Lipodox?對所建方法進行了驗證����,3種制劑的r2均大于0.98。
5體外釋放行為與體內(nèi)藥動學(xué)過程的聯(lián)立和數(shù)學(xué)建模
長效注射劑通常經(jīng)肌內(nèi)和皮下注射給藥����,制劑中的藥物在體內(nèi)緩慢釋放����,通過注射部位的毛細血管和淋巴器官等進入全身循環(huán)����,進而再分布到靶器官發(fā)揮藥效���,同時還有一部分藥物經(jīng)肝腎等器官消除。由于注射部位也可能存在肽酶和蛋白酶���,所以對于蛋白質(zhì)多肽類長效注射劑來說,藥物還可能在注射部位被降解���。對于長效注射劑來說,制劑中藥物的釋放是整個體內(nèi)過程的限速部分�。釋藥速度將直接影響到給藥期間血藥濃度是否在治療窗內(nèi)����、是否能發(fā)揮藥效[44]���。因此�,長效注射劑的體外釋放曲線與其注射部位的釋放曲線和血藥濃度-時間曲線的相關(guān)性評價尤為重要����。
體內(nèi)外相關(guān)性的高低既與體外和體內(nèi)測定的方法有關(guān)���,也受體內(nèi)釋放結(jié)果處理方法的影響。IVIVC建立的關(guān)鍵在于如何從長效注射劑的藥動學(xué)數(shù)據(jù)得到體內(nèi)釋放度與時間的信息���。體內(nèi)過程研究可獲得藥物的血藥濃度和尿藥排泄數(shù)據(jù)。通過藥動學(xué)數(shù)據(jù)處理���,可以得到cmax、tmax和AUC等參數(shù)���。體外釋放,以累積釋放百分數(shù)(Fd)表示����。體內(nèi)吸收則以各個時間吸收百分數(shù)(Fa)表示���。對于長效注射劑一般主要考察體外釋放百分數(shù)與體內(nèi)吸收百分數(shù)是否具有相關(guān)關(guān)系�。A級IVIVC通常采用的數(shù)學(xué)方法有:模型法和非模型法,模型法有Wagner-Nelson和Loo-Riegeman法����,非模型法有反卷積法[9]�,見表3���。
5.1 模型依賴法
傳統(tǒng)的依賴于隔室模型的Wagner-Nelson法和Loo-Riegel man法,是目前研究體內(nèi)數(shù)據(jù)的常用方法�。如果給藥后具有明顯的一室模型特征����,可利用Wagner-Nelson法得到藥物體內(nèi)吸收曲線�,如給藥后體內(nèi)的藥動學(xué)符合二室模型特征[4]�,可利用Loo-Riegeman法得到藥物體內(nèi)吸收曲線。Andhariya等[54]用家兔模型研究納曲酮微球的藥動學(xué)���,用Loo-Liegeman法對得到的藥動學(xué)數(shù)據(jù)進行反卷積���,并與USPⅣ法獲得的納曲酮微球體外釋放曲線進行比較���。建立并驗證了A級IVIVC的可預(yù)測性。Shen等[55]用取樣分離法和流通池法對不同工藝制得的利培酮微球體外釋放行為進行測定���,并將家兔實驗得到的藥時曲線用Loo-Liegeman法反卷積,建立IVIVC對藥物體內(nèi)釋放參數(shù)進行預(yù)測���。結(jié)果得到了A級IVIVC且模型擬合較好。
5.2 非模型依賴法
當(dāng)藥物的體內(nèi)過程符合非線性動力學(xué)時���,可通過非模型依賴法的反卷積法(deconvolution)作為推導(dǎo)體內(nèi)“釋放度-時間曲線”的數(shù)學(xué)方法,反卷積法支持通過血藥濃度-時間曲線得到藥物體內(nèi)釋放度數(shù)據(jù)����,也支持由體內(nèi)釋放度-時間曲線推導(dǎo)血藥濃度數(shù)據(jù)���。該法的應(yīng)用不受模型限制�,適于模型化困難藥物的研究����,且擬合結(jié)果準(zhǔn)確可靠[56]。Hu等[52]嘗試分別用Wagner-Nelson模型���,Loo-Liegeman模型和數(shù)值反卷積模型的方法得到利培酮微球的IVIVC,通過研究pH���、滲透壓、溫度和乙醇濃度對利培酮釋放速率的影響來優(yōu)化加速釋放條件�,并在優(yōu)化加速釋放條件下獲得利培酮從PLGA微球中的體外累計釋放量����,并從大鼠中取血分析得出藥動學(xué)參數(shù)。結(jié)果表明���,3種擬合模型IVIVC相關(guān)系數(shù)(r2)均在0.95以上����,斜率均在0.9564~1.1868之間�。Li等[57]嘗試分別采用反卷積法和基于藥動學(xué)(pharmacokinetics���,PK)模型的模擬方法得到艾塞那肽雙層微球的IVIVC,利用直接釋藥法得到體外累積釋放量����,并從大鼠眼眶靜脈中取血分析得出藥動學(xué)參數(shù)����。結(jié)果表明����,通過反卷積和模擬計算得出的微球初始突釋分別約為1.1%和1.2%���,得到A級IVIVC,藥物釋放量與體內(nèi)吸收百分率(Fa)呈良好的線性回歸,r2分別為0.982(反卷積法)和0.984(PK模型的模擬方法)�。
5.3 其他方法
分數(shù)AUC法���、直接測量法[58]、基于PK模型的模擬方法[58]等也被提出用于得到體內(nèi)釋放度數(shù)據(jù)�。Wang等[59]采用恒溫水浴振蕩法測定3種PLGA相對分子質(zhì)量的醋酸戈舍瑞林微球體外釋放行為���,用分數(shù)AUC法處理藥動學(xué)數(shù)據(jù),并將不同釋放速率的微球分別組合�,建立3個IVIVC模型���。結(jié)果得到A級體內(nèi)外相關(guān)性,同時對模型的外部預(yù)測能力進行評估����,發(fā)現(xiàn)預(yù)測與實際的累積釋放曲線基本重合�,說明建立的IVIVC模型具備可預(yù)測性����。
6 IVIVC模型評價
藥物IVIVC模型建立后,需驗證IVIVC模型是否具有預(yù)測能力����。采用體外釋放度研究的數(shù)據(jù)按相關(guān)模型計算體內(nèi)釋放和吸收的值����,作為預(yù)測值�,通過比較預(yù)測值和實測值之間的差異進行評估����,包括內(nèi)部驗證(internal validation)和外部驗證(external validation)[6����,60]。
6.1 內(nèi)部預(yù)測能力評估和外部預(yù)測能力評估
內(nèi)部預(yù)測能力評估是指用體內(nèi)外相關(guān)性建模時采用的制劑處方的數(shù)據(jù)進行驗證���。外部預(yù)測能力評估是指用非建模的制劑處方的數(shù)據(jù)進行驗證����。
外部預(yù)測能力的評估主要用于:內(nèi)部預(yù)測評估的誤差不符合要求時;僅用2種釋藥速率的處方建立了體內(nèi)外相關(guān)性時�;僅在研究治療窗指數(shù)窄的藥物時等����。
按照優(yōu)先順序排列,用以評估外部預(yù)測能力的制劑處方主要為:具有與建立體內(nèi)外相關(guān)性模型時所用制劑處方不同釋藥速率的處方����,其釋藥速率可以在建模用制劑處方的釋藥速率范圍內(nèi)���,但也可以在此范圍外(以了解預(yù)測能力的范圍);具有與建立模型時所用制劑處方相同或類似釋藥速率的處方����,這些處方在制備過程中略有不同(如處方組成����、工藝�、設(shè)備���、生產(chǎn)場地等)����;生產(chǎn)過程中無變化而來自另一生產(chǎn)批的處方����,這些處方與建模時所用處方具有相同或類似的釋藥速率。
6.2 內(nèi)���、外部預(yù)測的評估指標(biāo)
評估指標(biāo)是ρmax和AUC的預(yù)測誤差(PE%),按照公式1~2計算:
6.3 可被接受具有體內(nèi)外相關(guān)性的判斷標(biāo)準(zhǔn)
內(nèi)部預(yù)測能力要求ρmax及AUC的各制劑處方PE的平均值≤10%,且每個制劑處方的PE≤15%����;外部預(yù)測能力要求ρmax和AUC的各制劑處方PE的平均值≤10%�,若PE在10%~20%,則無結(jié)論性判斷����,還需繼續(xù)外部預(yù)測檢驗;若PE>20%通常意味著預(yù)測能力不足�。
7總結(jié)和展望
長效注射劑具有提高患者依從性���、減少給藥次數(shù)和延長作用時間等優(yōu)點,生物可降解的長效注射劑順應(yīng)了制劑向長效���、高效���、低毒發(fā)展的方向,正在成為國內(nèi)外新藥研發(fā)的熱點����。這些長效注射劑通常含有大量的強效治療藥物,任何意想不到的生物利用度變化都可能導(dǎo)致嚴(yán)重的毒副作用����,這使它們成為“高風(fēng)險”藥物制品[32]���。與口服制劑不同,由于長效注射劑釋放周期長���,缺乏標(biāo)準(zhǔn)的體外釋放評價方法,以及體內(nèi)釋放的復(fù)雜性���,使得長效注射劑IVIVC的建立具有較大挑戰(zhàn)。
長效注射劑的常見劑型和開發(fā)IVIVC模型的難點包括:①微球���,微球在體外/體內(nèi)釋放藥物的主要機制包括聚合物的侵蝕與降解、刺激響應(yīng)�、注射微環(huán)境調(diào)節(jié)���、藥物擴散����、水介導(dǎo)作用�、解吸�、聚合物修復(fù)以及從基質(zhì)內(nèi)部向外部介質(zhì)的溶解[61]。開發(fā)合適的具有區(qū)分性的模型來體現(xiàn)藥物先從微球表面突釋���,隨后再從微球核殼進行后續(xù)控釋,給有效的IVIVC帶來了挑戰(zhàn)[62]����。已獲批的微球制劑包括利培酮長效注射劑(Risperdal ConstaTM)�、醋酸亮丙瑞林長效注射劑(leupron depotTM)以及善寧長效注射劑(Sandostatin LARTM)等[62]���。②脂質(zhì)體�,脂質(zhì)體是基于脂質(zhì)的載體囊泡���,其形態(tài)上可能是單層膜�、多層膜或多囊泡結(jié)構(gòu),屬于獲批最為廣泛的長效注射劑之一���。藥物在脂質(zhì)體中的釋放情況取決于脂質(zhì)的性質(zhì)與組成、脂質(zhì)與被包封藥物之間的相互作用����、水相組成���、表面修飾以及滲透壓等����,此外,諸如流體動力學(xué)直徑����、ζ電位和形態(tài)等也會影響體內(nèi)/體外釋放[63]����。針對游離藥物含量以及體現(xiàn)藥物從脂質(zhì)載體各釋放階段的釋放曲線開發(fā)合適的區(qū)分模型給該類制劑有效的IVIVC帶來了挑戰(zhàn)[62]�。已獲批的脂質(zhì)體制劑包括給兩性霉素B脂質(zhì)體注射劑(Ambio someTM)����、鹽酸多柔比星脂質(zhì)體(DoxilTM)�、布比卡因脂質(zhì)體混懸液(ExparelTM)和伊立替康脂質(zhì)體注射液(OnivydeTM)等[62,64]�。③微乳制劑和油基注射用長效制劑����,微乳制劑和油基可注射長效制劑為疏水性藥物提供了合適的載體����。這些方法通常包括使用助溶劑�、表面活性劑和油來溶解甾體類藥物。此外�,還會采用化學(xué)修飾方法���,例如將藥物與癸酸鹽�、庚酸鹽�、己酸鹽等脂肪酸進行偶聯(lián)�,在皮下或肌內(nèi)注射后形成前藥控釋庫[65],開發(fā)此類制劑的IVIVC方法時����,應(yīng)考察藥物在油性賦形劑中的溶解情況�、前藥的水解潛能���、賦形劑的黏度、長效制劑的形成程度�、溶血潛能以及藥物從油相向周圍組織再進入血液的情況等因素[62]����。已獲批上市的制劑包括己酸羥孕酮(MakenTM)�、癸酸諾龍(Deca-DurabolinTM)、庚酸睪酮(XyostedTM)等[65]���。④長效混懸劑,將疏水性藥物利用助懸劑配制成混懸劑���。將此類藥物配制成微米級或納米級混懸劑會使其物理化學(xué)性質(zhì)發(fā)生變化,比如粒徑和溶解度等方面?���;诩{米化的納米晶技術(shù)TM已被用于制備長效非典型抗精神病藥善思達(Invega Sustenna?���,棕櫚酸帕利哌酮酯)[66]?���;钚运幬锏墓逃腥芙舛?��、酯前藥的水解速率�、粒徑以及溶解動力學(xué)是影響此類混懸劑體外釋放的重要體外參數(shù)[66]�。⑤長效水凝膠���,水凝膠(聚合物水凝膠和超分子水凝膠)是三維可膨脹的聚合物體系,適用于組織工程進行疏水性藥物的給藥[67]����。釋放曲線會受到不同機制的影響,包括從聚合物結(jié)構(gòu)中釋放(擴散控制���、溶脹控制、化學(xué)控制)����、從水凝膠包封顆粒中釋放藥物����、跨基質(zhì)擴散[67]����。建立此類藥物的IVIVC方法時需要著重考慮的因素包括多相體外釋放情況(突釋����、滯后階段和指數(shù)式釋放);聚合物及水凝膠的特性���、水凝膠的幾何形狀、藥物從基質(zhì)中的釋放情況�、內(nèi)部和外部粒徑、ζ電位�、溶脹率、水凝膠網(wǎng)孔特性���、藥物的疏水性等,都可能是此類制劑IVIVC建模時的速率控制因素[62���,67-68]。已上市藥物有布比卡因緩釋凝膠(Posidur?)等���。⑥原位凝膠植入劑,是一種新型的藥物遞送系統(tǒng)����,在生理條件下可發(fā)生相轉(zhuǎn)變���,從可流動的液體狀態(tài)轉(zhuǎn)變?yōu)榘牍腆w或固體凝膠狀態(tài)的植入劑。這種轉(zhuǎn)變使得藥物能夠在特定的部位緩慢釋放���,從而延長藥物的作用時間����。此類制劑藥物釋放通常有藥物擴散和聚合物降解或溶蝕兩種方式���,藥物從制劑釋放后轉(zhuǎn)移至周圍組織后進入血液[69]����。植入劑的釋放周期較長�,開發(fā)具有區(qū)分性和模擬性的IVIVC方法會比較困難,需要考慮聚合物特性���、尺寸�、孔隙率、形態(tài)以及表面電位�,還需要依據(jù)釋藥機制考察藥物從聚合物釋放的動力學(xué)來包含時間變量[70-72]���。
在我國目前的法規(guī)體系下,建立具有體內(nèi)外相關(guān)性的IVIVC模型一直是藥物研發(fā)與制劑開發(fā)領(lǐng)域的關(guān)鍵課題�。通過整合藥物體外釋放度試驗數(shù)據(jù)與體內(nèi)藥動學(xué)信息,IVIVC模型能夠為藥物產(chǎn)品的優(yōu)化���、質(zhì)量控制以及生物等效性預(yù)測提供重要依據(jù),開展IVIVC研究有助于降低長效注射劑的劑型風(fēng)險���。對于長效注射劑,每一個IVIVC都是個案化的�,全面系統(tǒng)地獲知藥物分子的理化性質(zhì)�、生物藥劑學(xué)性質(zhì)和制劑的處方設(shè)計及其與注射部位的交互作用,對于評估創(chuàng)建IVIVC的可行性���、分析體內(nèi)數(shù)據(jù)用于指導(dǎo)創(chuàng)建工作、設(shè)計具有預(yù)測性的體外釋放度試驗�、解釋預(yù)期和未預(yù)期的實驗結(jié)果都具有非常重要的作用�。
建立IVIVC模型的傳統(tǒng)的方法通?��;趯λ幬锏奈锢砘瘜W(xué)性質(zhì)、制劑特性以及生理藥動學(xué)過程的深入理解����,通過大量的實驗設(shè)計與數(shù)據(jù)采集來構(gòu)建模型�。實驗過程往往耗時費力����,需要大量的樣本與資源投入�。由于人體生理系統(tǒng)的復(fù)雜性以及藥物在體內(nèi)過程的多樣性�,準(zhǔn)確建立普適性強且具有高度預(yù)測性的IVIVC模型并非易事�。不同藥物的特性差異以及個體間的生理變異性都可能影響模型的準(zhǔn)確性與可靠性。人工智能技術(shù)的迅猛發(fā)展為高效建立IVIVC模型帶來了前所未有的機遇���,有望成為關(guān)鍵的突破口�。機器學(xué)習(xí)算法�,如人工神經(jīng)網(wǎng)絡(luò)、支持向量機等���,具備強大的模式識別與數(shù)據(jù)挖掘能力[73]。通過對海量的體外釋放數(shù)據(jù)�、體內(nèi)藥動學(xué)數(shù)據(jù)以及相關(guān)藥物與制劑信息進行學(xué)習(xí)與訓(xùn)練,人工智能模型能夠自動提取特征并建立復(fù)雜的非線性關(guān)系�,克服傳統(tǒng)方法在處理復(fù)雜數(shù)據(jù)時的局限性���。同時隨著精準(zhǔn)醫(yī)學(xué)的興起和對仿生溶出系統(tǒng)的深入研究(包括仿生溶出裝置和仿生介質(zhì)),未來基于人工智能的IVIVC模型可能會朝著個性化與精準(zhǔn)化的方向發(fā)展���。針對不同個體的生理特征、遺傳背景以及疾病狀態(tài)�,建立定制化的IVIVC模型[74]。人工智能技術(shù)可以通過分析大量個體臨床數(shù)據(jù)����,識別出影響藥物體內(nèi)過程的關(guān)鍵個體因素����,并將這些因素納入模型中�,實現(xiàn)對不同個體藥物吸收行為的精準(zhǔn)預(yù)測�。這將有助于在藥物研發(fā)和臨床治療中,為患者提供更個性化的藥物制劑選擇和給藥方案優(yōu)化,提高藥物治療的有效性和安全性���。