本文是翻譯自Medical Writing雜志2025年9月刊的文章����,文章邏輯通順,層層深入����,對(duì)廣大制造商來(lái)說(shuō)����,是絕佳的學(xué)習(xí)文章�����,文章doi號(hào)是10.56012/eqqu1042����,有興趣的朋友也可以搜索原文閱讀��。
本文從上市后臨床跟蹤在MDR法規(guī)下的要求����,以及其需持續(xù)驗(yàn)證器械的安全性與有效性進(jìn)行討論��;到PMCF實(shí)操時(shí)面臨困境�����,如傳統(tǒng)臨床試驗(yàn)數(shù)據(jù)難以覆蓋真實(shí)臨床場(chǎng)景的多元人群����,罕見(jiàn)病 / 兒科器械更是面臨數(shù)據(jù)招募難的難題等情況進(jìn)行說(shuō)明����;再到引入真實(shí)世界數(shù)據(jù)與真實(shí)世界證據(jù)作為PMCF工作的新通路�����,以 4 個(gè)典型實(shí)操案例進(jìn)行拆解��,層層深入RWD 如何賦能 PMCF��。
理解上市后臨床跟蹤的要求
上市后臨床跟蹤(PMCF)是MDR的重要組成部分����,旨在醫(yī)療器械進(jìn)入市場(chǎng)后持續(xù)評(píng)估其性能與安全性�����。這并非一次性活動(dòng)����,而是貫穿器械全生命周期的持續(xù)過(guò)程,為制造商提供更新的臨床證據(jù)以支持其器械符合監(jiān)管要求����。該過(guò)程還包括收集真實(shí)世界使用中的臨床數(shù)據(jù)����,以便在更廣泛患者群體中使用時(shí)進(jìn)一步評(píng)估器械性能。
監(jiān)管框架與要求
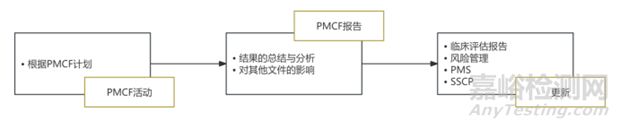
根據(jù)MDR�����,制造商必須建立并實(shí)施包含PMCF(上市后臨床跟蹤)作為關(guān)鍵要素的上市后監(jiān)督(PMS)體系�����。PMCF必須經(jīng)過(guò)規(guī)劃、系統(tǒng)化并形成文件��,明確目標(biāo)�����、方法論及需收集的臨床數(shù)據(jù)��。收集到的數(shù)據(jù)應(yīng)經(jīng)過(guò)分析�����,用于更新臨床評(píng)估�����、風(fēng)險(xiǎn)管理、PMS及其他文件(如適用時(shí)更新安全性和臨床性能摘要(SSCP))��。
圖1. PMCF與其他流程的緊密關(guān)聯(lián)縮寫(xiě)說(shuō)明:PMCF����,上市后臨床跟蹤����;PMS��,上市后監(jiān)督����;SSCP��,安全性與臨床表現(xiàn)摘要�����。
PMCF方法論
PMCF主要分為兩類:常規(guī)PMCF與特定PMCF。
常規(guī)PMCF指收集不針對(duì)特定臨床問(wèn)題����、作為常規(guī)PMS活動(dòng)一部分獲取的臨床數(shù)據(jù)�����。例如��,這類數(shù)據(jù)可能包括醫(yī)療保健專業(yè)人員的一般反饋��、系統(tǒng)文獻(xiàn)綜述信息或警戒數(shù)據(jù)庫(kù)數(shù)據(jù)�����。
另一方面��,特定PMCF指的是有針對(duì)性的活動(dòng)����,例如高質(zhì)量用戶調(diào)查�����、上市后研究或從器械登記系統(tǒng)收集數(shù)據(jù)��。這些活動(dòng)旨在解答特定問(wèn)題(例如臨床評(píng)估中的問(wèn)題),并填補(bǔ)醫(yī)療器械臨床證據(jù)的空白����。無(wú)論一般性還是特定性PMCF活動(dòng)�����,均須嚴(yán)格遵循MDR及其他國(guó)際/本地要求(如ISO 14155或GCP)進(jìn)行��,確保目標(biāo)明確�����、方法規(guī)范,并完整記錄����。
制造商還需確保將PMCF產(chǎn)生的任何臨床發(fā)現(xiàn)傳達(dá)給相關(guān)監(jiān)管機(jī)構(gòu)�����、利益相關(guān)方及設(shè)備使用者����。
當(dāng)真實(shí)世界數(shù)據(jù)發(fā)揮作用時(shí)
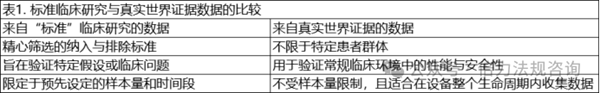
真實(shí)世界數(shù)據(jù)(RWD)已成為上市后階段的寶貴資源��,尤其在PMCF框架下。隨著醫(yī)療保健的發(fā)展和患者護(hù)理的日益復(fù)雜��,RWD能夠提供獨(dú)特見(jiàn)解����,揭示醫(yī)療器械在臨床研究受控環(huán)境之外����、跨不同患者群體和臨床場(chǎng)景使用時(shí)的安全性��、有效性和長(zhǎng)期性能表現(xiàn)。與前瞻性干預(yù)研究或隨機(jī)對(duì)照試驗(yàn)(RCT)不同����,RWD能反映更廣泛的人群特征�����,包括患有各種合并癥�����、不同程度疾病嚴(yán)重程度的患者����,以及傳統(tǒng)臨床試驗(yàn)中可能未能充分體現(xiàn)的其他因素����。使用真實(shí)世界數(shù)據(jù)可更準(zhǔn)確��、更全面地了解醫(yī)療器械在真實(shí)環(huán)境中的表現(xiàn)����,有助于發(fā)現(xiàn)上市前評(píng)估中可能未被發(fā)現(xiàn)的問(wèn)題。(見(jiàn)表 1)��。
真實(shí)世界數(shù)據(jù)類型
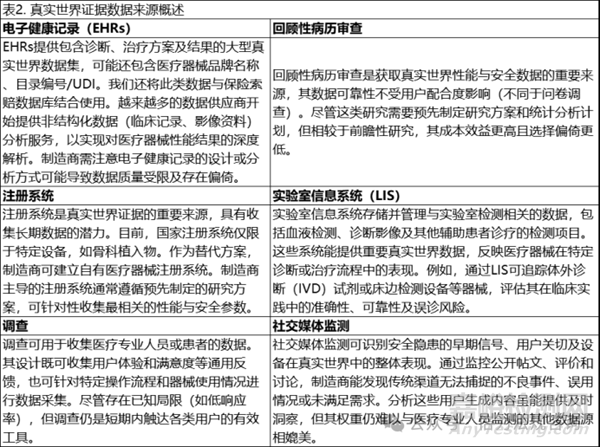
存在大量可被利用的真實(shí)世界數(shù)據(jù)來(lái)源�����,以支持PMCF活動(dòng)�����。表2展示了其中一些最廣泛使用的真實(shí)世界數(shù)據(jù)類型����。
RWD和RWE在醫(yī)療器械上市后作用
將真實(shí)世界數(shù)據(jù)整合到上市后監(jiān)督與跟蹤中,可實(shí)現(xiàn)對(duì)醫(yī)療器械安全性和性能的持續(xù)監(jiān)測(cè)�����。通過(guò)分析來(lái)自多種真實(shí)世界來(lái)源的數(shù)據(jù)�����,制造商能夠識(shí)別新出現(xiàn)的風(fēng)險(xiǎn)����、評(píng)估長(zhǎng)期性能��,并對(duì)產(chǎn)品或上市后監(jiān)督與跟蹤計(jì)劃進(jìn)行必要調(diào)整����。真實(shí)世界數(shù)據(jù)使監(jiān)管機(jī)構(gòu)能夠更全面地了解器械在不同患者群體和臨床環(huán)境中的表現(xiàn)。該數(shù)據(jù)還能彌補(bǔ)臨床研究數(shù)據(jù)的缺口�����,尤其適用于罕見(jiàn)病癥中具有獨(dú)特患者群體的器械��,確保監(jiān)管決策基于最佳可用證據(jù) 例如����,我們通常運(yùn)用真實(shí)世界數(shù)據(jù)支持極窄適應(yīng)癥(如關(guān)節(jié)內(nèi)延伸的股骨遠(yuǎn)端骨折)����。另一個(gè)重要用途是提供兒科數(shù)據(jù)�����。在這兩種情況下����,通過(guò)傳統(tǒng)臨床研究收集這些數(shù)據(jù)都將非常耗時(shí)(招募周期長(zhǎng)且研究站點(diǎn)少�����,兒科研究審批存在障礙)且成本高昂����。
案例研究1-真實(shí)世界證據(jù)的注冊(cè)系統(tǒng)
背景:某骨科植入物制造商(該類產(chǎn)品被視為中至高風(fēng)險(xiǎn)器械)希望利用公開(kāi)的關(guān)節(jié)假體注冊(cè)系統(tǒng)��,獲取其醫(yī)療器械的性能與安全性數(shù)據(jù)�����。國(guó)家關(guān)節(jié)注冊(cè)系統(tǒng)因其長(zhǎng)期隨訪數(shù)據(jù),已成為真實(shí)世界證據(jù)的重要來(lái)源尤其對(duì)骨科植入物領(lǐng)域具有重要價(jià)值��。
問(wèn)題:然而��,這些注冊(cè)機(jī)構(gòu)通常在其標(biāo)準(zhǔn)年度報(bào)告中不提供設(shè)備特定數(shù)據(jù)��,這限制了制造商評(píng)估和比較單個(gè)設(shè)備性能的能力�����。
解決方案:為解決此問(wèn)題�����,某骨科植入物制造商要求注冊(cè)機(jī)構(gòu)所有者提供兩份額外的器械特定報(bào)告:一份專注于其自有設(shè)備����,另一份針對(duì)基準(zhǔn)設(shè)備組。這些報(bào)告實(shí)現(xiàn)了與當(dāng)前技術(shù)水平的直接對(duì)比����,并將每年定期獲取。此舉提升了注冊(cè)庫(kù)作為持續(xù)真實(shí)世界證據(jù)來(lái)源的價(jià)值�����。
潛在挑戰(zhàn):小型注冊(cè)庫(kù)可能缺乏為制造商生成定制報(bào)告的資源,或拒絕提供對(duì)照產(chǎn)品的數(shù)據(jù)��。
案例研究2-真實(shí)世界證據(jù)的回顧性病歷審查
情況:某血管支架制造商(該產(chǎn)品被視為高風(fēng)險(xiǎn)器械)擁有強(qiáng)有力的臨床證據(jù)支持其在小腿動(dòng)脈中的應(yīng)用�����,這符合該產(chǎn)品部分預(yù)期用途�����。
問(wèn)題:該器械的廣泛適應(yīng)癥(包括大腿動(dòng)脈應(yīng)用)缺乏可靠臨床證據(jù),僅依賴零星病例報(bào)告。
解決方案:為彌補(bǔ)這一缺口��,制造商選定一家頻繁將支架用于大腿病變的醫(yī)院�����,對(duì)其數(shù)據(jù)庫(kù)進(jìn)行回顧性分析����,成功收集性能與安全性數(shù)據(jù)以支持更廣泛的適應(yīng)癥�����。
潛在挑戰(zhàn):這通常并非持續(xù)性活動(dòng)��,且單個(gè)中心可能無(wú)法提供足夠數(shù)量的病例來(lái)滿足特定適應(yīng)癥的需求�����。
案例研究3-真實(shí)世界證據(jù)的用戶調(diào)查
背景:某制造商提供低風(fēng)險(xiǎn)醫(yī)療器械����,主要作為介入手術(shù)的輔助設(shè)備使用�����。這些器械風(fēng)險(xiǎn)等級(jí)較低����,通常不會(huì)出現(xiàn)在科學(xué)文獻(xiàn)中。
問(wèn)題:鑒于其輔助功能和結(jié)構(gòu)簡(jiǎn)單性��,開(kāi)展臨床研究既不現(xiàn)實(shí)也非必要��,但制造商仍需性能和安全性數(shù)據(jù)來(lái)支持器械應(yīng)用。
解決方案:制造商采用簡(jiǎn)易病例報(bào)告表實(shí)施用戶調(diào)查����,要求在設(shè)備介入操作期間或結(jié)束后立即填寫(xiě)。該方法有效收集了技術(shù)性能及潛在安全事件的相關(guān)數(shù)據(jù)�����。鑒于設(shè)備特性及預(yù)期用途����,短期隨訪已足夠滿足需求。
潛在挑戰(zhàn):PMCF領(lǐng)域基于真實(shí)世界證據(jù)的用戶調(diào)查可能面臨應(yīng)答偏倚����、臨床深度不足及數(shù)據(jù)質(zhì)量不一等問(wèn)題,或?qū)⑾魅醢踩院托阅芊治龅目煽啃浴?/span>
案例研究4-真實(shí)世界證據(jù)的社交媒體監(jiān)測(cè)
背景:某可穿戴心臟監(jiān)測(cè)設(shè)備制造商旨在通過(guò)探索非傳統(tǒng)數(shù)據(jù)源來(lái)強(qiáng)化上市后監(jiān)督����。
問(wèn)題:盡管設(shè)有正式報(bào)告渠道��,部分用戶僅通過(guò)社交媒體平臺(tái)反饋設(shè)備問(wèn)題——如皮膚刺激或讀數(shù)不準(zhǔn)確����。這些信號(hào)被傳統(tǒng)PMS系統(tǒng)遺漏�����。
解決方案: 該制造商部署社交媒體監(jiān)測(cè)工具����,實(shí)時(shí)追蹤產(chǎn)品相關(guān)公開(kāi)內(nèi)容。此舉能早期識(shí)別重復(fù)性用戶投訴�����,進(jìn)而觸發(fā)對(duì)公開(kāi)文獻(xiàn)�����、投訴事件數(shù)據(jù)庫(kù)及其他來(lái)源的深度分析��。該方法既提升了患者安全性����,又為傳統(tǒng)PMS數(shù)據(jù)體系提供了補(bǔ)充。
潛在挑戰(zhàn):企業(yè)將社交媒體監(jiān)測(cè)納入整體藥物警戒戰(zhàn)略,可能比僅針對(duì)單一產(chǎn)品開(kāi)展PMCF監(jiān)測(cè)更具成本效益�����。