【引言】
2025年06月06日,輝瑞/Arvinas宣布已向FDA遞交PROTAC新藥Vepdegestrant的上市申請����,如果順利獲批����,將成為全球首款PROTAC新藥���。這是PROTAC藥物領(lǐng)域的里程碑,標(biāo)志著PROTAC概念誕生的20多年后����,這類創(chuàng)新療法將進入全新階段���,必將引發(fā)新一輪的關(guān)注熱潮。
【什么是PROTAC藥物】
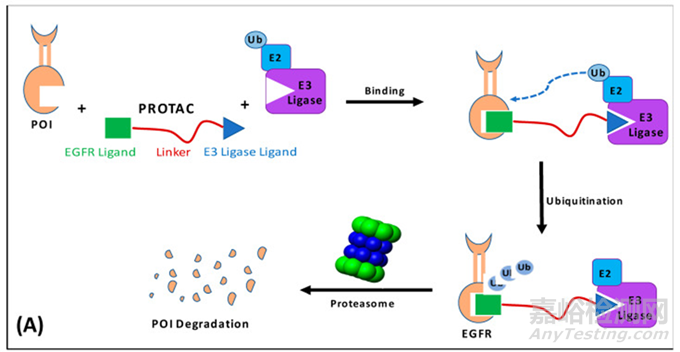
PROTAC藥物,全稱為蛋白降解靶向嵌合體(Proteolysis-Targeting Chimera)���,是一種新型的小分子藥物。其作用機制基于將靶蛋白募集到E3泛素連接酶進行泛素化標(biāo)記���,并最終實現(xiàn)蛋白質(zhì)的降解。PROTAC分子由三個關(guān)鍵部分組成:靶蛋白(POI)配體���、E3連接酶配體以及連接體����。靶蛋白配體負責(zé)特異性識別并結(jié)合目標(biāo)蛋白質(zhì),而E3連接酶配體則通過與特定的E3泛素連接酶結(jié)合����,促使目標(biāo)蛋白被泛素化標(biāo)記。隨后�,泛素化的目標(biāo)蛋白進入蛋白酶體系統(tǒng)���,最終被降解為短肽或氨基酸,如圖1所示�。
圖1:PROTAC藥物組成及作用機制【文獻1】
【PROTAC藥物發(fā)展歷史】
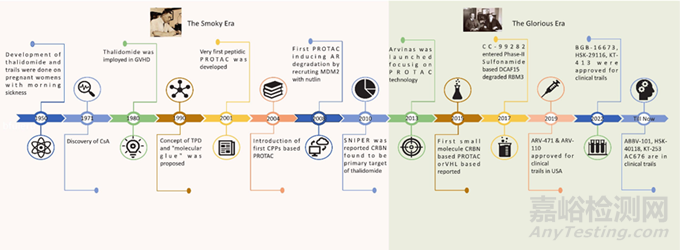
①2001年,概念提出
Craig M. Crews團隊首次提出PROTAC概念����,利用細胞內(nèi)天然的泛素-蛋白酶體系統(tǒng)(UPS)實現(xiàn)目標(biāo)蛋白的靶向降解,標(biāo)志著藥物研發(fā)從傳統(tǒng)“抑制蛋白功能”轉(zhuǎn)向“直接清除致病蛋白”的全新思路�。
②2008年:首個小分子PROTAC設(shè)計
科學(xué)家成功設(shè)計出基于VHL和CRBN的小分子PROTAC,突破了早期多肽結(jié)構(gòu)PROTAC的穩(wěn)定性差���、難以入胞等限制�,為PROTAC的臨床轉(zhuǎn)化奠定了基礎(chǔ)�。
③2015年:動物體內(nèi)驗證
首次在動物體內(nèi)驗證了小分子PROTAC的蛋白降解能力�,證明其在活體環(huán)境中的有效性���,為后續(xù)臨床研究提供了關(guān)鍵支持�。
④2019年:進入臨床試驗
首個PROTAC藥物ARV-110(靶向雄激素受體AR)進入臨床試驗,標(biāo)志著PROTAC正式從實驗室邁向臨床階段����,開啟了PROTAC的臨床轉(zhuǎn)化時代����。
⑤2020年:臨床概念驗證
ARV-110和ARV-471(靶向雌激素受體ER)的I期臨床試驗初步數(shù)據(jù)表明����,PROTAC在人類身上具有良好的耐受性�、靶蛋白降解能力和抗腫瘤活性�,驗證了PROTAC的臨床可行性����。
⑥2021年:多款PROTAC進入臨床
至少15個靶向性PROTAC藥物進入臨床階段�,覆蓋癌癥�、自身免疫性疾病等多種適應(yīng)癥���,PROTAC領(lǐng)域進入快速發(fā)展期�。
⑦�;2025年:首個PROTAC新藥申請
Vepdegestrant(ARV-471)的新藥申請(NDA)獲美國FDA受理,若獲批將成為首個上市的PROTAC藥物����,標(biāo)志著PROTAC技術(shù)從理論到臨床應(yīng)用的全面突破。
圖2: PROTAC 的發(fā)展時間線【文獻2】
【PROTAC藥物優(yōu)勢】
PROTAC的臨床前研究和臨床研究均表明:PROTAC具有較傳統(tǒng)小分子藥物更強的靶向性和更廣泛的適應(yīng)證����,并且有著前所未有的優(yōu)勢和特點,如圖3所示�。【文獻5】
圖3 PROTAC相交于其他治療策略的優(yōu)勢
【PROTAC藥物存在問題】
PROTAC藥物因其獨特的結(jié)構(gòu)設(shè)計����,通常由靶蛋白配體�、E3連接酶配體和連接鏈三部分組成�,這種復(fù)雜的結(jié)構(gòu)導(dǎo)致了其相對分子質(zhì)量較大。普遍違背類藥五規(guī)則中的多項指標(biāo)�,即當(dāng)化合物結(jié)構(gòu)具有5個以上的氫鍵供體����、超過10個氫鍵受體、分子量大于500�、log P大于5或可旋轉(zhuǎn)鍵大于10時,化合物很可能具有較差的吸收或滲透性���。PROTAC分子量高(一般在700-1200 Da之間)����、溶解度差���、滲透性低���,這些都使得部分候選藥物的口服生物利用度偏低,為提高體內(nèi)口服生物利用度帶來挑戰(zhàn)���,進一步為臨床轉(zhuǎn)化和商業(yè)成功帶來了障礙����。為此,研發(fā)人員必須優(yōu)化PROTAC的物理化學(xué)和藥代動力學(xué)性質(zhì)����。
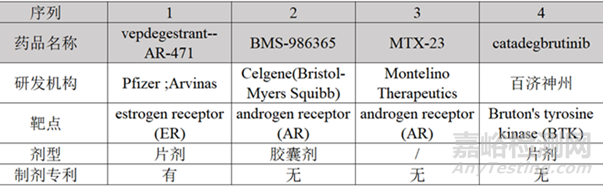
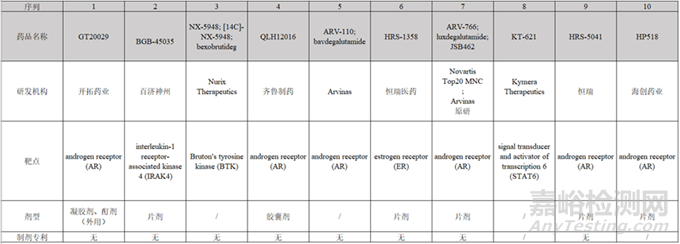
2、目前上市和臨床2期之后PROTAC藥物劑型
為了解目前主流PROTAC藥物的劑型情況���,搜索了處于臨床Ⅱ期及之后階段的藥物�,結(jié)果如圖3和圖4所示���,大部分PROTAC藥物為口服藥物���,劑型為片劑或膠囊劑,但是只有申請上市的藥物AR-471有較明確的制劑專利���。
圖3:申請上市和處于臨床Ⅲ期PROTAC藥物的劑型及制劑專利
圖4:處于臨床Ⅱ期PROTAC藥物的劑型及制劑專利
3����、藥物合成的結(jié)構(gòu)優(yōu)化是解決PROTAC藥物問題的主流手段
當(dāng)前���,制劑研發(fā)在PROTAC藥物開發(fā)流程中的參與度相對較低���,通常被視為后期輔助性工作����。而藥物合成階段在PROTAC藥物的開發(fā)中扮演著至關(guān)重要的角色���,尤其是在提升藥物生物利用度和穩(wěn)定性方面。通過結(jié)構(gòu)優(yōu)化等手段�,研究人員能夠顯著改善PROTAC藥物的性能。例如:①優(yōu)化連接子結(jié)構(gòu)����,提高PROTAC滲透性和代謝穩(wěn)定性將柔性聚乙二醇(PEG)替換為剛性芳環(huán),顯著降低TPSA�、提高clogP。剛性疏水連接子(如芳環(huán)����、螺環(huán))可平衡滲透性,提升藥物分子與靶標(biāo)結(jié)合的能力�,突破傳統(tǒng)PEG連接子的高TPSA-低clogP 瓶頸;MW控制(<900)進一步規(guī)避大分子 PROTAC 的遞送限制�。②減少E3 泛素連接酶配體的相對分子質(zhì)量PROTAC 的性質(zhì)與所選E3泛素連接酶配體的類型密切相關(guān)���。目前,臨床試驗的口服PROTAC全部為CRBN配體���。與VHL配體相比����,CRBN配體體積較小�,MW更低,這使得含CRBN 配體的PROTAC 在口服吸收方面具有更好的生物利用度���。③探索新型E3 泛素連接酶配體�。④此外���,計算機輔助設(shè)計技術(shù)的應(yīng)用進一步推動了PROTAC分子的優(yōu)化過程����。例如���,基于神經(jīng)網(wǎng)絡(luò)的預(yù)測系統(tǒng)可用于篩選具有良好降解效果的分子����,從而提高藥物研發(fā)的成功率,并縮短研發(fā)周期����。因此,藥物合成階段不僅是PROTAC藥物開發(fā)的核心環(huán)節(jié)���,也是解決其生物利用度和穩(wěn)定性問題的關(guān)鍵所在���。
4、制劑研發(fā)在提高PROTAC藥物生物利用度中所做的努力
目前制劑在PROTAC藥物提升生物利用度方面的作用絕大多數(shù)還在很早期的階段�,有一些研究人員豐富了生物利用度的判斷標(biāo)準、也有一些學(xué)者���,通過固體分散體技術(shù)、新型的遞送系統(tǒng)等����,在提升PROTAC藥物生物利用度方面取得了一定的成績。
4.1����、優(yōu)化化合物生物利用度處方前判斷依據(jù)
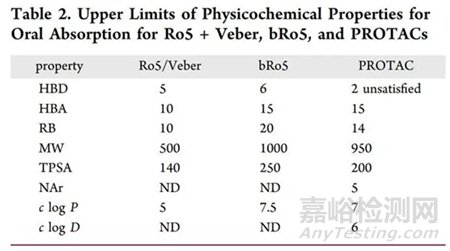
Keith R. Hornberger與Erika M. V. Araujo在文獻中【文獻6】根據(jù) Arvinas 數(shù)據(jù)庫中1806 個 PROTAC 化合物的物理化學(xué)性質(zhì)和大鼠IV 和 POPK 數(shù)據(jù)在傳統(tǒng)的 Ro5和超越五法則(bRo5)基礎(chǔ)上,展示了 PROTAC 在這些經(jīng)驗定義的化學(xué)空間區(qū)域中口腔吸收截止值的����,位置如圖5所示���。該規(guī)則為后續(xù)口服 PROTAC 的設(shè)計提供了思路和指導(dǎo)。
圖5: Ro5�、bRo5、PROTAC口服吸收的理化性質(zhì)上限
4.2����、隨餐給藥改善溶解度
Pike等在臨床研究中發(fā)現(xiàn),溶解度是PROTAC類藥物口服生物利用度的核心決定因素�。例如,ARV-110在空腹模擬腸液中溶解度僅為0.01g/L�,但餐后含膽汁鹽的腸液使其溶解度激增120倍至1.2g/L,膠束粒徑從150nm縮小至20nm����,跨膜效率顯著提升;動物實驗數(shù)據(jù)顯示����,隨高脂飲食給藥后,ARV-110的Cmax和AUC均提高2.8倍���,生物利用度從4.2%升至11.8%�。機制分析表明,膽汁鹽通過形成納米膠束降低臨界膠束濃度�,突破藥物溶解閾值,并通過小粒徑膠束增強胞吞作用���。這一結(jié)果提示 PROTAC 在進食后給藥可能會獲得更好的體內(nèi)藥物暴露����。ARV-110和ARV-471的臨床試驗設(shè)計也揭示了這2種PROTAC分子的Ⅰ期臨床給藥模式為每日1次����,隨餐給藥,這種給藥模式為提高口服生物利用度提供了參考���。
4.3����、固體分散體ASD
Postgese 及其同事探索了通過固體分散體(ASD)來提升PROTAC ARCC-4的溶解度���。使用Eudragit® L 100-55(EL 100-55)和HPMCAS(L 級)為聚合物,通過真空壓縮成型(VCM)制備ASD����,在整個溶解期內(nèi)實現(xiàn)了 ARCC-4 顯著的過飽和且無沉降����?!疚墨I6】
深圳市藥欣生物科技有限公司在其專利中,用無定形固體分散體(ASD)改善ARV-110和ARV-471口服利用度����,使用HPMCAS與磷脂制備三元SD,把ARV-471口服生物利用度F%由16%提高到40%���,����,將ARV-110的口服生物利用度由19%提高到是92%�。【文獻7】
4.4�、仿生納米顆粒
由于 PROTAC 膜穿透力差以及非靶向遞送可能導(dǎo)致不想要的“離靶”副作用,將這些細胞降解效應(yīng)轉(zhuǎn)化為臨床應(yīng)用一直困難�。范等人成功開發(fā)了一種智能納米藥物遞送系統(tǒng)(CM8988-PIPD),采用仿生策略進行PIPD的靶向遞送�。仿生納米顆粒展現(xiàn)出明顯的球形結(jié)構(gòu),平均尺寸約為124.8納米�。用癌細胞膜包覆納米顆粒,使 CM8988-PIPD 在體內(nèi)具有優(yōu)異的血清穩(wěn)定性、受控的藥物釋放特性����、良好的生物相容性和免疫相容性,以及增強了同源 PC 細胞的靶向能力
4.5����、自乳化藥物遞送系統(tǒng)
Rathod 等人利用 ARV-825 作為 PROTAC 分子開發(fā)了 PROTAC 載荷自納米乳化預(yù)濃縮液,顯著提升了在水溶液和生物相關(guān)培養(yǎng)基中的溶解度���。
4.6�、創(chuàng)新性遞送機制
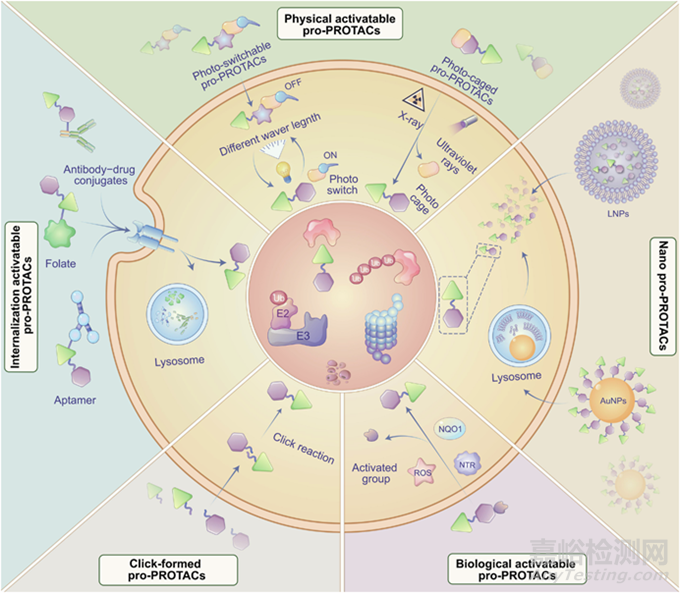
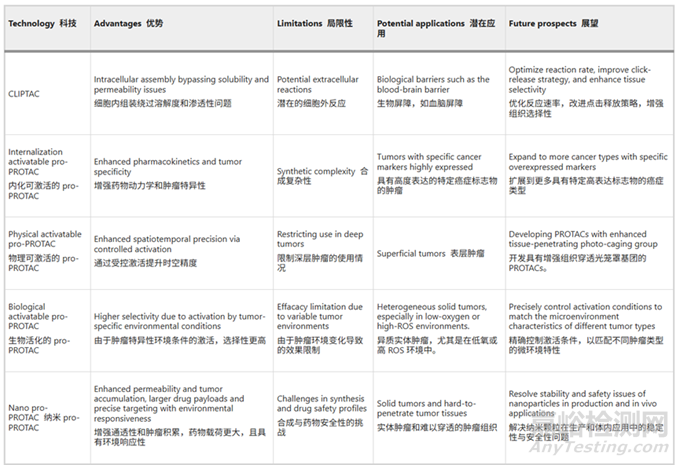
大分子藥物的有效性通常受限于其細胞膜通透性較差�。除了PROTAC進行結(jié)構(gòu)改造以增強這一特性外,持續(xù)的研究還集中在開發(fā)創(chuàng)新的配方和遞送機制(見圖6���、圖7)���。【文獻4】開發(fā)PROTACs"前藥"(pro-PROTAC)的新興策略�,通過提供PROTAC分子的可控釋放來解決其固有局限性,從而增強靶向暴露并可能擴展這一突破性技術(shù)的臨床應(yīng)用���。目前較新的PROTAC前藥有光控-PROTACs、細胞內(nèi)點擊形成的蛋白水解靶向嵌合體 (CLIPTAC)����、葉酸 PROTAC�、活性氧(ROS)PROTAC���、缺氧激活的 PROTAC���、放療激活的 PROTAC (RT-PROTAC)、半導(dǎo)體聚合物納米 PROTAC (SPNpro)���、聚合Poly-PROTAC等【文獻1】
圖6:PROTACs"前藥"(pro-PROTAC)策略
圖7:PROTACs"前藥"(pro-PROTAC)策略的優(yōu)缺點
總結(jié)
PROTAC技術(shù)平臺作為靶向蛋白降解領(lǐng)域的革命性突破,展現(xiàn)出巨大的臨床轉(zhuǎn)化前景�。隨著CRBN/VHL等新型E3連接酶配體的發(fā)現(xiàn)和分子設(shè)計技術(shù)的進步,越來越多的PROTAC候選化合物正加速進入臨床研究階段����,預(yù)示著該領(lǐng)域即將迎來爆發(fā)式發(fā)展。然而����,我們必須清醒認識到,PROTAC藥物固有的理化特性缺陷—尤其是分子量過大導(dǎo)致的低生物利用度問題���,仍然是制約其臨床轉(zhuǎn)化的關(guān)鍵瓶頸���。這一挑戰(zhàn)需要研發(fā)人員持續(xù)關(guān)注并系統(tǒng)優(yōu)化:一方面要繼續(xù)深化結(jié)構(gòu)改造策略�,包括連接子工程�、配體優(yōu)化等分子層面的創(chuàng)新;另一方面更要重視制劑技術(shù)的協(xié)同突破����,通過固體分散體、納米遞送系統(tǒng)����、前藥設(shè)計等多元化手段提升藥物的溶解性和吸收效率。只有將結(jié)構(gòu)優(yōu)化與制劑開發(fā)緊密結(jié)合���,形成"分子設(shè)計-劑型優(yōu)化"的全鏈條研發(fā)體系����,才能真正釋放PROTAC技術(shù)的治療潛力����,為患者帶來更多突破性療法。
參考文獻
【文獻1】Recent Advances in the Development of Pro-PROTAC for Selective Protein Degradation�。Fady Hakem 1, Ahmad Abdelwaly
【文獻2】Design and development of PROTACs: A new paradigm in anticancer drug discovery�。Vishal Mathur , Mukund Jha
【文獻3】PROTAC Degraders in Clinical Trails: 2025 Update���。
【文獻4】Targeted protein degradation: advances in drug discovery and clinical practice。Guangcai Zhong, Xiaoyu Chang
【文獻5】口服蛋白降解靶向嵌合體藥物的研究進展
【文獻6】Physicochemical Property Determinants of Oral Absorption for PROTAC Protein Degraders
【文獻7】專利:PROTAC化合物的藥物組合物及其用途�;CN 119604285 A